肽鏈的折疊方式不是蛋白質多樣性的直接原因*
羅 怡 徐秋夢 李德紅
人教版高中生物學教材《分子與細胞》第2 章第2 節“生命活動的主要承擔者——蛋白質”關于蛋白質結構及其多樣性的敘述是:“在細胞內,每種氨基酸的數目成百上千,氨基酸形成肽鏈時,不同種類氨基酸的排列順序千變萬化,肽鏈的盤曲、折疊方式及其形成的空間結構千差萬別,因此蛋白質分子的結構是極其多樣的。這就是細胞中蛋白質種類繁多的原因”[1]。 相應的教師用書有關敘述實質等同:“由于氨基酸種類、排列順序和肽鏈數目及空間結構的不同,就形成了分子結構不同的蛋白質”[2]。 該教師用書對蛋白質分子結構的4 個層次僅做簡單介紹,未闡述4 個層次間的形成關系及一級結構對高級結構的決定作用。很多高中生物學教師據此總結:“蛋白質的氨基酸種類、數目、排列順序及肽鏈的折疊方式(蛋白質的空間結構)是造成蛋白質結構和功能多樣性的直接原因。 ”肽鏈的折疊方式,即蛋白質的空間結構,是引起蛋白質結構與功能多樣性的直接原因嗎?在肽鏈一級結構確定的情況下,其盤曲折疊方式還具有較大多變性嗎?若同一肽鏈有多種折疊方式,還能通過有關軟件,利用其一級結構準確預測其高級結構嗎?
1 蛋白質的分子結構
“結構與功能觀”是極其重要的生命觀念之一。蛋白質分子具體且專一的結構決定其功能,不同類型的蛋白質執行不同的功能。 蛋白質的結構包括一級、二級、三級和/或四級等多個結構層次。
一級結構為氨基酸組成及其排列順序,是最基本的結構。 此外,二硫鍵也參與一級結構的形成,例如胰島素蛋白分子由A、B 2 條肽鏈形成,A鏈內部有一個鏈內二硫鍵,A、B 鏈之間通過2 個二硫鍵連接[3]。因此氨基酸種類、數目和排列順序的不同會直接導致蛋白質結構的不同從而影響其功能。 例如人教版高中生物學教材《遺傳與進化》第5 章第1 節“基因突變和基因重組”提到:血紅蛋白分子中的一個谷氨酸被纈氨酸替換,使得該蛋白質結構發生變化,由圓盤狀變成鐮刀狀,從而失去攜氧功能導致鐮刀型貧血癥[4]。
主鏈上一個氨基酸的羰基氧和另一個氨基酸的亞氨基形成氫鍵,致使一級結構中部分肽鏈發生卷曲或折疊形成二級結構,常見有α 螺旋(αhelix)、β 折疊(β-sheet)、β 轉角(β-turn)、β 凸起(β-bulge)和無規則卷面等幾種類型[5]。 若干個相鄰的二級結構元件組合在一起,形成種類不多的、有規則的超二級結構,如αα、βαβ、ββ。 在二級結構或超二級結構的基礎上形成相對獨立的緊密球狀實體,稱為結構域,它是球狀蛋白的獨立折疊單位[6]。一條肽鏈在二級結構、超二級結構和結構域的基礎上構建形成的包括主鏈和側鏈在內的總三維結構,稱為三級結構。
許多蛋白質分子含有多條相同或不同的具有完整三級結構的肽鏈,每條肽鏈稱為蛋白質分子的亞基,例如血紅蛋白便是由2 種亞基、每種各2個組成。 蛋白質分子中各亞基通過非共價鍵形成的空間構象稱為四級結構,涉及亞基的數目、種類以及各亞基在整個分子中的空間排布[6]。可見,氨基酸序列從非折疊狀態到折疊狀態的復雜變化都基于蛋白質內部分子間和分子內原子間的相互作用。 因此,氨基酸序列已確定的多肽鏈,其折疊變化并非隨意多樣。
2 蛋白質的質量控制系統
通過特殊途徑折疊的蛋白質執行著非常專一的功能。蛋白質的空間結構一旦折疊錯誤,便將喪失其生物學功能,甚至引起疾病。為防止蛋白質結構的形成發生錯誤,細胞具有保證蛋白質正常功能的多層次“質量控制系統”,以保證在細胞生命過程中蛋白質表達的精確性[7]。
該系統包括DNA 復制的質量控制、翻譯過程中的質量控制、翻譯后的質量控制。 其中,翻譯后的質量控制過程與蛋白質的折疊相關。 一些化學損傷、 熱休克及其他刺激可以引起翻譯完成后的蛋白質失活、去折疊或者錯誤折疊[8]。此時翻譯后的質量控制一方面可通過分子伴侶與不能自發折疊的蛋白質結合,以幫助其正確地折疊;另一方面可利用細胞質中能量依賴的蛋白酶清除那些損傷不可逆的錯誤折疊蛋白,以保證細胞生命活動有條不紊地進行。 這也是為何蛋白質空間結構不具有隨意性的另一個原因: 蛋白質一旦發生錯誤折疊,細胞便會通過翻譯后的質量控制系統糾正或清除錯誤折疊蛋白。假若翻譯后的質量控制失敗,錯誤折疊的蛋白質積累,其濃度到達臨界值時便會沉積產生淀粉樣沉淀導致多種疾病,稱為淀粉樣變病。 常見的淀粉樣變病見表1。
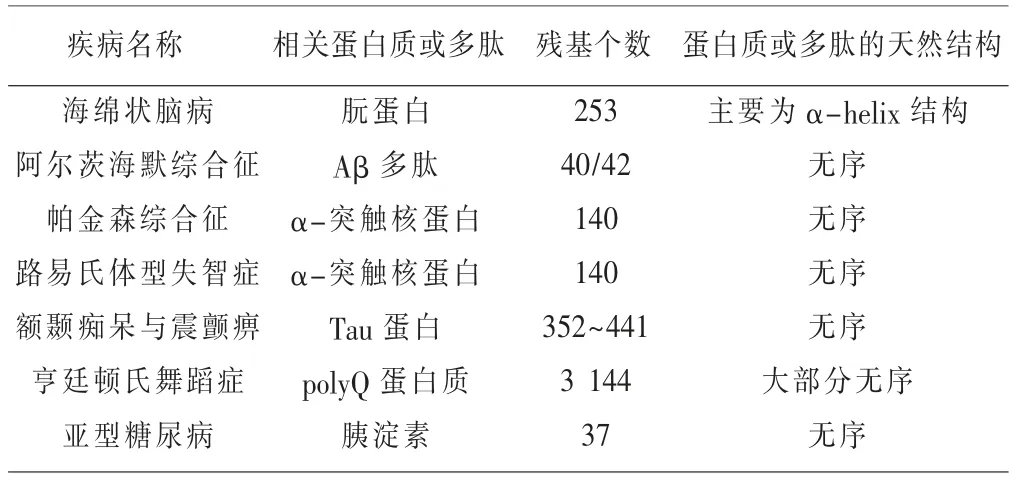
表1 常見的淀粉樣變病[9]
3 同源建模法預測蛋白質的三維構象
1961年Anfinsen 等在實驗的基礎上提出蛋白質序列決定其空間結構的著名論斷——在給定環境下蛋白質折疊所需的全部信息都包含在其氨基酸序列中,并因此獲得諾貝爾獎[10]。 在生物的進化過程中,蛋白質的三維結構也比一級結構更保守[11]。 因此在計算機、物理、數學等多學科共同參與下,以蛋白質的一級結構氨基酸序列為起點,三維結構為目標的蛋白質結構預測方法得以發展,成為生物信息學的核心研究內容之一。 該方法能有效幫助細胞和分子生物學家探索從氨基酸序列到蛋白質空間結構的編碼關系(被稱為第二遺傳密碼[3])。同源建模法是一種較成熟的蛋白質預測方法,它根據結構已知的蛋白質家族成員(模板),通過分子動力學模擬方法和建模軟件預測新序列的結構,從而建立序列與結構之間的編碼關系。 該方法之所以行之有效,也是因為蛋白質空間結構具有很強的保守性,其折疊子(包括二級結構單元、二級結構單元間的相對排布位置關系及多肽鏈的整體走向)的總數目和類型是很有限的[12]。
眾多學者對自然界可能存在的折疊子數目作了估計,我國的王志新院士認為僅存在654 種折疊子[13]。 若蛋白質的空間結構在其一級結構確定的情況下也同氨基酸序列一樣具有巨大的可變性,這一涵蓋了多個研究領域的第二遺傳密碼的研究方法就缺乏理論基礎和事實依據。 只能先分離提純蛋白質,然后利用蛋白質空間分析技術,例如核磁共振技術、X 射線晶體衍射法等費時費力的傳統方法才可能了解其空間結構。
4 啟示
綜上所述,肽鏈的折疊方式(蛋白質的空間結構)并不是引起蛋白質結構和功能多樣性的直接原因。當氨基酸序列確定的情況下,肽鏈的折疊方式在很大程度上已經被確定,比氨基酸序列的組成更具有保守性。即便發生錯誤折疊,蛋白質分子也會被細胞的蛋白質質量控制系統糾正或者降解清除。若質量控制失敗,錯誤折疊的蛋白質便會引起疾病。 而從氨基酸序列出發利用分子力學模擬方法通過建模軟件預測出蛋白質的三維構象這一研究技術,也從側面印證了一條多肽鏈的折疊方式是保守的,并不具隨意性、多樣性。
關于蛋白質結構和功能多樣性的直接原因,教材和教師教學用書對該知識點的編寫有些簡單籠統,教師容易形成錯誤認知。筆者在知網以“蛋白質結構”為主題檢索發現,在與中學生物學教學相關的期刊雜志中發表的論文多涉及蛋白質結構層次,卻鮮有相關論文針對蛋白質結構多樣性原因的認識誤區進行剖析。 可見,有些高中生物學教師是割裂地理解蛋白質結構多樣性的原因和蛋白質的結構層次這2 個知識點,忽視了二者的關聯性。
類似這樣片面地理解知識,忽視了知識與知識間的聯系,作為知識的傳授者要盡力注意和避免。 教師應增加對知識的理解深度,能由此及彼、由表及里地關注到知識點間的關聯,進而完善自身的專業知識系統,這也有助于教師更好地展開教學,提高教學的科學性。

