響應面法優(yōu)化馬鈴薯莖段高效再生體系
江林娟,鄒 雪,黃雪麗,倪 蘇,李立芹,楊世民,2,*
(1.四川農業(yè)大學 農學院,四川 成都 611130;2.四川農業(yè)大學 作物科學國家級實驗教學示范中心,四川 成都 611130)
響應面法優(yōu)化馬鈴薯莖段高效再生體系
江林娟1,鄒 雪1,黃雪麗1,倪 蘇1,李立芹1,楊世民1,2,*
(1.四川農業(yè)大學 農學院,四川 成都 611130;2.四川農業(yè)大學 作物科學國家級實驗教學示范中心,四川 成都 611130)
摘 要:為了探討馬鈴薯莖段愈傷組織高效再生的最佳激素濃度配比,建立馬鈴薯組織培養(yǎng)和快速繁殖技術新體系,以馬鈴薯品種川芋10號莖段為外植體誘導的愈傷組織為材料,通過采用響應面方法(RSM)中的Box-Behnken設計方法,研究TDZ、2,4-D、GA3濃度對馬鈴薯莖段愈傷組織芽分化的影響,優(yōu)化馬鈴薯愈傷組織芽分化的最佳激素配比。結果表明,從響應面法優(yōu)化所得模型可知,培養(yǎng)基中的激素濃度變化對馬鈴薯愈傷組織出芽敏感性TDZ>GA3>2,4-D;所得模型的決定系數(shù)R2為0.9921,確定了川芋10號莖段愈傷組織芽分化最佳培養(yǎng)基為MS+2.02mg·L-1TDZ+0.08mg·L-12,4-D+2.25mg·L-1GA3,在此條件下,實際測得的平均出芽率與預測值基本一致,證實了該模型的有效性。
關鍵詞:馬鈴薯;愈傷組織;響應面法;培養(yǎng)基
馬鈴薯(SolariumtuberosumL.)是世界四大糧食作物之一,屬糧菜兼用型作物,也是植物組織培養(yǎng)和細胞培養(yǎng)的模式作物。目前,馬鈴薯愈傷組織再生體系的研究較多,普遍采用正交試驗設計不同激素配比歸納出最優(yōu)組合[1-2],但無法確定整個區(qū)域上因素的最優(yōu)條件與響應值。響應面法在試驗條件優(yōu)化過程中可以連續(xù)地對試驗因素的各個水平進行分析,克服了正交試驗只能對一個個孤立的試驗點進行分析和不能給出直觀圖形的缺陷[3]。筆者采用響應面法優(yōu)化馬鈴薯莖段愈傷組織再生體系,為提高馬鈴薯愈傷組織再生效率,縮短培養(yǎng)時間,尋找更優(yōu)的試驗設計方法。
響應面分析法(response surface methodology,RSM)是近幾年來國外工作者常用的實驗設計和優(yōu)化法,使用方便,優(yōu)選條件預測性好[4-5],已在植物愈傷組織研究中廣泛應用。Abbasi等[6]通過運用響應面法獲得誘導和分化大豆愈傷組織的最佳培養(yǎng)基激素配比。Bagherieh等[7]運用響應面法設計研究滇紫草愈傷組織繼代培養(yǎng)基體系。川芋10號具有單株產量高,生育期短,植株健壯,不易倒伏,鮮薯品質優(yōu),塊莖休眠期較長,較耐貯,淀粉含量高等優(yōu)點[8-9]。本研究應用響應面法中的Box-Behnken設計方法對影響川芋10號馬鈴薯愈傷組織芽分化的激素配比的培養(yǎng)條件進行優(yōu)化,建立川芋10號馬鈴薯組織培養(yǎng)的技術體系,以期為其他植物再生體系的構建提供一定借鑒。
1 材料與方法
1.1 材料
1.1.1 供試苗
馬鈴薯品種川芋10號脫毒試管苗,由四川農業(yè)大學農學院馬鈴薯研究開發(fā)中心提供。
1.1.2 試劑
所用植物生長調節(jié)劑(plant growth regulator,PGR)包括:6-芐氨基腺嘌呤(6-benzylaminopurine,6-BA)、噻苯隆(thidiazuron,TDZ)、赤霉素(gibberellin acid A3,GA3)等購自Sigma公司,萘乙酸(1-naphthaleneacetic acid,NAA)、2,4-二氯苯氧基乙酸(2,4-dichlorophenoxyacetic acid,2,4-D)和MS培養(yǎng)基(含3%蔗糖,0.6%瓊脂),各成分均為國產分析純。
1.2 方法
1.2.1 培養(yǎng)條件
以MS為基本培養(yǎng)基(pH5.8),培養(yǎng)溫度為(22±2)℃,光照條件為日光燈光強1500~2000μmol·m-2·s-1,光照時間14h·d-1,黑暗10h·d-1。
1.2.2 愈傷組織的誘導
挑選生長健壯,長勢相當?shù)?0d左右脫毒馬鈴薯品種試管苗,取不帶側芽的莖段0.5cm左右,接種于愈傷組織誘導培養(yǎng)基MS+1.5mg·L-16-BA+0.4mg·L-1NAA+0.2mg·L-12,4-D,以平鋪方式培養(yǎng),每瓶接種10個莖段,接種150瓶,暗培養(yǎng)7d后見光培養(yǎng)。莖段誘導培養(yǎng)3、7、14d觀察記錄愈傷組織生長情況。根據(jù)愈傷組織形成情況,分別于7、14d考察愈傷組織數(shù)量、長勢、顏色與狀態(tài),并統(tǒng)計愈傷組織誘導率、愈傷組織鮮質量增長率。
1.2.3 不同激素配比對愈傷組織芽分化的影響
采用響應面方法中的Box-Behnken設計,對影響馬鈴薯莖段愈傷組織再生體系的關鍵因素進行研究和探索,以獲得芽分化最佳的條件參數(shù)。基于前期單因素預試驗,得知影響馬鈴薯莖段愈傷組織芽分化率的激素有TDZ、2,4-D、GA3。本研究采用三因素三水平的響應面分析方法進行試驗,以TDZ、2,4-D、GA3的3種激素的濃度為3個因素,以愈傷組織出芽率為響應值(表1),根據(jù)中心組合(Box-Behnken)試驗設計原理,確定愈傷組織分化培養(yǎng)中激素組合的最佳配比。挑選生長旺盛、結構疏松的新鮮愈傷組織轉移到不同激素配比的分化培養(yǎng)基上,每個處理接種8瓶,每瓶8個外植體,見光培養(yǎng)。分化培養(yǎng)30d后觀察記錄愈傷組織生長情況,以芽長度大于0.5cm的愈傷組織數(shù)量來統(tǒng)計不同培養(yǎng)基愈傷組織出芽率,討論這3種激素不同濃度組合對愈傷組織分化的影響。
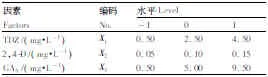
表1 Box-Behnken設計因素與水平
1.2.4 最佳激素的配比及驗證
為進一步確定最佳的激素濃度,在模型濃度范圍內選擇出發(fā)點,按照模型使用快速上升法優(yōu)化,可得愈傷組織芽分化的最佳激素配比。用模型的最佳激素配比培養(yǎng)愈傷組織,來驗證該模型的有效性。分化培養(yǎng)20d愈傷組織于OLYMPUS SZX7體視顯微鏡(目鏡10倍,物鏡5.6倍)下觀察,OLYMPUS DP26成像系統(tǒng)拍照,ACDSee 3.1軟件獲取圖片。
1.2.5 再生植株的生根培養(yǎng)
待愈傷組織上的不定芽長到1~2cm時,將其剪下,置于MS培養(yǎng)基中生根培養(yǎng),14d后觀察植株生長情況。
2 結果與分析
2.1 愈傷組織誘導及生長狀況
試驗結果顯示,接種莖段2~3d后,莖段兩端切口處便明顯膨大,可見到有淡黃色愈傷組織出現(xiàn),其后愈傷組織沿維管束向莖段中間生長,7d左右的愈傷組織即可長滿莖段表面,誘導率高達90.55%;14d左右的愈傷組織從外觀上出現(xiàn)了較大的變化,顏色由淡黃色變成黃綠色,且生長旺盛,愈傷組織增重率高達500.56%(圖1)。
2.2 響應面法分析不同激素濃度配比對愈傷組織分化的影響
2.2.1 不同激素濃度配比對愈傷組織分化的影響結果及方差分析
利用響應面法對影響馬鈴薯愈傷組織芽分化率的主要激素參數(shù)條件進行優(yōu)化,采用Design-Expert.V8.0.6.1統(tǒng)計軟件進行試驗設計與回歸分析,結果見表2、表3。從方差分析結果可以看出,TDZ對出芽率的影響最為顯著,其次是GA3,而2,4-D影響較小。
2.2.2 模型擬合與優(yōu)化

圖1 莖段愈傷組織Fig.1 Stem callus tissues
表2Box-Behnken試驗設計與結果
Table2Box-Behnken design and results
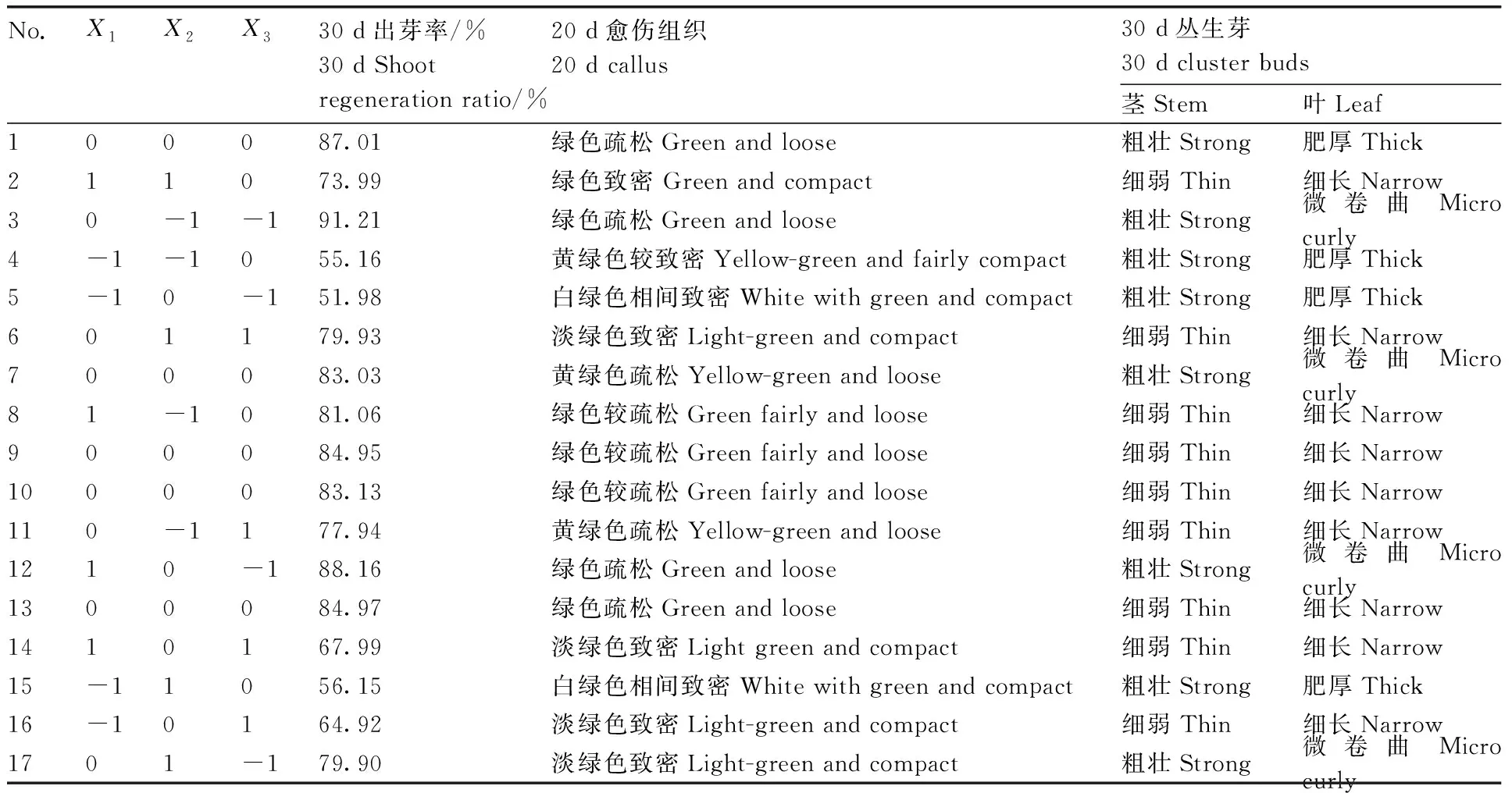
No.X1X2X330 d出芽率/%30 d Shootregeneration ratio/%20 d愈傷組織20 d callus30 d叢生芽30 d cluster buds莖Stem葉Leaf100087.01綠色疏松Green and loose粗壯Strong肥厚Thick211073.99綠色致密 Green and compact細弱Thin細長Narrow30-1-191.21綠色疏松Green and loose粗壯Strong微卷曲Micro curly4-1-1055.16黃綠色較致密Yellow-green and fairly compact粗壯Strong肥厚Thick5-10-151.98白綠色相間致密White with green and compact粗壯Strong肥厚Thick601179.93淡綠色致密Light-green and compact細弱Thin細長Narrow700083.03黃綠色疏松Yellow-green and loose粗壯Strong微卷曲Micro curly81-1081.06綠色較疏松Green fairly and loose細弱Thin細長Narrow900084.95綠色較疏松Green fairly and loose細弱Thin細長Narrow1000083.13綠色較疏松Green fairly and loose細弱Thin細長Narrow110-1177.94黃綠色疏松Yellow-green and loose細弱Thin細長Narrow1210-188.16綠色疏松Green and loose粗壯Strong微卷曲Micro curly1300084.97綠色疏松Green and loose細弱Thin細長Narrow1410167.99淡綠色致密Light green and compact細弱Thin細長Narrow15-11056.15白綠色相間致密White with green and compact粗壯Strong肥厚Thick16-10164.92淡綠色致密Light-green and compact細弱Thin細長Narrow1701-179.90淡綠色致密Light-green and compact粗壯Strong微卷曲Micro curly
表3回歸模型各項的方差分析
Table3Variance analysis of regression equation
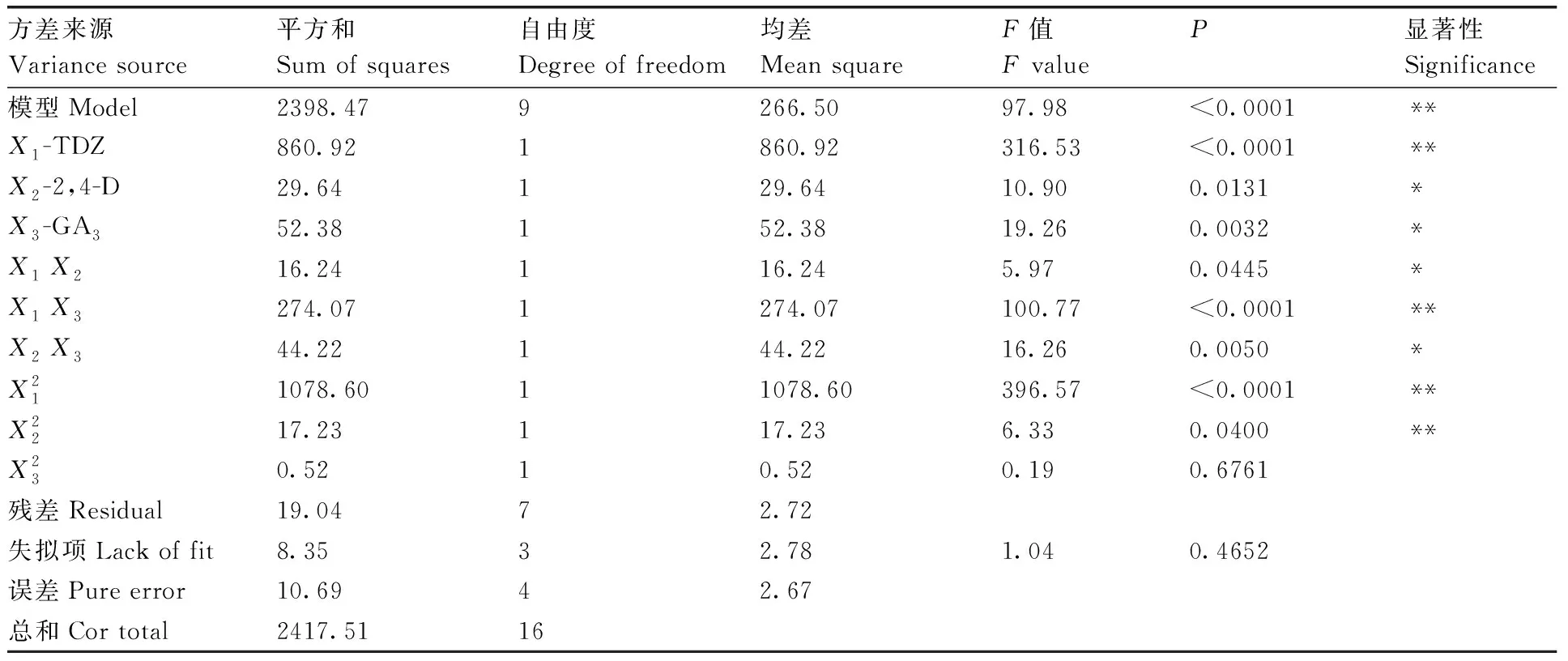
方差來源Variance source平方和Sum of squares自由度Degree of freedom均差Mean squareF值F valueP顯著性Significance模型Model2398.479266.5097.98<0.0001**X1-TDZ860.921860.92316.53<0.0001**X2-2,4-D29.64129.6410.900.0131*X3-GA352.38152.3819.260.0032*X1 X216.24116.245.970.0445*X1 X3274.071274.07100.77<0.0001**X2 X344.22144.2216.260.0050*X211078.6011078.60396.57<0.0001**X2217.23117.236.330.0400**X230.5210.520.190.6761殘差Residual19.0472.72失擬項Lack of fit8.3532.781.040.4652誤差Pure error10.6942.67總和Cor total2417.5116
*和**分別表示顯著(P<0.05)、極顯著(P<0.01)水平。
* and **represented significance at the level of 0.05 and 0.01,respectively.
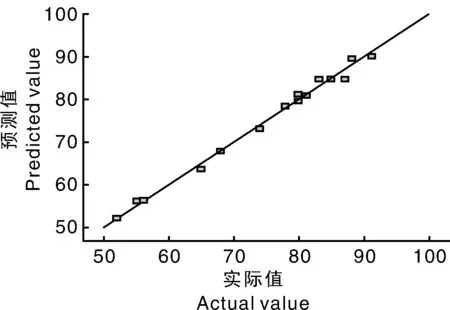
圖2 測量與預測的出芽率之間的線性相關圖Fig.2 Linear correlation plot between shoot regeneration ratio of measured value vs.predicted value
2.2.3 響應面和等高線
為了分析TDZ、2,4-D、GA3對馬鈴薯莖段愈傷組織再生出芽效率的影響,根據(jù)回歸方程做出各因素對Y的響應面和等高線,考察擬合響應曲面的形狀(圖4)。從響應面的坡度變化及等高線的形狀可分析各因素的交互作用:若等高線的形狀為橢圓形表示因素間交互作用顯著,圓形則表示因素間交互作用可忽略不計[10],同時響應面坡度相對平緩表示響應值不敏感;反之,則敏感。
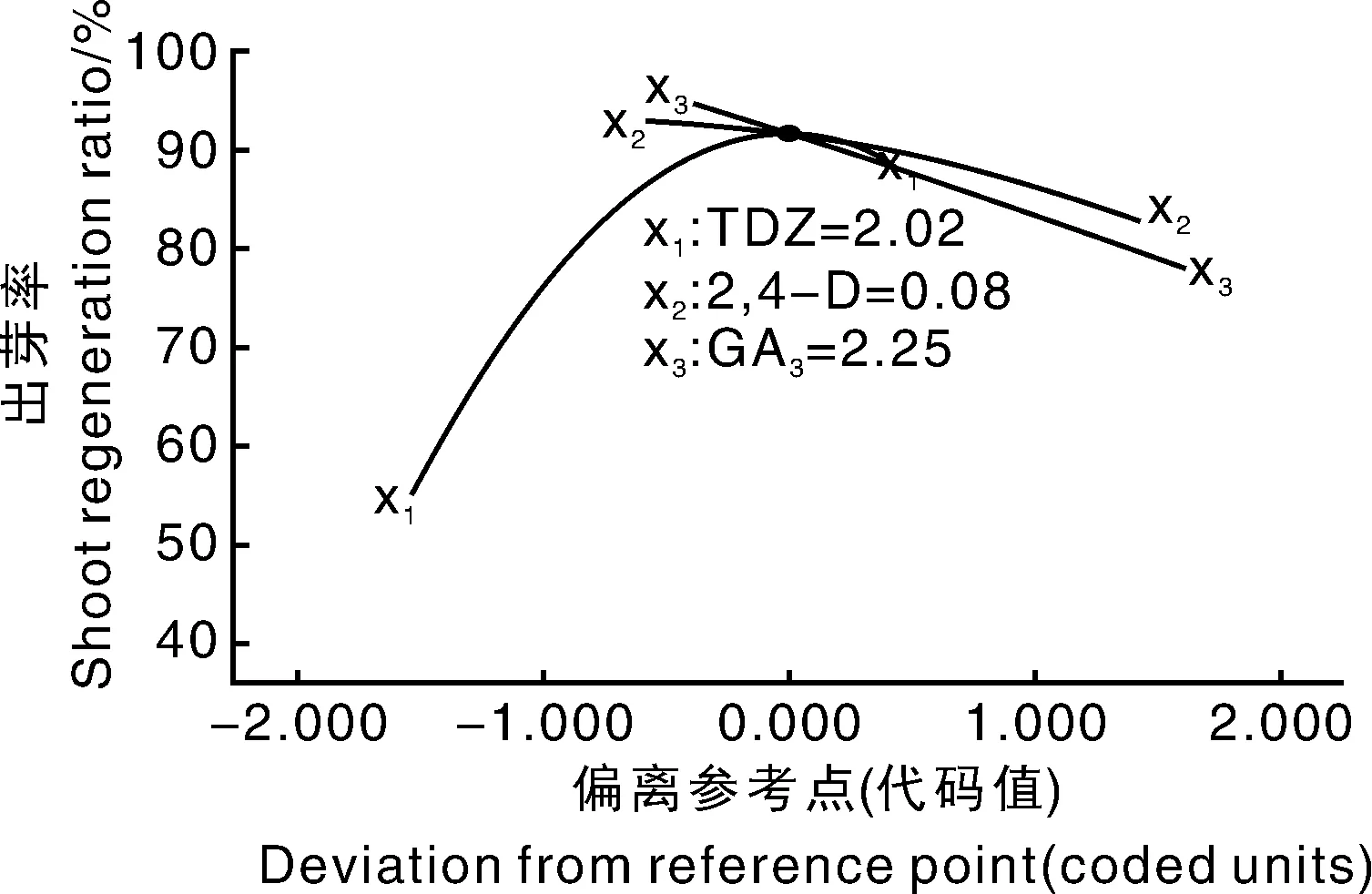
圖3 TDZ、2,4-D、GA3三者與愈傷組織出芽率的攝動關系圖Fig.3 Perturbation of TDZ(X1),2,4-D(X2) and GA3(X3) on callus shoot regeneration ratio
由圖4可以看出,TDZ和2,4-D,TDZ和GA3的交互作用顯著,2,4-D和GA3交互作用較小。因此,TDZ在培養(yǎng)基中的濃度變化對馬鈴薯愈傷組織出芽很敏感,而2,4-D、GA3相對不敏感,其敏感性TDZ>GA3>2,4-D。
2.2.4 最佳激素濃度配比及驗證
在MS+2.02mg·L-1TDZ+0.08mg·L-12,4-D+2.25mg·L-1GA3最佳激素配比下,馬鈴薯莖段愈傷組織的理論出芽率為91.52%。在此激素條件下,實際測得的平均出芽率為91.50%,與預測值基本一致,證實了該模型的有效性。分化培養(yǎng)14d左右,其中一些愈傷組織表面出現(xiàn)瘤狀顆粒,結構松散、質地緊密,20d在OLYMPUS SZX7體視顯微鏡下觀察,可以看到愈傷組織瘤狀突起處有胚芽形成,30d肉眼可觀察到明顯的叢生芽,40d芽越來越多,60d叢生芽生長旺盛。
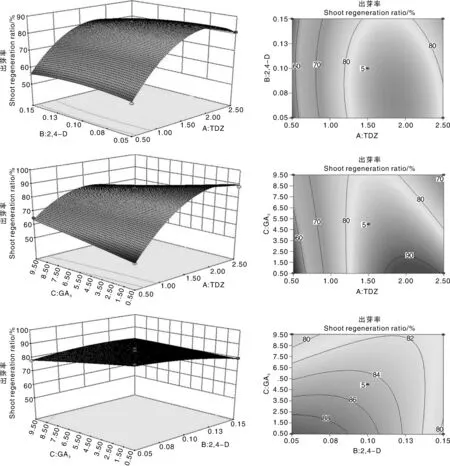
圖4 愈傷組織出芽率隨TDZ(A)、2,4-D(B)和GA3(C)變化的響應面圖及對應的等高線圖Fig.4 Response surface and contour map for effects of TDZ(A),2,4-D(B) and GA3(C) on callus shoot regeneration ratio
接于MS上的芽,14d再生植株生長良好,根系粗壯(圖5)。

圖5 叢生芽誘導(A-F)與再生植株的生根培養(yǎng)(G-I)Fig.5 Multiple-shoot inducement(A-F) and regeneration rooting culture plants(G-I)
3 討論
響應面分析法是一種試驗次數(shù)少、周期短、回歸方程精度高,能研究幾種因素間交互作用的回歸分析方法[11]。相對于傳統(tǒng)的數(shù)理統(tǒng)計方法,響應面分析法求得的各參數(shù)組合更加精確,可以大大降低生產實踐過程中造成的原料浪費。愈傷組織分化培養(yǎng)的效果,需要綜合考慮多方面因素,諸如生長情況,是否出現(xiàn)退化、變色、硬化、出芽等問題。由于在進行響應面法設計時,需要以定量值作為衡量指標,定性指標的標準不好確定,因此,以出芽長度>0.5cm的愈傷組織數(shù)統(tǒng)計出芽率,作為響應值。
從響應面和等高線可以看出,不同濃度TDZ、2,4-D、GA3對愈傷組織出芽率的影響不同,敏感性TDZ>GA3>2,4-D。研究不同濃度的激素組合對愈傷組織叢生芽誘導率的影響,以往在馬鈴薯組織培養(yǎng)中的芽誘導主要應用的細胞分裂素是6-BA[1]、玉米素(trans-zeatin)[12]、激動素(kinetin,KT)[2]。在蔥[13]、土黨參[14]等植物愈傷組織再生體系中運用TDZ效果顯著,因此本實驗中引用了TDZ代替6-BA。TDZ是一類人工合成的苯基脲衍生物,具有強烈的細胞活性,其活性遠遠超過玉米素、6-BA、激動素KT和異戊烯腺嘌呤(Zip),能誘導外植體從愈傷組織形成到體細胞胚胎發(fā)生的一系列過程,具有生長素和細胞分裂素雙重作用的特殊功能[15-16]。Elaleem等[17]研究馬鈴薯愈傷芽分化時認為MS+5.00mg·L-1TDZ出芽率高達81%。而本研究結果表明,使用較高濃度的TDZ對叢生芽誘導時間、叢生芽誘導率、出芽數(shù)均有較為顯著的作用,而當TDZ濃度超過2.02mg·L-1后,隨著TDZ使用濃度的增加,愈傷組織的叢生芽誘導率及出芽數(shù)降低。這表明對TDZ形成具再生能力的致密型愈傷組織影響最大,當超過一定濃度后,TDZ的添加量與指標體系之間存在負相關性。可能由于馬鈴薯品種的基因型不同,其內源激素有差異,導致本研究中的TDZ最佳濃度有別于前人的研究結果。
GA3能刺激細胞分裂和伸長,對芽的分化有明顯促進作用[18]。研究結果表明,GA3在馬鈴薯莖段愈傷不定芽分化中均具有一定的影響,這與Ghosh等[19]在馬鈴薯葉片愈傷不定芽分化中的研究結果一致。Kumlay等[20]研究認為,低濃度的GA3有利于馬鈴薯愈傷組織芽分化。在本研究中GA3濃度較高,但當濃度大于5mg·L-1時,會導致芽莖桿細,移植的苗不健壯,且不容易成活。2,4-D是誘導馬鈴薯愈傷組織的關鍵激素之一,在一定濃度范圍內,濃度的增加對誘導大部分植物的胚性愈傷具有良好效果[21],但過高或過低的2,4-D濃度均不利于胚性愈傷組織的形成和分化[22]。本研究發(fā)現(xiàn),2,4-D對芽的分化有抑制作用,且愈傷組織出芽率隨著2,4-D濃度的增加而逐漸降低。濃度過高會產生白色愈傷組織,質地緊致且芽分化困難,這與大多數(shù)人研究認為高濃度2,4-D能誘導生長勢旺盛的愈傷組織,但不定芽的分化率相對較低的結果相似。
馬鈴薯愈傷組織表面形狀與顏色、質地疏松與否,與其形態(tài)器官的再生能力有明顯關系。本研究表明,只有顏色呈綠色或黃綠色、表面凹凸明顯、結構疏松的馬鈴薯莖段愈傷組織,才具有較強形態(tài)器官的再分化能力與較強的植株再生能力。TDZ對馬鈴薯愈傷組織芽分化起著關鍵作用,與Dokhaniyeh等[23]研究結果相一致。本實驗中馬鈴薯莖段愈傷組織脫分化后形成的愈傷組織在相對低濃度的2,4-D(0.08mg·L-1)與相對高濃度的TDZ(2.02mg·L-1)及GA3(2.25mg·L-1)作用下,再分化芽能力最強,平均出芽率與模型預測值基本一致。表明在生長素的添加量適宜的前提下,適當提高細胞分裂素和赤霉素的添加量有利于組培苗形態(tài)器官的再分化。后期實驗將進一步研究響應法運用應綜合考慮衡量愈傷組織生長好壞的其他指標。
:
[1] 黃萍,馬朝宏,顏謙.特色馬鈴薯品種紅寶石再生系統(tǒng)的篩選[J].天津農業(yè)科學,2017,23(2):16-19.
HUANG P,MA C H,YAN Q.Screening of regenerated system of characteristic potato variety ‘Hongbaoshi’[J].TianjinAgriculturalSciences,2017,23(2):16-19.(in Chinese with English abstract)
[2] 陳曉艷,孟亞雄,賈小霞,等.馬鈴薯品種‘隴薯11號’再生體系的構建[J].中國馬鈴薯,2016,30(2):65-69.
CHEN X Y,MENG Y X,JIA X X,et al.Construction of regeneration system for potato variety ‘Longshu 11’[J].JournalofChinesePotato,2016,30(2):65-69.(in Chinese with English abstract)
[3] 許俊潔,盧金清,萬麗娟,等.響應面法優(yōu)化羅麥顆粒成型工藝的研究[J].中國藥師.2016,19(9):1665-1669.
XU J J,LU J Q,WAN L J,et al.Optimization of forming process of luomai granules by response surface methodology[J].ChinaPharmacist,2016,19(9):1665-1669.(in Chinese with English abstract)
[4] NEKOUEI F,NEKOUEI S.Comparative study of photocatalytic activities of Zn5(OH)8Cl2·H2O and ZnO nanostructures in ciprofloxacin degradation:response surface methodology and kinetic studies[J].ScienceoftheTotalEnvironment,2017,601/602:508-517.
[5] BEN A A,MOKNI A,YAICH H,et al.Technological properties of milk gels produced by chymosin and wild cardoon rennet optimized by response surface methodology[J].FoodChemistry,2017,237:150-158.
[6] ABBASI Z,HOOSHYAR S,BAGHERIEH N M B.Improvement of callus production and shoot regeneration using various organs of soybean(GlycinemaxL.Merr) by response surface methodology[J].InVitroCellular&DevelopmentalBiology-Plant,2016,52(5):537-545.
[7] BAGHERIEH N M B,NEZAMDOOST T.Optimization of shikonin production inOnosmadichroanthacallus using response surface methodology[J].PlantCell,TissueandOrganCulture,2016,126(3):399-409.
[8] 湯云川,陳濤,梁遠發(fā),等.成都平原馬鈴薯品種比較試驗[J].四川農業(yè)科技,2017(6):10-13.
TANG Y C,CHEN T,LIANG Y F,et al.Comparison test of potato varieties in Chengdu plain[J].SichuanAgriculturalScienceandTechnology,2017(6):10-13.(in Chinese)
[9] 梁遠發(fā),倪蘇,蔣馨,等.高干中早熟馬鈴薯新品種“川芋10號”的創(chuàng)新培育[J].中國馬鈴薯,2008,22(1):63.
LIANG Y F,NI S,JIANG X,et al.Innovative cultivation of the new potato variety Chuanyu No.10 in the political precocious[J].JournalofChinesePotato,2008,22(1):63.(in Chinese)
[10] 黃玉蘭,殷奎德,岳才軍.黃瓜愈傷組織繼代培養(yǎng)中激素濃度組合的優(yōu)化[J].激光生物學報,2014,23(1):83-89.
HUANG Y L,YIN K D,YUE C J.Optimum combination of hormone concentration during callus subculture of cucumber[J].ActaLaserBiologySinica,2014,23(1):83-89.(in Chinese with English abstract)
[11] OBEROI D P S,SOQI D S.Utilization of watermelon pulp for lycopene extraction by response surface methodology[J].FoodChemistry,2017,232:316-321.
[12] ABBASI A Z,BILAL M,HUSSAIN J,et al.Robust regeneration protocol for theAgrobacteriumtumefaciensmediated transformation ofSolanumtuberosum[J].PakistanJournalofBotany,2016,48(2):707-712.
[13] FARHADI N,PANAHANDEH J,AZAR A M,et al.Effects of explant type,growth regulators and light intensity on callus induction and plant regeneration in four ecotypes of Persian shallot(Alliumhirtifolium)[J].ScientiaHorticulturae,2017,218:80-86.
[14] 戚甫友,范偉軍,胡秀,等.土黨參莖段的愈傷組織誘導與植株再生[J].浙江農業(yè)學報.2017,29(8):1313-1320.
QI F Y,FAN W J,HU X,et al.Callus induction and plant regeneration from stem explants ofCampanumoeajavanicaB1[J].ActaAgriculturaeZhejiangensis,2017,29(8):1313-1320.(in Chinese with English abstract)
[15] 徐曉峰,黃學林.TDZ:一種有效的植物生長調節(jié)劑[J].植物學通報,2003,20(2):227-237.
XU X F,HUANG X L.TDZ:an efficacious plant growth regulator[J].ChineseBulletinofBotany,2003,20(2):227-237.(in Chinese with English abstract)
[16] 崔海蘭,朱延明,齊洋.Thidiazuron等植物生長調節(jié)劑對水稻(OryzasativaL.) 愈傷組織不定芽分化的影響[J].東北農業(yè)大學學報,2003,34(1):72-76.
CUI H L,ZHU Y M,QI Y.Effect of Thidiazuron on rice(OryzasativaL.) callus organogenesis[J].JournalofNortheastAgriculturalUniversity,2003,34(1):72-76.(in Chinese with English abstract)
[17] ELALEEM K G A,MODAWI R S,KHALAFALLA M M.Effect of plant growth regulators on callus induction and plant regeneration in tuber segment culture of potato(SolanumtuberosumL.) cultivar Diamant[J].AfricanJournalofBiotechnology,2009,8(11):2529-2534.
[18] 方貫娜,龐淑敏.馬鈴薯愈傷組織再生體系的研究進展[J].中國馬鈴薯,2012(5):307-310.
FANG G N,PANG S M.Research progress on callus regeneration system of potato[J].JournalofChinesePotato,2012(5):307-310.(in Chinese)
[19] GHOSH S,MAJUMDAR S,SARKAR D,et al.An efficient adventitious shoot regeneration system for potato(SolanumtuberosumL.) using leaf discs[J].JournalofPlantBiochemistry&Biotechnology,2015,24(3):298-304.
[20] KUMLAY A M,ERCISLI S.Callus induction,shoot proliferation and root regeneration of potato(SolanumtuberosumL.) stem node and leaf explants under long-day conditions[J].Biotechnology&BiotechnologicalEquipment,2015,29(6):1075-1084.
[21] 袁雪,鐘雄輝,李曉昕,等.鐵炮百合的胚性愈傷組織誘導和植株再生[J].核農學報,2012,26(3):454-460.
YUAN X,ZHONG X H,LI X X,et al.Embryonic callus induction and plant regeneration ofLiliumlongiflorum[J].JournalofNuclearAgriculturalSciences,2012,26(3):454-460.(in Chinese with English abstract)
[22] 苗博瑛,劉艷軍,楊靜慧.黑莓松散型胚性愈傷組織的誘導[J].山西農業(yè)科學,2014,42(3):209-212.
MIAO B Y,LIU Y J,YANG J H.Study on the induction method of blackberry friable embryogenic callus[J].JournalofShanxiAgriculturalSciences,2014,42(3):209-212.(in Chinese with English abstract)
[23] DOKHANIYEH A Y,KOHNEHROUZ B B,MOUSAVI A,et al.Rapid and high efficiency regeneration from potato(SolanumtuberosumL.) using thidiazuron as cytokinin source[J].JournalofFoodAgriculture&Environment,2011,9(3):613-617.
Optimizationofefficientregenerationsysteminstemofpotatousingresponsesurfacemethodology
JIANG Linjuan1,ZOU Xue1,HUANG Xueli1,NI Su1,LI Liqin1,YANG Shimin1,2,*
(1.CollegeofAgronomy,SichuanAgriculturalUniversity,Chengdu611130,China;2.NationalDemonstrationCenterforExperimentalCropScienceEducation,SichuanAgriculturalUniversity,Chengdu611130,China)
Abstract:To establish the optimal hormone concentrations of culture medium for efficient regeneration of potato stem callus tissue,as well as build a new system for tissue culture and rapid propagation technology,stem of Chuanyu No.10 was employed as explants to induce callus tissue,and the Box-Behnken design method of response surface methodology(RSM) was used to research the effect of TDZ,2,4-D and GA3on the differentiation of potato callus.Meanwhile,the hormone concentrations were optimized.The results showed that the sensitivity of the hormone concentrations in culture medium to potato callus budding from the response surface method optimization model is TDZ>GA3>2,4-D.The determination conefficientR2of the model was 0.992 1,the optimal medium for adventitious bud differentiation from stem callus of Chuanyu No.10 was MS+2.02mg·L-1TDZ+0.08mg·L-12,4-D+2.25mg·L-1GA3.In this condition,the budding rate was actual measured,which was consistent with the predicted values.That confirmed the validity of the model.
Key words:potato;callus;response surface method;medium
中圖分類號:S532
A
文章編號:1004-1524(2018)06-0918-08
收稿日期:2017-09-04
基金項目:四川省科技創(chuàng)新苗子工程(2015120);國家重點研發(fā)計劃子課題(2016YFD0300908-03)
作者簡介:江林娟(1985—),女,浙江嘉善人,碩士研究生,主要從事植物組織培養(yǎng)及遺傳育種研究。E-mail:juan498@163.com
,楊世民,E-mail:yangshimin1@163.com
10.3969/j.issn.1004-1524.2018.06.05
(責任編輯張 韻)

