miR-936對人喉癌細胞株Hep-2增殖、遷移、侵襲和藥物敏感性的影響
王海峰 李培 王志遠 林惜君 郭程 葉進
喉癌是頭頸部常見的惡性腫瘤,其中喉鱗狀細胞癌是其主要病理類型,占90%以上。雖然過去幾十年間喉癌的治療方式獲得了長足的進展,但患者五年生存率卻沒有獲得提高,研究顯示1975年~2010年間美國喉癌患者的5年生存率從66%降到63%[1-2]。喉癌治療以外科手術為主,放化療是不可或缺的組成部分,近年來新型分子治療成為一種潛在選擇[1]。大量研究表明,諸多因子參與到的喉癌的腫瘤學進程中,探明喉癌的分子機制對喉癌的早期診斷及研究新的分子靶標至為重要[3-6]。微小RNA(miR)在腫瘤的發生發展中扮演著重要的角色,它們既可以作為促癌基因也可以作為抑癌基因[7-8]。近年來,miR在喉癌中的研究越來越多, 各種研究表明在喉癌的早期診斷、治療和預后等方面具有潛在作用[5]。目前miR-936偶見于其他腫瘤的報道中,但是尚未見miR-936在喉癌中的研究報道,本文主要討論miR-936對喉癌細胞株Hep-2的影響。
材料與方法
一、細胞培養
Hep-2細胞、HEK293T細胞培養在含10%胎牛血清和青霉素(100 U/ml)、鏈霉素(100 ng/ml)的DMEM培養液中,置于37℃、5%CO2的培養箱中培養,以0.25%胰蛋白酶消化細胞傳代,每 1~2 d傳代1次,取處于對數生長期的細胞用于后續實驗。
二、質粒構建及病毒包裝
通過將合成好的pre-miR-936(F:CCGGTCAAGGCCACTGGGACAGTAGAGGGAGGAATCGCA-GAAATCACTCCAGGAGCAACTGAGAGACCTTCTAC-TTTACCAGGTCCTGCTGGCCCAGATTTTTG; R: AA-TTCAAAAATCTGGGCCAGCAGGACCTGGTAAAGTA-GAAGCAAGGTCTCTCAGTTGCTCCTGGAGTGATTT-CTGCGATTCCTCCCTCTACTGTCCCAGTGGCCTTGA)克隆到慢病毒載體pLKO.1-GFP質粒中,構建了miR-936慢病毒載體。將pLKO.1-GFP-miR-936與psPAX和pMD2G共轉染HEK293T,分別在轉染后24 h、48 h、72 h、96 h收集培養液上清。收集濃縮的培養液上清,用濃縮的慢病毒(Lenti-miR-936)溶液感染Hep-2細胞,之后用嘌呤霉素篩選建立Hep-2的miR-936穩定表達細胞株及對照組細胞株(pLKO.1-GFP空載包裝病毒并感染Hep-2細胞),分別稱為miR-936組及Vector組。
三、實時熒光定量PCR(RT-qPCR)
采用HiPure Total RNA Mini Kit(Magen)從Hep-2細胞中提取總RNA。采用HiFi-script cDNA kit(Cwbio)進行逆轉錄(miR-936逆轉錄引物:GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACT-GGATACGACCTGCGA)。以上所有操作遵照產品說明書。SYBR 熒光染料法RT-qPCR檢測Hep-2-miR-936穩定株中miR-936的表達量,U6作為內參RT-qPCR引物:miR-936(F): CACGCAACAGTAGAGGGA,miR-936(R):CCAGTGCAGGGTCCGAGGTA;U6(F):GCGCGTCGTGAAGCGTTC,U6(R):GTGCAGGGTCCGAGGT。反應條件:95 ℃ 10 s; 95 ℃ 30 s, 60 ℃ 20 s(共40個循環),所有反應均設3個復孔,記錄系統返回的CT值,采用獲得相對定量結果。引物由Sangon Biotech訂購。
四、MTT實驗
將Hep-2細胞以0.5×104~1×104/孔的密度接種到96孔板中,設3個復孔,在增殖實驗中分別在種板4 h、24 h、48 h、72 h、96 h后加入MTT(每孔終濃度0.5 mg/ml),培養4 h,吸去培養液,加入100 μl DMSO。在λ= 570 nm處測定吸光度。
五、劃痕實驗
將Hep-2細胞(5×105/孔)接種到六孔培養皿中,直到細胞80%~90%匯合,吸盡培養液,先在皿底用黑線標記,用10 μl移液槍吸頭在細胞單層上垂直于標記線劃痕,并用磷酸鹽緩沖液(PBS)洗滌兩次。使細胞在無血清培養基中遷移24 h和48 h,分別觀察并拍攝劃痕,選取3張圖片進行統計分析,遷移的距離從顯微照片中測量。
六、Transwell小室實驗
將Hep-2細胞接種在改良的Boyden室(Corning)的上部隔室中,用無血清培養基培養。下室含有10%胎牛血清的培養基,在37℃、5%CO2中培養24 h。擦去膜上表面的細胞,并將侵入底部的細胞用10%結晶紫染色,然后隨機選取3個不同的視野拍攝并計數。
七、鬼筆環肽(Phalloidin)染色實驗
將細胞接種在玻璃蓋板上24 h,然后用4%多聚甲醛固定20 min,并用0.1%Triton X-100在室溫下透化15 min。將蓋玻片在黑暗中用100 nM羅丹明-鬼筆環肽在室溫下孵育30 min。 之后用100 nM DAPI核復染。 將蓋玻片在PBS中沖洗并倒置晾干。然后將這些載玻片用中性香脂密封,并在共聚焦顯微鏡下觀察。
八、藥敏實驗
將Hep-2細胞以0.5×104~1×104個細胞/孔的密度接種到96孔板中,設3個復孔,于37℃、5% CO2培養箱中孵育至其貼壁(一般4 h),加入所屬濃度梯度的藥,繼續孵育72 h,在光學顯微鏡下觀察其細胞狀態。加入10 μl MTT,而后繼續孵育4 h,吸盡培養基,加入50 μl DMSO,用搖床緩慢搖10 min,待結晶完全溶解,用酶標儀在570 nm處檢測其吸光值(OD570)。
九、統計學處理
結 果
一、miR-936過表達Hep-2細胞株構建
由于構建的pLKO.1-GFP-miR-936質粒以及空載pLKO.1-GFP包含熒光基因GFP,成功感染的Hep-2細胞在藍光激發下能夠產生綠色熒光,未被感染的細胞則不能產生綠色熒光,因此比較同一光學顯微鏡視野下白光圖片及熒光圖片中細胞數量能夠判斷慢病毒感染效率,miR-936組感染效率為92%(細胞數量比值,熒光/白光=720/780),Vector組感染效率為0.91(細胞數量比值,熒光/白光=510/560)(圖1A)。RT-qPCR結果顯示,miR-936組細胞的miR-936 mRNA表達水平高于Vector組(2.36±0.47vs1.00±0.10,t=5.600,P﹤0.05),提示miR-936過表達的Hep-2穩轉株構建成功(圖1B)。

圖1 miR-936過表達Hep-2細胞株和對照組構建(×100)
A:miR-936組與Vector組熒光表達情況;B: miR-936組與Vector組RT-qPCR檢測miR-936的表達;與Vector組比較,**P<0.01
二、過表達miR-936抑制Hep-2細胞增殖能力
將miR-936組和Vector組細胞等量接種于96孔板,2組細胞在每個時間點分別設置3個復孔,0、4 h的MTT結果顯示2組接種量幾乎一致(t值分別為2.451和0.324,P均>0.05),而在48、72、96 h,2組出現差異,miR-936組細胞增殖速度低于Vector組(圖2),差異有統計學意義(t值分別為4.939、6.154、3.739,P均<0.05)。
三、miR-936抑制Hep-2細胞遷移能力
劃痕后細胞培養至24、48 h,miR-936組細胞的相對劃痕寬度均寬于Vector組(t值分別為8.071、6.318,P均﹤0.01),提示miR-936過表達能夠減弱Hep-2細胞的遷移能力,見圖3。
四、miR-936抑制hep-2細胞侵襲能力
Transwell小室實驗結果(圖4)顯示, miR-936組細胞的穿膜數量少于Vector組(t=8.342,P<0.01),提示miR-936過表達能夠減弱Hep-2細胞的侵襲能力。
五、miR-936抑制Hep-2細胞表面微管微絲表達
鬼筆環肽染色顯示miR-936組Hep-2細胞表面的微管微絲明顯少于Vector組(圖5),miR-936組細胞表面微管微絲的減少提示其侵襲遷移能力的減弱。
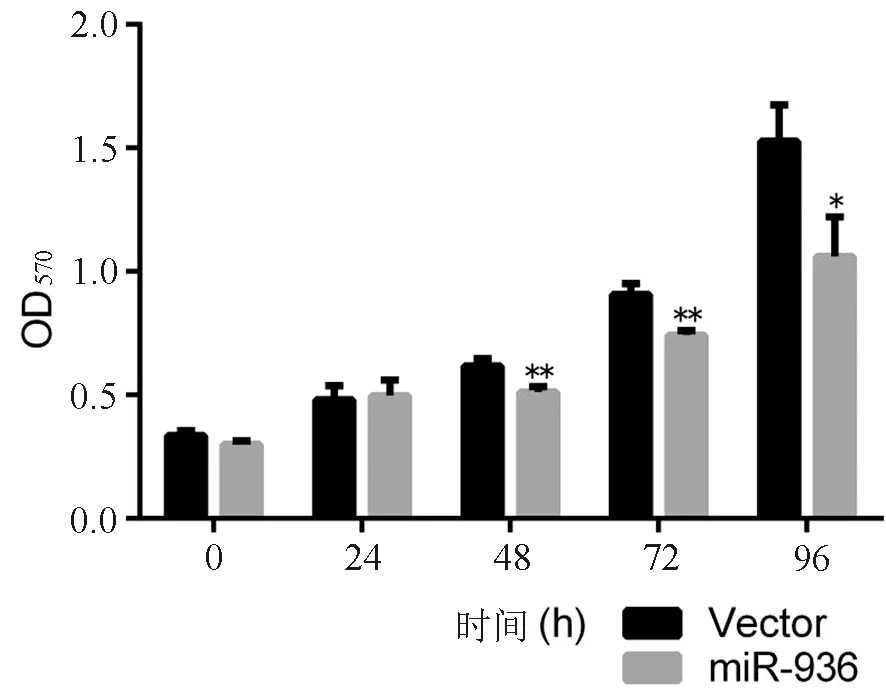
圖2 miR-936對Hep-2細胞增殖的影響
*P<0.05,**P<0.01
六、miR-936增加Hep-2細胞對順鉑和阿霉素的敏感性
與Vector組相比,miR-936組Hep-2細胞對順鉑和阿霉素的敏感性增加(圖6),DDP組0~100 μm的t值分別為0.000,-0.456,3.389,4.057,6.925,0.826,-2.782,2組在1、3、10 μm處比較差異有統計學意義(P均<0.05);DOX組0~10 μm的t值分別為0.000,5.181,5.598,3.112,1.610,0.437,0.831,2組在0.03、0.1、0.3 μm處比較差異有統計學意義(P均<0.05 )。

圖3 miR-936對Hep-2細胞遷移的影響(×100)
A:2組細胞培養至0、24、48 h的相對劃痕寬度;B:2組細胞相對劃痕寬度比較,**P<0.01
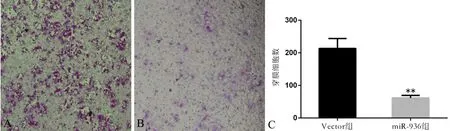
圖4 miR-936對Hep-2細胞遷移的影響(×100)
A:Vector組;B: miR-936組;C:2組細胞的穿膜數量比較,**P<0.01
討 論
miR是一類具有控制基因轉錄后表達水平的能力的調控分子。miR通過降解mRNA或阻止mRNA翻譯來減少蛋白質的產生。因此,miR可以通過抑制其他促癌基因或者抑癌基因的基因轉錄后表達參與到腫瘤的分子機制網絡中。有系統性研究指出,在喉癌中有潛在診斷價值的miR有miR-196a,miR-21,miR-27a等,對預后評價有潛在價值的miR有miR-101、miR-126、miR-152、miR-19a等,而一些miR如miR-1、miR-129-5p、miR-155、miR-206等有可能是潛在的治療靶點[5]。

圖5 miR-936對Hep-2細胞微管微絲的影響(×600)
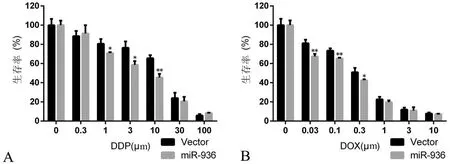
圖6 miR-936增加Hep-2細胞對順鉑和阿霉素的敏感性
A:對順鉑的敏感性;B: 對阿霉素的敏感性;*P<0.05,**P<0.01
研究發現相比于正常組織,miR-936在 子宮內膜癌(EEC)和舌鱗狀細胞癌中高表達[9-10]。在結直腸癌轉移組織中也有報道miR-936呈現高表達[11-12]。另有研究發現與正常人相比,miR-936在肝細胞癌病人血液細胞微泡(Microvesicles)中高表達[13-14]。而另一項研究顯示miR-936在人非小細胞肺癌細胞系(EPLC-32M1、A549和801D)和人胰腺導管腺癌細胞系(MiaPaCa-2、PANC-1和Hs766T)中呈現低表達[15-17]。由此可見,miR-936在不同腫瘤及腫瘤細胞株中可能扮演著不同角色,而其在喉癌中扮演的角色及在喉癌細胞生物學行為中的具體作用尚不可知。
本研究顯示,過表達的miR-936組Hep-2細胞對順鉑和阿霉素的敏感性明顯增加,具體機制尚不清楚。而Zhang等[18]研究發現抗腫瘤藥物斑蝥素(Cantharidin)可以上調乳腺癌細胞MCF7中miR-936的表達。另有研究發現一種對腎細胞癌細胞有抑制作用的強心苷類藥物(Amantadig)能夠升高腎細胞癌細胞中miR-936的表達[19]。這些研究提示miR-936也可能作為抗腫瘤藥物的下游基因發揮抗腫瘤作用。因此miR-936有可能既直接增加腫瘤細胞對于化療藥物的敏感性,同時也作為抗腫瘤藥物的下游基因發揮抗腫瘤作用。
為了進一步研究miR-936對喉癌細胞的作用,我們分別進行了細胞增殖實驗、劃痕實驗、Transwell侵襲實驗以及鬼筆環肽染色實驗。細胞增殖實驗發現過表達的miR-936明顯抑制了Hep-2細胞的增殖能力(與Vector組相比較)。劃痕實驗和Transwell侵襲實驗發現過表達的miR-936能夠明顯抑制Hep-2細胞的遷移和侵襲能力,并且在鬼筆環肽染色實驗中發現miR-936組細胞表面微管微絲明顯減少。這些結果提示miR-936能夠抑制喉癌細胞的侵襲和遷移能力。Zhang等[20]研究發現,相對于N0期(無淋巴結轉移)胃癌組織,miR-936在N3期(超過7個淋巴結轉移)的胃癌組織中明顯低表達,提示miR-936低表達可能和胃癌轉移有關。這與本研究發現的miR-936能夠抑制喉癌細胞的侵襲和遷移能力的結果相一致。
綜上所述,miR-936在不同腫瘤中可能有著不同的作用,本研究發現并初步驗證了miR-936對于喉癌細胞系Hep-2的抑制作用,并從多個方面驗證了miR-936作為抑癌基因抑制喉癌細胞系Hep-2的增殖、遷移和侵襲能力,并且增加其藥物敏感性,提示miR-936在喉癌治療中可能有潛在的應用價值。
[1] Steuer CE, El-Deiry M, Parks JR, Higgins KA, Saba NF. An update on larynx cancer. CA Cancer J Clin,2017,67(1):31-50.
[2] Siegel RL, Miller KD, Jemal A. Cancer statistics, 2015. CA Cancer J Clin,2015,65(1):5-29.
[3] de Miguel-Luken MJ, Chaves-Conde M, Carnero A. A genetic view of laryngeal cancer heterogeneity. Cell Cycle,2016,15(9):1202-1212.
[4] Rafferty MA, Fenton JE, Jones AS. An overview of the role and inter-relationship of epidermal growth factor receptor, cyclin D and retinoblastoma protein on the carcinogenesis of squamous cell carcinoma of the larynx. Clin Otolaryngol Allied Sci,2001,26(4):317-320.
[5] Li P, Liu H, Wang Z,He F, Wang H, Shi Z, Yang A, Ye J. MicroRNAs in laryngeal cancer: implications for diagnosis, prognosis and therapy. Am J Transl Res,2016,8(5):1935-1944.
[6] Nadal A, Cardesa A. Molecular biology of laryngeal squamous cell carcinoma. Virchows Arch,2003,442(1):1-7.
[7] Ventura A, Jacks T. MicroRNAs and cancer: short RNAs go a long way. Cell,2009,136(4):586-591.
[8] 葛曙雄,王涌. 微小RNA與腫瘤微環境. 新醫學,2016,47(1):7-11.
[9] Snowdon J, Zhang X, Childs T, Tron VA, Feilotter H. The MicroRNA-200 family is upregulated in endometrial carcinoma. PLoS One,2011,6(8):e22828.
[10] Rentoft M, Fahlén J, Coates PJ, Laurell G, Sj?str?m B, Rydén P, Nylander K. miRNA analysis of formalin-fixed squamous cell carcinomas of the tongue is affected by age of the samples. Int J Oncol,2011,38(1):61-69.
[11] Chang J, Huang L, Cao Q, Liu F. Identification of colorectal cancer-restricted microRNAs and their target genes based on high-throughput sequencing data. Onco Targets Ther,2016,9:1787-1794.
[12] Kou Y, Qiao L, Wang Q. Identification of core miRNA based on small RNA-seq and RNA-seq for colorectal cancer by bioinformatics. Tumour Biol,2015,36(4):2249-2255.
[13] Lu L, Guo D, Chen X, Xiong W,Jie S,Li H. Abnormal miRNAs targeting chromosome open reading frame genes were enriched in microvesicles derived from the circulation of HCC. Biochem Genet,2016,54(2):120-133.
[14] Li H, Sun L, Chen X,Xiong W, Hu D, Jie S. Microvesicle microRNA profiles and functional roles between chronic hepatitis B and hepatocellular carcinoma. Clin Transl Oncol,2014,16(3):315-321.
[15] Liu M, Zhou K, Cao Y. MicroRNA-944 affects cell growth by targeting EPHA7 in non-small cell lung cancer. Int J Mol Sci,2016,17(10).pii: E1493.
[16] Lee E M, Shin S, Cha H J, Yoon Y, Bae S, Jung JH, Lee SM, Lee SJ, Park IC, Jin YW, An S. Suberoylanilide hydroxamic acid (SAHA) changes microRNA expression profiles in A549 human non-small cell lung cancer cells. Int J Mol Med,2009,24(1):45-50.
[17] Toste PA, Li L, Kadera BE, Nguyen AH, Tran LM, Wu N, Madnick DL, Patel SG, Dawson DW,Donahue TR. p85alpha is a microRNA target and affects chemosensitivity in pancreatic cancer. J Surg Res,2015,196(2):285-293.
[18] Zhang H, Yan X. Cantharidin modulates the E2F1/MCM7-miR-106b-93/p21-PTEN signaling axis in MCF-7 breast cancer cells. Oncol Lett,2015,10(5):2849-2855.
[19] Nolte E, Wach S, Silva IT, Lukat S, Ekici AB, Munkert J, Müller-Uri F,Kreis W, Oliveira Sim?es CM, Vera J, Wullich B, Taubert H, Lai X. A new semisynthetic cardenolide analog 3β-[2-(1-amantadine)-1-on-ethylamine]-digitoxigenin (AMA-NTADIG) affects G2/M cell cycle arrest and miRNA expression profiles and enhances proapoptotic survivin-2B expression in renal cell carcinoma cell lines. Oncotarget,2017,8(7):11676-11691.
[20] Zhang J, Zhu Z, Sheng J,Yu Z, Yao B, Huang K, Zhou L, Qiu Z, Huang C. miR-509-3-5P inhibits the invasion and lymphatic metastasis by targeting PODXL and serves as a novel prognostic indicator for gastric cancer. Oncotarget,2017,8(21):34867-34883.

