老年血管性癡呆患者血清C反應蛋白及白介素6檢測分析
徐亞麗 姚 莉 何小蓉 鄧 霞 張璦琳 漆 靜 張興平△
重慶市人民醫院 1)老年病科 2)健康管理中心 3)科教處,重慶 400013
腦小血管病(cerebral small vessel disease,CSVD)是指顱內小動脈或微動脈病變引起的腦缺血或出血性疾病,通常情況下指供應深部腦組織的小動脈和微動脈。CSVD的影像學表現包括腔隙性腦梗死、腦白質疏松及腦微出血現象[1]。缺血性腦小血管病占所有缺血性卒中的10%~30%。CSVD可導致患者慢性或隱匿進展的認知、人格、情感及行為障礙,是血管性認知功能損害(VCI)的主要原因,也是36%~67%的血管性癡呆(vascular dementia,VD)患者的病因[2]。隨著神經影像學檢查的普及和人口老齡化的進展,老年人群的CSVD檢出率越來越高[3]。VD是臨床常見的老年期癡呆疾病之一。血管性認知障礙的重要因素是腦內微動脈和小動脈病變所致的腦小血管病[4]。CSVD導致VCI的最常見原因[5]。目前認為,VCI是可以預防的,甚至在疾病早期或可逆轉,因此,早期識別VCI,研究其相關危險因素,早期干預成為重要預防策略[6]。腦小血管病是老年人常見的隱襲性腦血管病,因其臨床表現存在“寂靜”現象,所以易被患者及醫務工作者忽視,是導致VD的重要因素[7]。VD屬于腦血管疾病引起的認知功能的異常,越來越多的研究表明,炎癥病因參與了動脈硬化和腦小血管病變、認知功能障礙和癡呆[8]。炎癥因子在血管性癡呆中起重要的作用。本研究選擇在重慶市人民醫院治療的缺血性腦小血管病(SVD)導致的血管性癡呆患者及無癡呆患者,檢測2組血清炎性指標并進行分析。
1 資料與方法
1.1病例收集收集2015-01—2016-12重慶市人民醫院住院的缺血性腦小血管病老年患者,年齡75~90歲,所有患者經詳細詢問病史,進行全面的臨床檢查,包括神經系統體格檢查和神經心理測試、常規實驗室檢查、腦CT或磁共振成像(MRI)。符合1995年全國第4屆腦血管會議提出的腦小血管病診斷標準,均有腔隙性梗死或腦白質疏松。根據中華醫學會提出的中國癡呆與認知障礙診治指南(2011年)和血管性認知障礙診治指南(2011年),確診血管性癡呆患者35例(VD組)。選取同期住院的缺血性腦小血管病無認知功能障礙患者35例為對照組。排除診斷明確的惡性腫瘤、腦外傷,腦出血;其他類型的癡呆,嚴重的精神病;酒精或藥物濫用者;有血液系統疾病、消化道出血、甲狀腺、腎上腺及嚴重心、肝、腎、肺疾病者,近期有急性感染病史,慢性結締組織疾病者;長期使用或最近3個月內使用過非甾體類抗炎藥的患者。經患者家屬或授權委托人書面同意后列為受試者。2組年齡、性別比及合并冠心病、2型糖尿病、原發性高血壓差異無統計學意義(P>0.05)。見表1。

表1 2組臨床資料對比
1.2樣本采集與測試所有患者于入院次日清晨空腹采取肘正中靜脈血約5 mL送檢臨床檢驗科(重慶市臨床檢驗中心)檢測。CRP及hs-CRP測定采用免疫比濁法,IL-6采用電化學發光法。
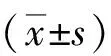
2 結果
VD組血清CRP、hs-CRP、IL-6水平明顯高于對照組,差異有統計學意義(P<0.05或0.01)。見表2。
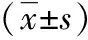
表2 2組血清CRP、hs-CRP、IL-6水平對比
注:與對照組比較,*P<0.01;與對照組比較,#P<0.05
3 討論
本研究表明,炎癥因子CRP、hs-CRP、IL-6水平升高是血管性癡呆的相關因素。本研究中VD患者血清中CRP、IL-6、hs-CRP水平較缺血性腦小血管病患者升高,表明炎癥因子在動脈粥樣硬化合并VD患者的炎癥反應更強烈。
研究表明,炎癥因子參與了動脈硬化、CSVD和認知功能下降的發病機制[8]。血清中的炎癥因子可能導致血栓形成,加速動脈粥樣硬化,促進腦梗死和VD的發生[9]。傳統的觀點認為,CRP、hs-CRP是一種急性期反應物,但越來越多的研究表明,CRP對血管細胞和單核-吞噬細胞具有直接生物效能[10],不但與血管損傷有關,而且與認知功能相關。對癡呆患者尸檢發現,CRP可能由腦內神經細胞和小膠質細胞產生[11]。動脈粥樣硬化形成和發展是一種低度的慢性炎癥反應過程,hs-CRP作為重要的炎性因子生物的標記物,不僅參與動脈粥樣硬化的發生演變和進展,而且還是腦血管疾病發生、發展的預測因子,其炎性反應對斑塊的形成和脫落起關鍵作用[12]。血清中CRP、hs-CRP水平升高是中樞神經系統炎癥在外周的反應[13]。炎癥受損機制在癡呆發病機制中起重要作用。炎癥因子失調與認知功能疾病、癡呆、腦血管疾病密切相關。hs-CRP是認知功能下降、卒中和血管性癡呆的危險因素。流行病學研究顯示,hs-CRP的升高與其后發生腦血管病等事件的危險性呈正相關[14],長期服用非甾體類抗炎藥物可明顯減少癡呆的風險[15]。認知功能障礙是CSVD最常見和最重要的臨床表現,包括執行功能、注意力、記憶力及日常生活功能的損害,其中以執行功能損害最為常見[16]。
研究發現,阿爾茨海默病患者和VD患者血清中CRP和IL-6的表達均明顯升高[17]。臨床研究發現,血清CRP水平可以預測VD的發生[18]。炎癥因子與認知功能的改變密切相關。CRP和IL-6在腔隙性梗死中發生變化[19],CRP在腔隙性梗死患者血清中表達上調[20-21]。人群隊列研究發現、CRP、IL-6升高與認知功能下降、腦血管疾病密切相關[22-23]。外周血中CRP水平與神經認知功能下降呈正相關,在中年和老年人群中,IL-6水平與認知功能具有相關性,同型半胱氨酸是腦血管病和癡呆的危險因素。有報道指出,CRP、IL-6和同型半胱氨酸均參與腦血管病和癡呆發病的病理機制[24]。
IL-6基因位于人類第7號染色體上,參與炎癥反應。IL-6是中樞神經系統疾病密切相關的一種多效細胞因子,參與機體防御、炎癥反應、免疫反應等重要過程。中樞神經系統中的神經元、小膠質細胞和星形膠質細胞能表達IL-6。IL-6在認知功能中起重要的作用,IL-6通過影響突觸可塑性、神經發生而影響認知功能。IL-6是炎癥趨化因子CX3CL1的下游信號,小膠質細胞激活釋放促炎因子IL-6,啟動神經保護和免疫反應[25]。動物實驗及人體研究均發現,高水平IL-6與認知功能下降有關[8],并可作為預測指標。動物實驗證實,腦缺血大鼠模型早期平板運動實驗可以顯著改善認知功能,減輕焦慮樣行為,認知功能和行為改善與腦內的炎癥因子IL-6水平密切相關[26]。IL-6通過與血管疾病相關作用可能影響認知功能下降[22]。此外,炎癥因子IL-6的基因多態性與缺血性腦卒中相關[27]。IL-6-174G → C 和572C → G 基因多態性與年輕人缺血性卒中發病相關[28],IL-6 rs1800796 TT基因型增加缺血性腦卒中風險[29]。IL-6水平升高,IL-6受體的基因變異增加癡呆的風險[8]。
本研究提示,hs-CRP、CRP和IL-6不但與血管因素有關,還與認知功能改變相關。本研究存在樣本量較小且無詳細的受試人群服用相關藥物等不足之處。此外,本研究系橫斷面研究,不能提供炎癥因子與血管性癡呆關系的直接證據。因此,還需大樣本前瞻性的研究進一步明確炎癥因子在血管性癡呆中的作用。
[1] 李強,孫翠梅,劉建強,等.血漿胱氨酸蛋白酶抑制劑C水平與腦小血管病關系的研究[J].卒中與神經疾病,2016,23(1):3.
[2] 柯莉.腦小血管疾病與阿爾茨海默病的相關研究[J].重慶醫學,2016,45(5):4.
[3] 孫國兵,郭珍立,譚倩.丁苯酞對腦小血管病患者認知功能及腦血管儲備功能的影響[J].中國實用神經疾病雜志,2017,20(23):46-49.
[4] 王杰,毛姍.腦小血管病引發的腦白質疏松與認知功能障礙的相關性研究[J].中國實用神經疾病雜志,2017,20(18):43-45.
[5] GRAU-OLIVARES M,ARBOIX A.Mild cognitive impairment in stroke patients with ischemic cerebral small-vessel disease:a forerunner of vascular dementia?[J].Expert Rev Neurother,2009,9(8):1 201-1 217.
[6] 孔祥增,王彥永,王曉,等.不同類型腦小血管病患者認知功能損害特征及危險因素分析[J].中國全科醫學,2017,20(5):543-548.
[7] 李偉,李桂林,王擁軍.腦小血管病[J].中華內科雜志,2010,49(2):163-164.
[8] MIWA K,OKAZAKI S,SAKAGUCHI M,et al.Interleukin-6,interleukin-6 receptor gene variant,small-vessel disease and incident dementia[J].Eur J Neurol,2016,23(3):656-663.
[9] WERSCHING H,DUNING T,LOHMANN H,et al.Serum C-reactive protein is linked to cerebral microstructural integrity and cognitive function[J].Neurology,2010,74(13):1 022-1 029.
[10] YEH E T.A new perspective on the biology of C-reactive protein[J].Circ Res,2005,97(7):609-611.
[11] YASOJIMA K,SCHWAB C,MCGEER E G,et al.Human neurons generate C-reactive protein and amyloid P:upregulation in Alzheimer's disease[J].Brain Res,2000,887(1):80-89.
[12] 李萌,王玉芬,劉紅,等.超敏C反應蛋白與腦血管病關系的研究進展[J].國際老年醫學雜志,2017,38(4):184-187.
[13] LINDQVIST D,HALL S,SUROVA Y,et al.Cerebrospinal fluid inflammatory markers in Parkinson's disease--associations with depression,fatigue,and cognitive impairment[J].Brain Behav Immun,2013,33:183-189.
[14] PURROY F,MONTANER J,MOLINA CA,et al.C-reactive protein predicts further ischemic events in transient ischemic attack patients[J].Acta Neurol Scand,2007,115(1):60-66.
[15] CHANG K H,HSU Y C,HSU C C,et al.Prolong Exposure of NSAID in Patients With RA Will Decrease the Risk of Dementia:A Nationwide Population-Based Cohort Study[J].Medicine(Baltimore),2016,95(10):e3056.
[16] 李世容,劉蕊,陳嵐,等 血清25-羥維生素D缺乏與腦小血管病的相關性研究[J].中國實用神經疾病雜志,2017,20(5):20-23.
[17] 胡軍,原琳琳,胡長春,等.早期阿爾茨海默病血清CRP IL-6 TG及血漿HDL-C診斷分析[J].中國實用神經疾病雜志,2017,20(15):9-11.
[18] HSU P F,PAN W H,YIP B S,et al.C-Reactive Protein Predicts Incidence of Dementia in an Elderly Asian Community Cohort[J].J Am Med Dir Assoc,2017,18(3):277e277-277e211.
[19] WISEMAN S,MARLBOROUGH F,DOUBAL F,et al.Blood markers of coagulation,fibrinolysis,endothelial dysfunction and inflammation in lacunar stroke versus non-lacunar stroke and non-stroke:systematic review and meta-analysis[J].Cerebrovasc Dis,2014,37(1):64-75.
[20] LADENVALL C,JOOD K,BLOMSTRAND C,et al.Serum C-reactive protein concentration and genotype in relation to ischemic stroke subtype[J].Stroke,2006,37(8):2 018-2 023.
[21] ALVAREZ-PEREZ F J,CASTELO-BRANCO M,ALVAREZ-SABIN J.Usefulness of measurement of fibrinogen,D-dimer,D-dimer/fibrinogen ratio,C reactive protein and erythrocyte sedimentation rate to assess the pathophysiology and mechanism of ischaemic stroke[J].J Neurol Neurosurg Psychiatry,2011,82(9):986-992.
[22] WRIGHT C B,SACCO R L,RUNDEK T,et al.Interleukin-6 is associated with cognitive function:the Northern Manhattan Study[J].J Stroke Cerebrovasc Dis,2006,15(1):34-38.
[23] CHEN A,OAKLEY A E,MONTEIRO M,et al.Multiplex analyte assays to characterize different dementias:brain inflammatory cytokines in poststroke and other dementias[J].Neurobiol Aging,2016,38:56-67.
[24] HU S L,XIONG W,DAI Z Q,et al.Cognitive Changes during Prolonged Stay at High Altitude and Its Correlation with C-Reactive Protein[J].PLoS One,2016,11(1):e0146290.
[25] DESFORGES N M,HEBRON M L,ALGARZAE N K,et al.Fractalkine Mediates Communication between Pathogenic Proteins and Microglia:Implications of Anti-Inflammatory Treatments in Different Stages of Neurodegenerative Diseases[J].Int J Alzheimers Dis,2012:345472.
[26] ZHANG Q,ZHANG J,YAN Y,et al.Proinflammatory cytokines correlate with early exercise attenuating anxiety-like behavior after cerebral ischemia[J].Brain Behav,2017,7(11):e00854.
[27] 施蕊,胡釗,余顯倫,等.缺血性腦卒中與相關基因多態性的研究進展[J].中國衛生標準管理,2017,8(1):139-142.
[28] YANG X,FENG L,LI C,et al.Association of IL-6-174G>C and-572C>G polymorphisms with risk of young ischemic stroke patients[J].Gene,2014,539(2):258-262.
[29] QI X F,FENG T J,YANG P,et al.Role of infla-mmatory parameters in the susceptibility of cerebral thrombosis[J].Genet Mol Res,2014,13(3):6 350-6 355.

