基于不同光源的無標記顯微成像技術
韓 豪,徐媛媛,鄭慧茹,,劉景業,廖景榮,王亞偉,*
(江蘇大學, a.機械學院; b.理學院, 江蘇 鎮江 212013)
0 引言
光學顯微成像是一門兼具悠久歷史和發展前景的學科。自1590年荷蘭籍學者Hans and Zacharias Janssen兩父子發明出最早的光學復式顯微鏡至今四百余年來,光學顯微成像技術經歷了很大的進展。近年來,人類對微觀世界求知欲的不斷膨脹也加快了顯微成像技術的發展步伐,使之成為生命科學等領域的重要研究手段[1],科學家們在其分辨性能、工作效率及三維成像等方面不斷改良優化[2]。而后,各種先進獨特的顯微技術被相繼提出,如定量相位成像技術(quantitative phase imaging,QpI)[3-9]、太赫茲成像技術[10]以及結構光照明顯微成像技術(structured illumination microscopy,SIM)[11]等。此類技術可以實現非侵入、無損傷、高效率、高質量的顯微成像,在半導體材料表征、生物組織診斷、無損檢測和安檢等方面有著極其廣泛的應用。如:生命科學領域對生物大分子、活體細胞以及組織切片等的無損成像和動力學行為分析[9,12]。
本文首先對高相干激光、低相干光、太赫茲波以及結構光這四類不同光源的無標記顯微成像技術進行簡介,敘述各類技術的適用范圍、原理特征,介紹幾類顯微成像技術的背景及國內外研究現狀,并做比較分析,然后討論其優缺點及改良方向。最后展望了顯微成像技術的發展動向。
1 各類顯微成像技術的原理特征
傳統顯微成像技術是基于光透過觀測物體時發生振幅和波長變化來實現的,生物細胞的無色透明特性致使傳統顯微成像技術無法對其進行成像。但其實透射細胞的光相較于通過環境液的光在相位上會發生一定的偏移(相移),光透過環境介質和細胞不同位置時的相移情況也都是有差別的。QpI正是基于相位差異化分布的原理實現對生物細胞的清晰成像。QpI以高相干激光和低相干光為主要光源,是一種由傳統光學顯微技術演變而來的新興成像手段,具有無損傷、無侵入、可動態檢測等優勢,應用前景廣闊[3-12]。實現方式無需對樣品進行標記、染色、固定等復雜處理程序,成像過程簡單且處理速度快。獲取的相移信息被電感耦合器件(CCD、CMOS)采集并轉換為可接收處理的電信號最終由計算機運算成像。相位圖攜帶有細胞微米甚至納米量級尺度的振幅和相位等信息,由此可以獲取物體的三維形態分布以及內部亞結構等信息[13,14]。獲取的此類信息不僅能作為區分細胞種類和大小的依據,還能反映出細胞的亞結構形貌特征。近年來,QpI的飛速發展不斷打破其應用領域的技術瓶頸,利用相位進行生物細胞形態檢測、特征識別等研究已成為該領域一個極具生命力的發展方向。對形態學、生理學、細胞生物學、遺傳學、分子生物學以及臨床醫學等生命科學研究工作的深入開展意義深遠[15,16]。
太赫茲(1 THz=1×1012Hz)指處在紅外和微波頻率范圍間的特殊電磁波[17-20]。其成像技術原理與QpI類似,但實現方式更簡單。太赫茲波通過透射樣品攜帶其強度及相位等信息,由探測器采集記錄并傳送至計算機,經相應的程序運算即可獲得樣品的圖像信息。像源與太赫茲時域譜一一對應,通過對時域譜進行傅里葉變換又可得到每一點的太赫茲頻率響應譜[21]。太赫茲特性優異,首先是穿透力強,透視成像方面兼具X射線和超聲波成像的優點,且獲取信息更全面。其次太赫茲光子能量僅為4.1 meV,相較于X射線低7-8 個數量級,非常適于生物活體樣本的無損檢測。太赫茲波還具有指紋譜性,不同分子在太赫茲的吸收色散等作用后展現出特有的“指紋譜”,能夠對樣本的外部形態成分進行辨別。另外太赫茲波的相干性也很好,可以提升成像的空間分辨率和景深。一系列優勢使得太赫茲技術近年來在軍事、醫療、成像等領域飛速發展。
結構光照明顯微成像技術(structured illumination microscopy,SIM)是一種通過對照明光源改造以突破衍射極限提高分辨率的顯微成像技術。有別于受激發射損耗顯微技術(stimulated emission depletion,STED)[22]、隨機光學重構顯微技術(stochastic optical reconstruction microscopy,STORM)[23]以及光激活定位顯微技術(photoactivated localization microscopy,pALM)[24]等技術的熒光特性(在對樣品顯微成像之前需利用特殊制劑對其熒光標定,該過程可能會引起光漂白、毒傷等副作用)。SIM可以通過空間光調制器(spatial light modulator,SLM)等器件改造光源來實現非熒光成像。在不斷追求更高分辨率的大環境下,SIM以其超分辨的性能在顯微成像領域獨樹一幟,原理如下:結構光源將被測物體的高頻信息編碼至低頻區域,使其通過傳統光學顯微技術頻域受限的通頻帶,再還原到高頻區域,光學顯微技術的頻譜范圍被拓寬,可獲得更為精細的樣品信息,即系統成像分辨率得到提高,不再受阿貝衍射極限的分辨率限制[1, 25, 26]。不僅如此,SIM在工業生產中也被涉及推廣。以其大量程、大視場、高精度、光紋信息提取簡單、實時性強及主動受控等特點,在三維視覺檢測和機器人自主導引中得到了愈來愈廣泛的應用。另外,當下炙手可熱的智能手機面部識別功能也有不少基于SIM研發而來,實用價值很高。
2 定量相位顯微成像技術
隨著對生物細胞的深入研究,尤其是近十年來數字全息和顯微技術的快速發展,各種QpI被相繼提出。此類技術能在微米甚至納米量級獲取活細胞振幅、相位等多類信息,在生命科學領域備受關注。在光源使用上以高相干激光和低相干光為主,接下來分別進行介紹。
2.1 激光光源定量相位顯微技術
激光具有相干度高、光束能量集中、光斑質量優良以及易獲取等優點,是光學顯微研究運用最為普遍的光源之一。在工業生產、通信傳輸以及顯微成像等領域都有廣泛應用。尤其在對生物細胞及活體組織顯微成像方面,其透過性良好,且不會對樣品的生物活性帶來不良影響。常用波段有:632.8 nm紅光、532 nm綠光以及488 nm藍光等。
QpI根據記錄全息圖時兩光場是否存在夾角又可分為同軸干涉下的QpI、離軸干涉下的QpI以及輕微離軸干涉下的QpI。另外還有衍生的雙波長技術等。
2.1.1 同軸干涉下的相位顯微技術
杜克大學Adam Wax教授研究小組于2010年提出平行同軸全息相位顯微技術[27],相位成像系統簡單,且相位恢復過程僅需兩幅干涉圖相減即可消除背景項[28]。基本光路如圖1(a)所示,成像系統主要包含一個馬赫-曾德爾(Mach-Zehnder,MZ)干涉儀和一個成像分束器。光束經MZ系統發生干涉,最后經過Wollaston棱鏡和兩透鏡組成的4f系統將不同光束分離出兩個垂直的偏振分量,最后在CCD上發生干涉,得到相移差值π/2的兩幅圖像。
2011年,中國科學院郜鵬等利用偏振相移原理代替時間相移原理也提出了一類同步相移干涉顯微技術[29-30]。同樣基于MZ光干涉原理,利用兩個相同的相位光柵構成同步單元對物光和參考光進行分光,以便在CCD上同時采集到相移量為π/2的兩干涉圖樣。基本光路如圖1(b)所示。
同軸相位顯微技術相位成像穩定性好,相位恢復運算簡便,但是空間相移控制要求高,不適于細胞的動態成像研究。
2.1.2 離軸干涉下的相位顯微技術
離軸干涉下的QpI具有單次拍攝特性,適用于物體的動態成像研究。2006年Gabriel popescu團隊提出希爾伯特相位成像技術[31](hilbert phase microscopy,HpM),它同樣基于典型的MZ干涉光路,利用希爾伯特積分變換處理單幅干涉圖以實現干涉相位成像,如圖2(a)所示。然而此類技術雙光束屬于分離式干涉,穩定性較差,易受外界環境干擾。對此,共光路的離軸干涉相位成像技術被提出。如衍射相位顯微技術[14,32,33](diffraction phase microscopy,DpM)以及它的延伸技術,利用光柵的衍射特性在不犧牲穩定性的前提下,即可實現快速成像,實驗原理如圖2(b)所示。攜帶樣品信息的光束通過光柵后可得到包含圖像全部空間信息的多級衍射,濾波器SF實現0級和1級衍射場的分離,使之作為參考光和物光在CCD上形成干涉調制圖樣。
離軸干涉下的QpI成像效率高,但卻不能充分利用CCD的分辨率和空間帶寬,而且在相位恢復過程中需要通過高通濾波消除背景像,容易造成高頻信息的缺失。
2.1.3 輕微離軸干涉下的相位顯微技術
鑒于同軸、離軸兩類QpI各有所長,一類結合相移技術的輕微離軸干涉下的QpI被提出。2009年美國杜克大學Adam Wax教授通過控制兩偏振片實現了兩步輕微離軸干涉[34](slightly-off-axis interference),實驗裝置如圖3所示。透鏡兩兩組成的4f系統保證了樣品相位信息和振幅信息的完整性,旋轉調節兩波片可以引入不同相移,相應CCD上可記錄得到兩幅干涉圖,最后將實驗所得的兩幅干涉圖導入計算機完成相位恢復。此方法不需要通過高通濾波就能消除背景項,能最大限度確保相位信息的完整性。但是相移需要事后通過擬合背景條紋確定,一定程度上增加了相位恢復的復雜性。
2.1.4 雙波長干涉下的相位顯微技術
對于眾多的QpI,從干涉圖樣中直接提取相位信息時,受到相位恢復算法本身的限制,往往需要對獲取的相位信息進行解包處理,運算量大且抗噪聲能力弱。而雙波長以及多波長干涉技術從等效延長波長的角度入手可以很好地解決這一問題。
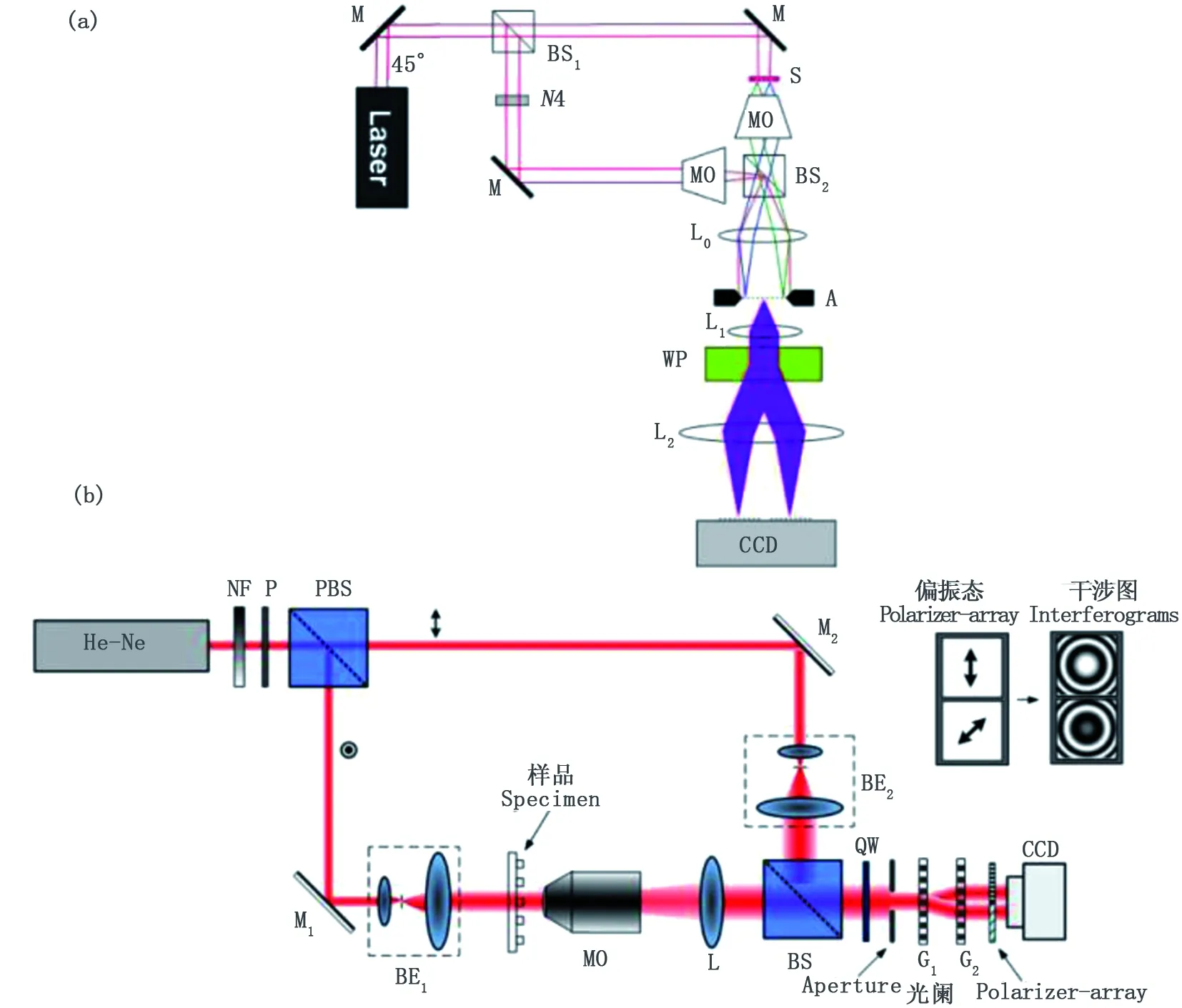
圖1 (a)平行同軸全息相位顯微技術;(b)光柵分光同步相移干涉顯微技術Fig.1 (a) parallel on-axis holographic phase microscopy; (b) Simultaneous phase-shifting interference microscopy by a grating
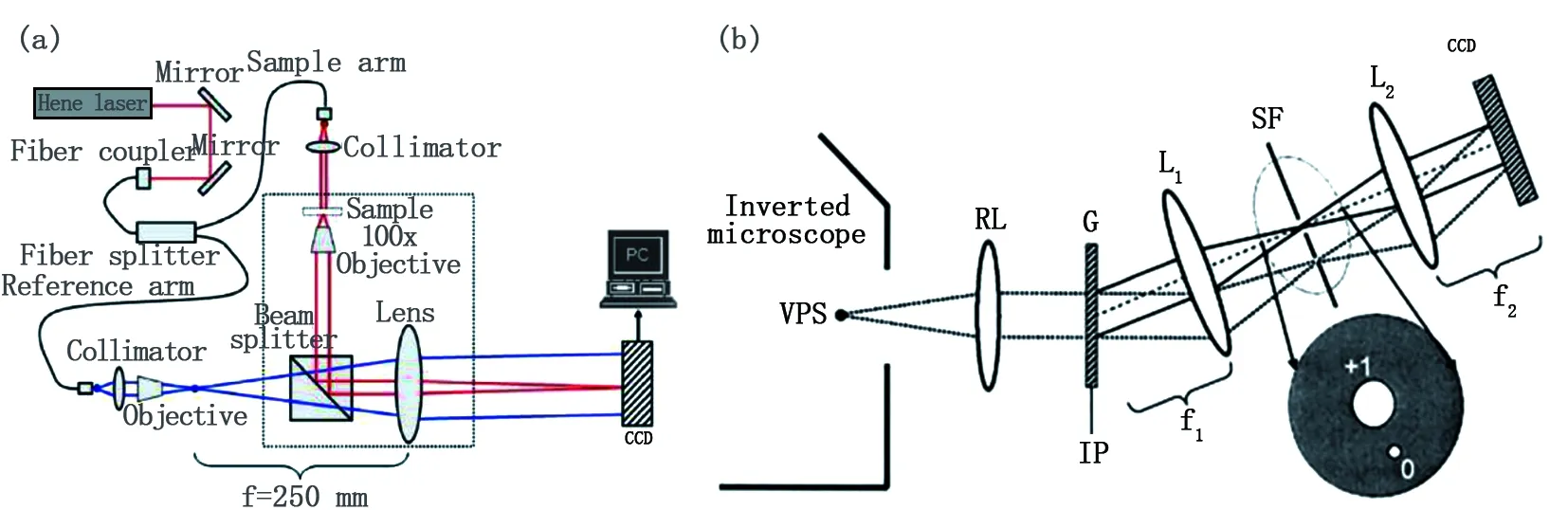
圖2 (a)希爾伯特相位成像技術;(b)衍射相位顯微技術Fig.2 (a) Hilbert phase microscopy (HpM); (b) Diffraction phase microscopy (DpM)
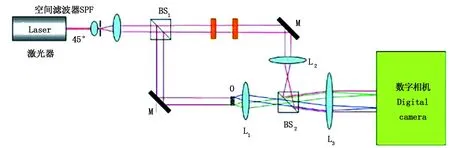
圖3 輕微離軸干涉技術Fig.3 Slightly-off-axis interference
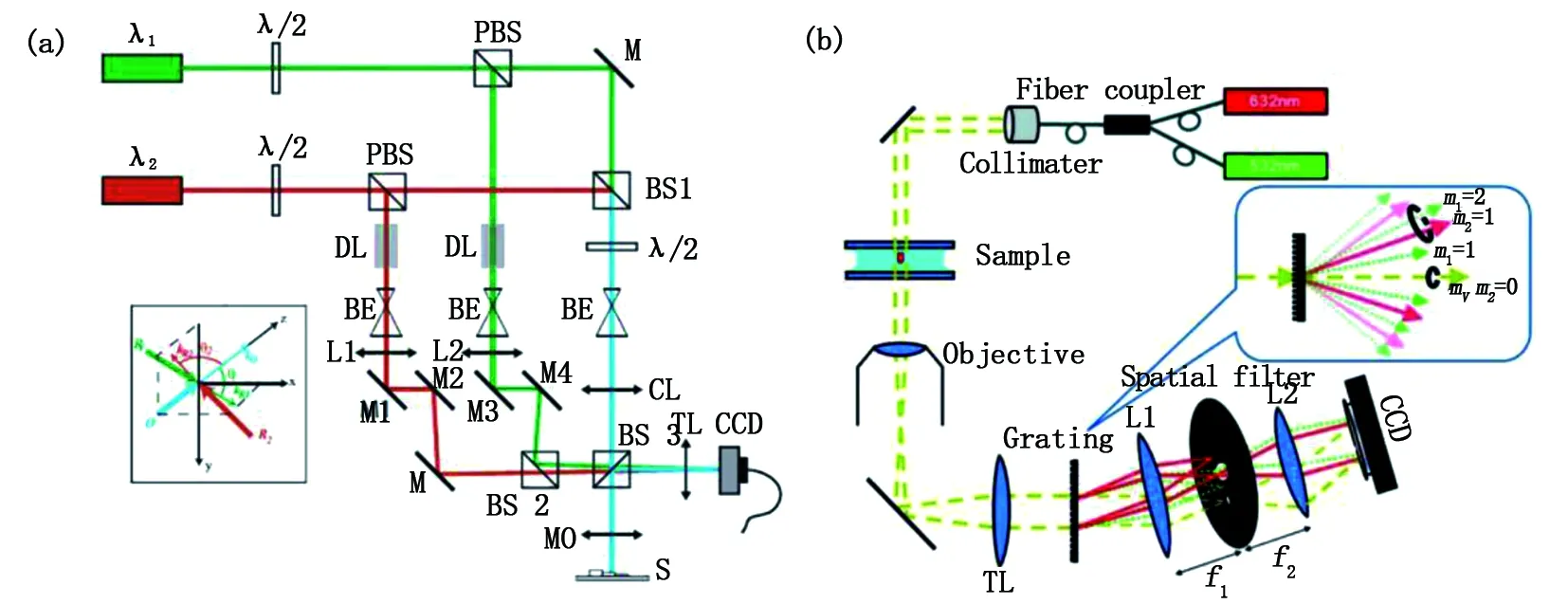
圖4 (a)實時雙波長干涉技術;(b)雙波長衍射相位顯微技術Fig.4 (a) Real-time dual-wavelength digital holographic microscopy; (b) Dual-wavelength diffraction phase microscopy (Dw-DpM)
2007年,瑞士Kuehn等報道了可對樣品快速變化現象和動態性能進行研究的實時雙波長全息成像技術[35],基本光路見圖4(a)。該技術利用兩不同波長的參考光波,通過調整他們的傳播方向,使得兩波長干涉下的空間載頻方向互為正交,這樣非常有利于信息的提取,且僅需CCD單次拍攝。
2014年,韓國學者Jafarfard等將雙波長技術應用到共光路的DpM下,實時測量了二氧化硅的折射率和厚度[13],如圖4(b)所示。該技術相較于傳統技術不僅具有單次曝光特性,還可以通過濾波變換等運算同時恢復兩幅干涉圖樣,進而得到空間物體的相位信息,獲取速度高達毫秒量級,光路穩定且分辨率可達亞納米量級。不僅適用于活體樣品動力學分析,多波長優勢還可用于無解包成像等研究。
2.1.5 三維定量相位顯微技術
在相位體三維QpI方面,以層析相位顯微技術[36-40](tomographic phase microscopy, TpM)為代表。2007年,美國Choi等人運用該技術首次獲得了活體海拉細胞的三維圖像[38]。其實驗裝置如圖5(a)所示。該技術同樣基于MZ的光干涉原理。電控掃描反射鏡調節油浸聚光透鏡與物鏡間產生多角度的樣品透射光線,并在CMOS接收面上發生干涉。再應用相移干涉技術計算出每個透射角度對應的相位信息。得到多角度下的樣品相位信息后,計算機通過運行相應的相位恢復算法即可重建樣品的三維形態分布。2016年Hassaan等人同樣用多角度照射的方式重建了小鼠白細胞的三維相位分布[40],基本原理見圖5(b)。系統采用激光共聚焦的方式對樣品進行透射采樣。其照射角度被電流計旋轉鏡(GM)所精準控制,對樣品進行掃描透射。樣品被不同角度的光照射以獲取不同角度下的樣品全息圖。這一系列全息圖最終被裝置的圖像傳感器Camera記錄下來,通過對應的相位恢復程序--光衍射層析算法(optical diffraction tomography,ODT)整合獲取的樣品相位信息并完成三維形態重建。
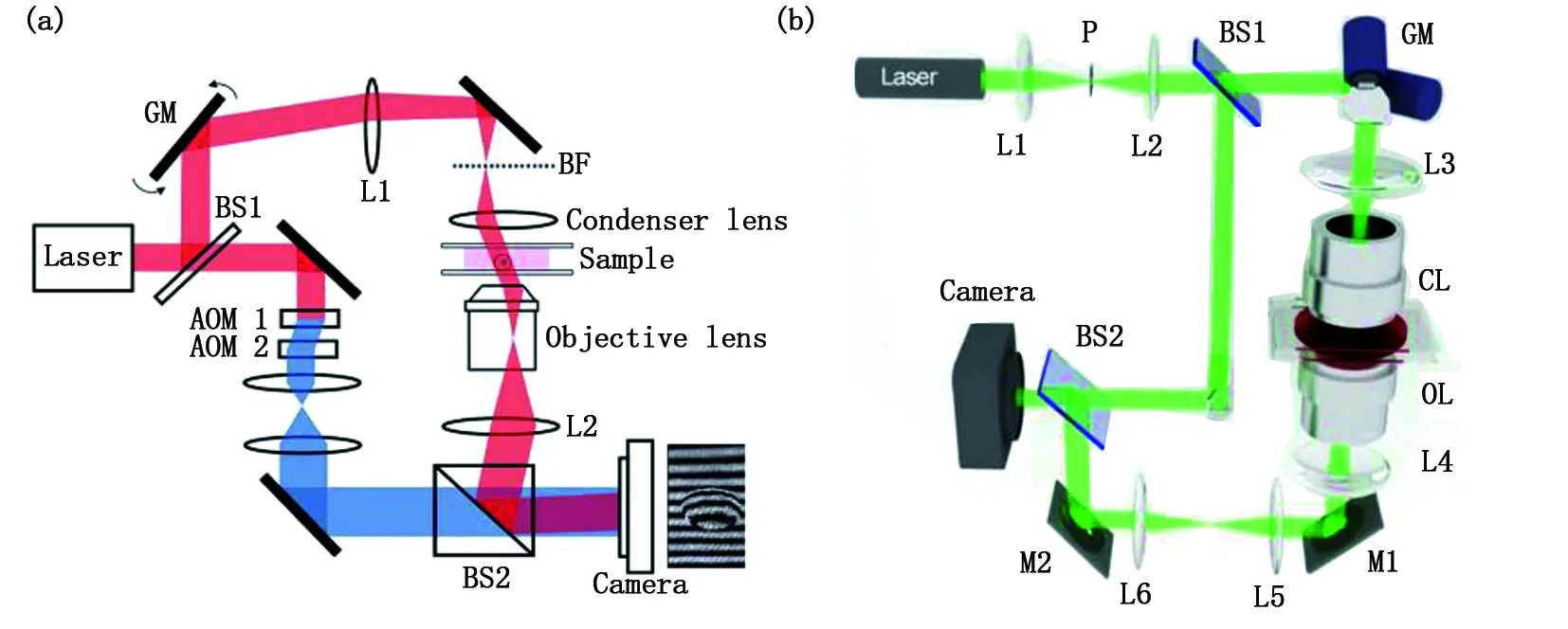
圖5 (a)層析相位顯微技術;(b)旋轉照明光束式層析光路示意圖Fig.5 (a) Tomographic phase microscopy (TpM); (b) The tomographic phase microscopy (TpM) setup by rotating the light
2.2 低相干光光源定量相位顯微技術
激光這類光源相干度高,成像時帶來的散斑效應會影響系統分辨率。而低相干光源的相干長度都比較短,能有效地抑制成像系統的相干噪聲,提高成像分辨率和重建信息精度。常用的低相干光源有:發光二極管(LED)、超輻射二極管(SLD)以及鹵鎢燈等。
低相干光源的發展史也很久遠。1934年荷蘭籍學者Zernike提出了相差顯微技術(phase contrast microscopy, pCM),利用相位板改變物光場的相位頻譜,從而實現透明樣品的清晰成像[41]。pCM在微觀顯微成像領域發展進程中具有里程碑式的意義,其光源即是低相干光。2004年美國Gabriel popescu教授提出傅里葉相位顯微技術[42](fourier phase microscopy,FpM),如圖6(a)所示。SLD作為光源出射光束,之后樣品的散射光與非散射光分別作為物光和參考光,最終在CCD上發生干涉。該技術通過引入相移,采集多幅干涉圖以實現相位成像。該課題組于2011年提出與此類似的空間光干涉顯微技術[43](spatial light interference microscopy,SLIM), 如圖6(b)所示。該技術的特殊之處在于其成像光源采用低相干鹵鎢燈,相干度僅有1.2 μm,很大程度上提高了圖像的對比度,成像效率高,且分辨率高達納米量級。此技術的顯微對象不僅可以是血細胞及其亞類細胞,甚至對其他類生物細胞、浮游微生物以及生物組織都可以實現成像。測量精度媲美原子力顯微鏡。SLIM的問世有助于細胞內部結構觀測、細胞增速測量以及細胞質流動探測等研究的深入推進[44-46]。
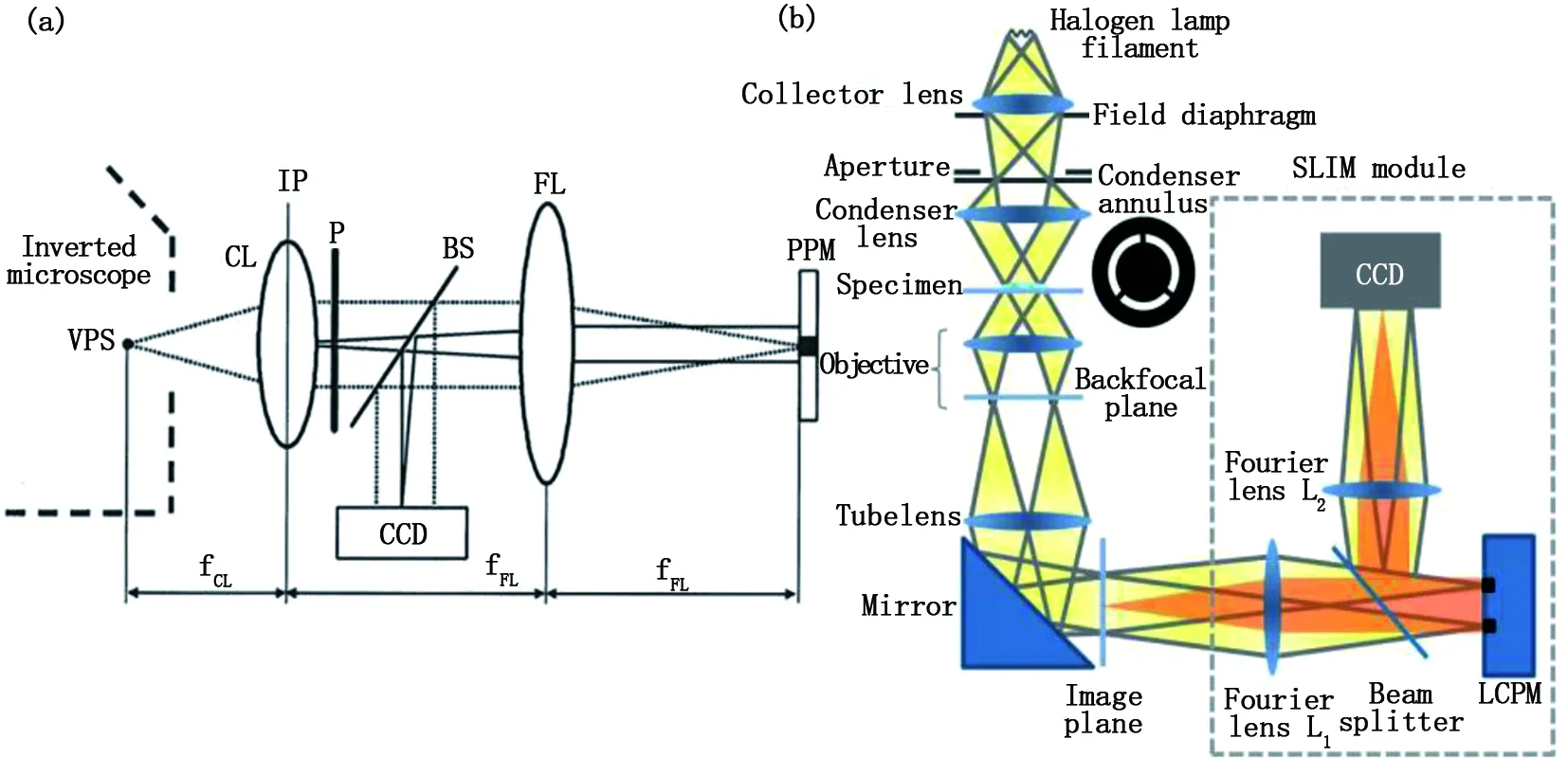
圖6 (a)傅里葉相位成像技術;(b)空間光干涉相位顯微術Fig.6 (a) Fourier phase microscopy (FpM); (b) Spatial light interference microscopy (SLIM)
低相干光源在離軸全息中也有運用。2012年,Basanta等提出了白光衍射相位成像技術[14](white light diffraction phase microscopy,wDpM),如圖7(a)所示。利用光柵的衍射特性在不犧牲穩定性的前提下,實現了快速成像。但它與其他離軸干涉不同之處在于,白光光源的引入有效抑制了散斑效應,提高了成像系統的分辨率。值得一提的是,該小組提出的SLIM和wDpM雖分屬不同干涉方式但卻有其各自的優勢,不足之處在于前者對光源要求較高,后者提升分辨率的同時犧牲了視野范圍。2013年,白光傅里葉相位顯微技術[47](white light fourier phase microscopy,wFpM)被提出,它不僅繼承了雙方優點還在一定程度上彌補了它們的短板,基本原理見圖7(b)。低相干鹵素白光作為照明光源,低時間相干性抬升了其空間靈敏度,共幾何光路有助于光路抵抗噪聲干擾。該技術的成像速率高達每秒12.5 幀,空間靈敏度高,橫向分辨能力強,創新性的運用同軸技術檢測動態相位信息。
眾多的QpI在對生物細胞顯微成像和結構特征分析方面產生了深遠影響。其優異特性是傳統光學顯微鏡和諸多電子顯微鏡等成像手段無法比擬的。尤其是“相位”這一概念的提出為生命科學研究注入了新的活力,具有很大的發展潛質。比如傳統臨床血液檢測往往基于流式細胞光散射原理,只有分類計數等基本功能。結合QpI之后,血液檢測還可以對單一細胞進行病理分析,為醫療診斷提供更有力的依據。在成像質量方面,如今多數QpI分辨率只能達到微米量級,對于生物細胞的成像研究還停留在形態檢測和分類識別階段。低相干QpI雖說不受散斑效應的影響分辨能力優于激光QpI,但技術尚不成熟,在成像效率和穩定性方面仍有提升空間。所以目前研究對象以紅細胞等均質細胞為主,分辨率限制了對于細胞復雜內部結構的定量表征。另外由于相位恢復需要耗時的數據運算,其成像效率也會受限。
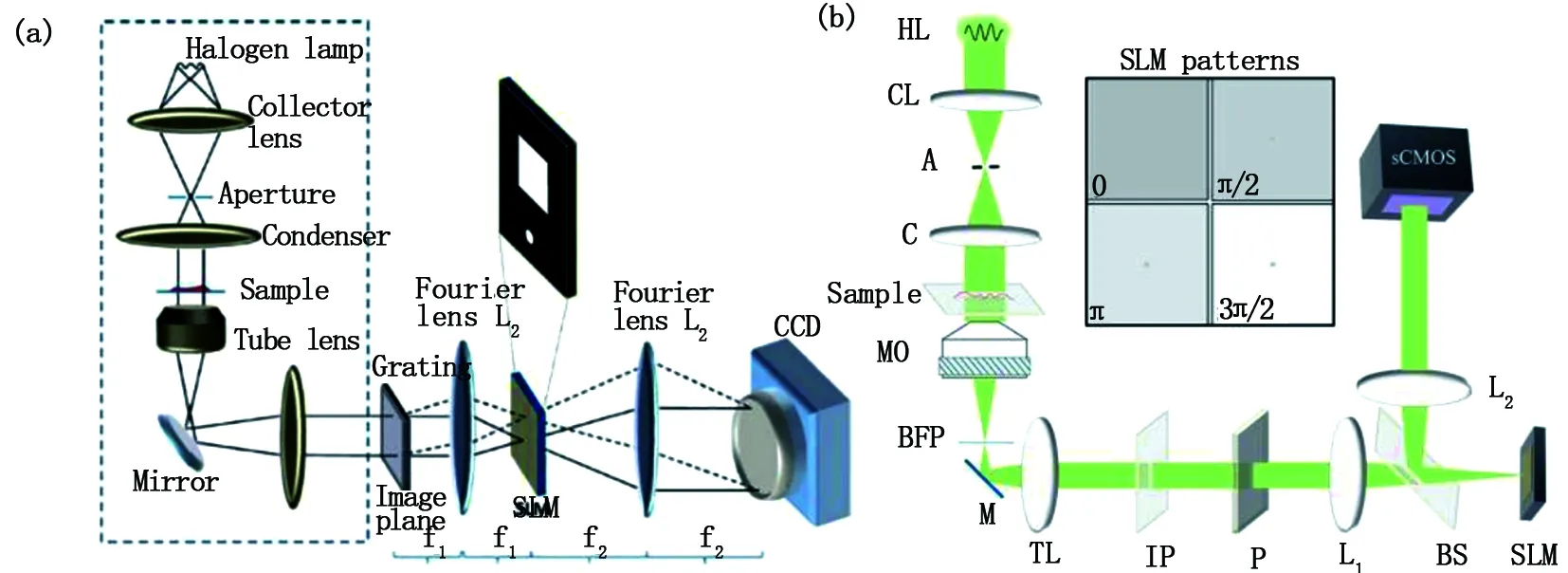
圖7 (a)白光衍射相位成像技術;(b)白光傅里葉相位顯微技術Fig.7 (a) White light diffraction phase microscopy (wDpM); (b) White light fourier phase microscopy (wFpM)
3 太赫茲波成像技術
太赫茲成像是太赫茲技術較為基礎的研究領域。由于太赫茲波在很多材料中傳輸性能良好,并且單光子能量極低,不會對生物組織產生有害的電離輻射等影響,因此太赫茲技術被廣泛運用于材料探查、港口車站安檢以及生物組織無損檢測等成像領域[48]。太赫茲成像技術主要有:連續太赫茲波二維成像技術、太赫茲波(三維)相干層析成像技術[49]。
3.1 連續太赫茲波二維成像技術
2006年,英國的Mahon等在100 GHz波段對毫米波數字全息進行了相關實驗研究[50,51]。如圖8(a)所示采用的是離軸全息的成像模式。利用耿氏二極管振蕩器產生太赫茲波,十字形定向耦合器實現物參光束分離。拋物面鏡調節參考光角度與物光發生干涉,最后由點源探測器掃描記錄圖樣完成信息采集。
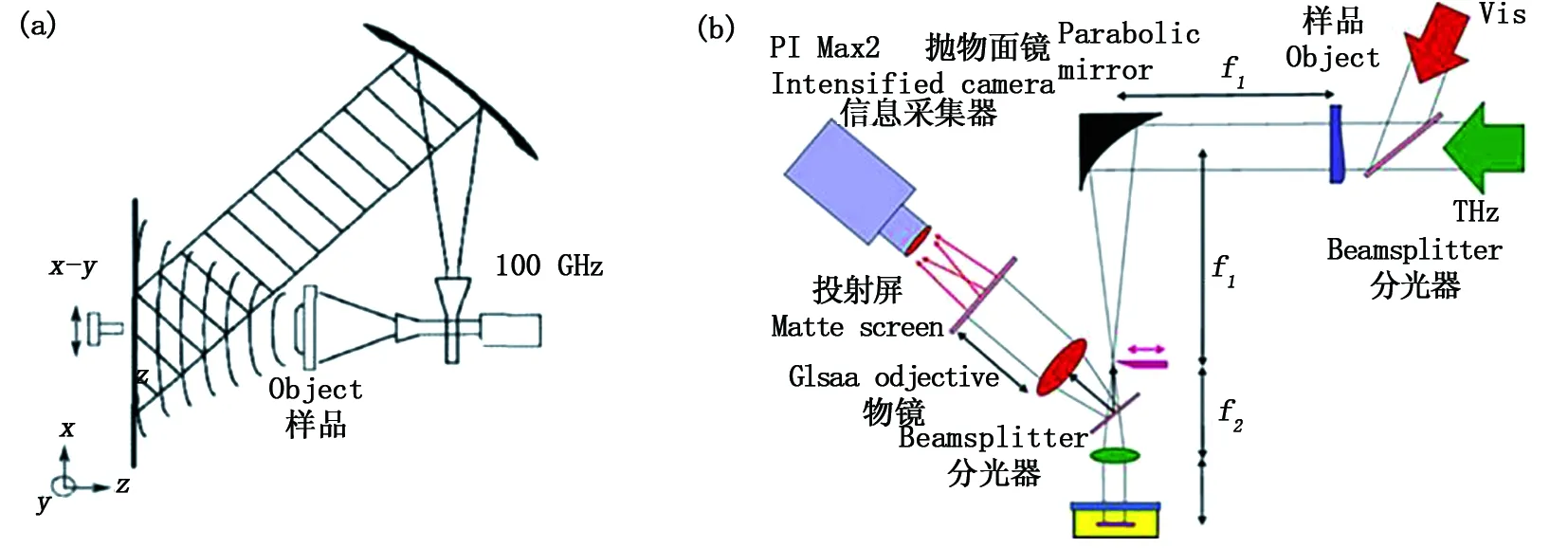
圖8 (a)毫米波數字全息技術;(b)自由電子激光全息成像技術Fig.8 (a) Millimeter-wave digital holographic configuration; (b) Digital holographic with free-electron laser
北京首都師范大學張巖團隊于2008年對太赫茲光波的空域傳輸進行了數值仿真和實驗研究[52]。該方法以角譜理論為原理,無需參考光干涉記錄,通過飛秒激光抽運產生太赫茲波,由CCD記錄太赫茲復振幅時域波形,最后整合數據得到全息圖。2010年Knyazev等利用可調諧太赫茲自由電子激光器在130 μm和68 μm兩波段進行了一系列的Gabor同軸數字全息實驗研究[53,54],基本光路如圖8(b)所示。該實驗裝置可獲得較大的成像視場,這主要是由于在信息采集時熱影像板的引入,太赫茲輻射的二維數字全息圖最后由CCD記錄采集。
2011年美國的Martin等[55]通過對13.5 GHz和16.0 GHz毫米波進行多次倍頻后獲得0.66~0.76 THz的可調諧太赫茲輻射波,其平均功率約50 μW。成像實驗光路如圖9(a)所示。裝置采用離軸干涉的方式,通過探測器二維掃描來獲取全息圖。另外由于信息處理中選用頻域濾波和角譜法,實驗圖避免了零級衍射的干擾,最小分辨率為2 mm。哈爾濱工業大學可調諧激光技術國家級重點實驗室在 2011年進行了2.52 THz數字全息成像實驗[56],其裝置如圖9(b)所示。實驗裝置中四個鍍金離軸拋物面鏡用于對太赫茲波的水平調節,實驗中以分辨率板為樣品來檢測系統分辨率,實驗圖顯示0.4 mm條紋完全可以分辨。后又通過減小物體到探測器距離,達到了0.2 mm的分辨能力。
由表4可知,實驗8周后,只有在群體交往一致性方面實驗組和對照組無顯著性差異(P>0.05),在總體凝聚力及凝聚力其他3個維度方面實驗組和對照組均存在顯著性差異(P<0.05);在任務凝聚力方面實驗組與對照組存在顯著性差異(P<0.05)。具體表現為,實驗組成員實驗后,對課程教學目標和任務更加清晰,團隊歸屬感和榮譽感增強,愿意為共同的目標共同努力、刻苦訓練;同學們交往也更加密切、融洽。
2014年,李琦等以CO2激光抽運激光器為輻射源產生連續太赫茲波,進行了Gabor同軸數字全息成像實驗[57],待測物體選用聚四氟乙烯基底電路板,其分辨率分別為0.4 mm和0.6 mm,采集不同距離下的多組實驗結果,最后運用對應的算法理論完成了圖像重建。實驗裝置如圖10(a)所示。同年,北京工業大學王大勇等提出了連續太赫茲同軸數字全息成像技術[58],實驗裝置如圖10(b)所示。輻射源同樣選用CO2抽運連續太赫茲波激光器,頻率參數為2.52 THz。太赫茲波從輻射源出射,首先通過兩拋物面鏡對太赫茲波進行擴束整形,之后太赫茲波透射樣品攜帶信息,散射光和非散射光在記錄面發生干涉最終被探測器采集。該系統達到了橫向0.3 mm縱向0.4 mm的分辨能力。
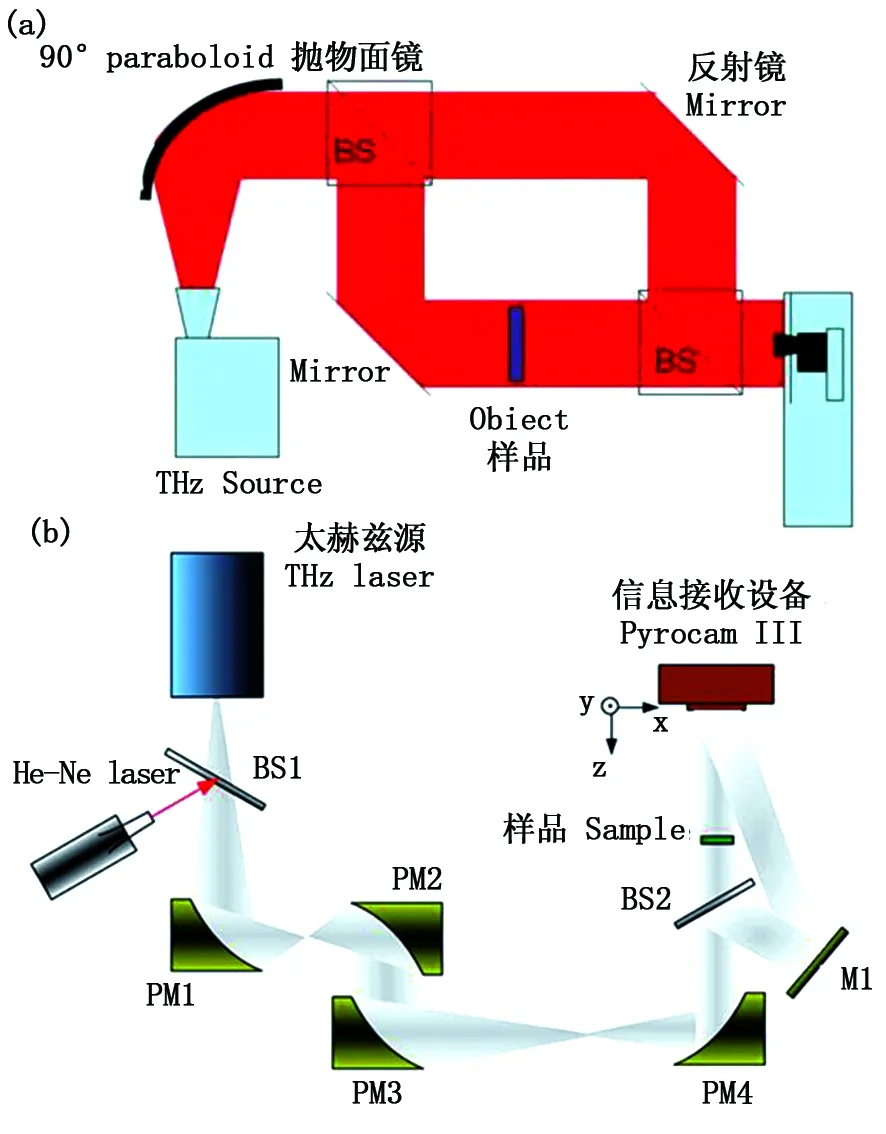
圖9 (a)Martin等的太赫茲數字全息記錄技術;(b)哈工大的連續太赫茲波數字全息技術Fig.9 (a) Digital holographic recording configuration by Martin; (b) Continuous-wave terahertz digital holography by Harbin Institute of Technology
3.2 太赫茲波(三維)相干層析成像技術
太赫茲相干層析技術的主要原理與三維QpI[36-40]類似,即一束太赫茲波透射待測樣品后通過控制樣品移動,使太赫茲波多方位多角度透射待測樣品,攜帶的樣品信息最終被記錄下來通過計算機運算處理以獲得待測樣品的三維形態。
2002年,Ferguson等首先提出一種太赫茲透射層析成像技術[59]。2004年,Simon等進一步發展了這一技術[60],基本光路如圖11(a)。實驗通過改變樣品的水平角度,太赫茲波從多個角度透射以獲取樣品不同角度下的光強相位等信息。但是若被測物體結構特殊對光波形成較大干擾,或是待測樣品無法進行旋轉等操作時,此技術將不再適用,故應用范圍較小。2009年,Christian等提出一種快速主動式連續太赫茲反射層析成像技術[61]。如圖11(b)所示,該技術基于雷達原理,通過連續波譜調制法來獲取被測物體的形態、位置等信息。速度快,只需幾秒即可獲得物體的三維圖像。該系統具有效率高、穩定性好等優勢。
同年,Jun Takayanagi等提出一種太赫茲飛行時間三維成像技術[62],基本原理如圖12(a)所示。該技術通過記錄樣品不同層面的光波信號進行三維形態解構,信噪比高且動態范圍更廣,縱向分辨率可達300 μm。但是,受掃描方式影響,系統成像時間較長。基于傳統手段分辨率低、成像耗時長的弱點,華中科技大學姚建銓院士等于2013年提出了太赫茲相干層析成像技術[49]。該技術輻射源具有相干性低、光頻帶寬等特點,可實現高精度的縱向掃描成像。如圖12(b)所示,該技術以頻率輸出范圍1~20 THz的中壓汞燈作為輻射源。選用厚度為500 μm鍍金反射鏡和300 μm的低阻硅作為待測物體,實驗結果證明其縱向分辨率可達100 μm,成像能力優于其他太赫茲三維成像技術。
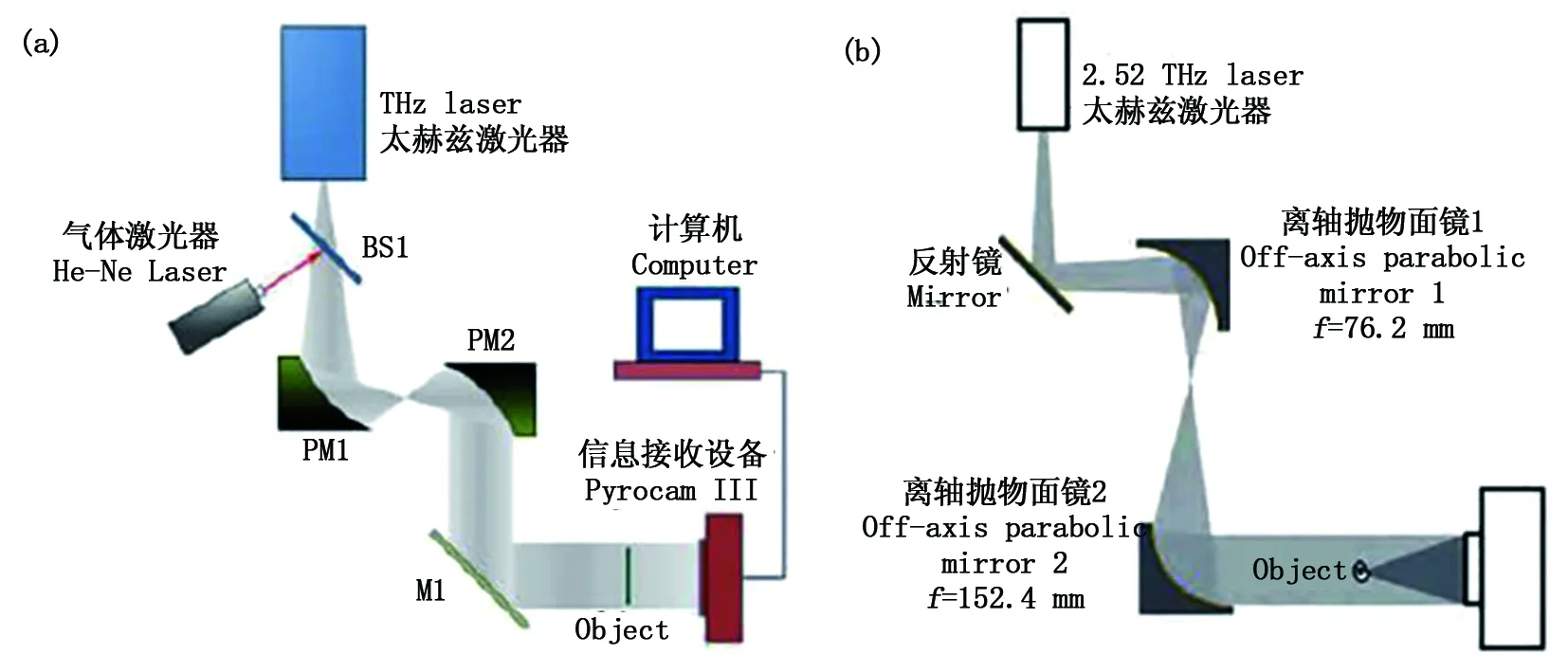
圖10 (a)李琦等的連續太赫茲波數字全息技術;(b)連續太赫茲波同軸數字全息技術Fig.10 (a) Continuous-wave terahertz digital holography by Li; (b) Continuous-wave terahertz in-line digital holography
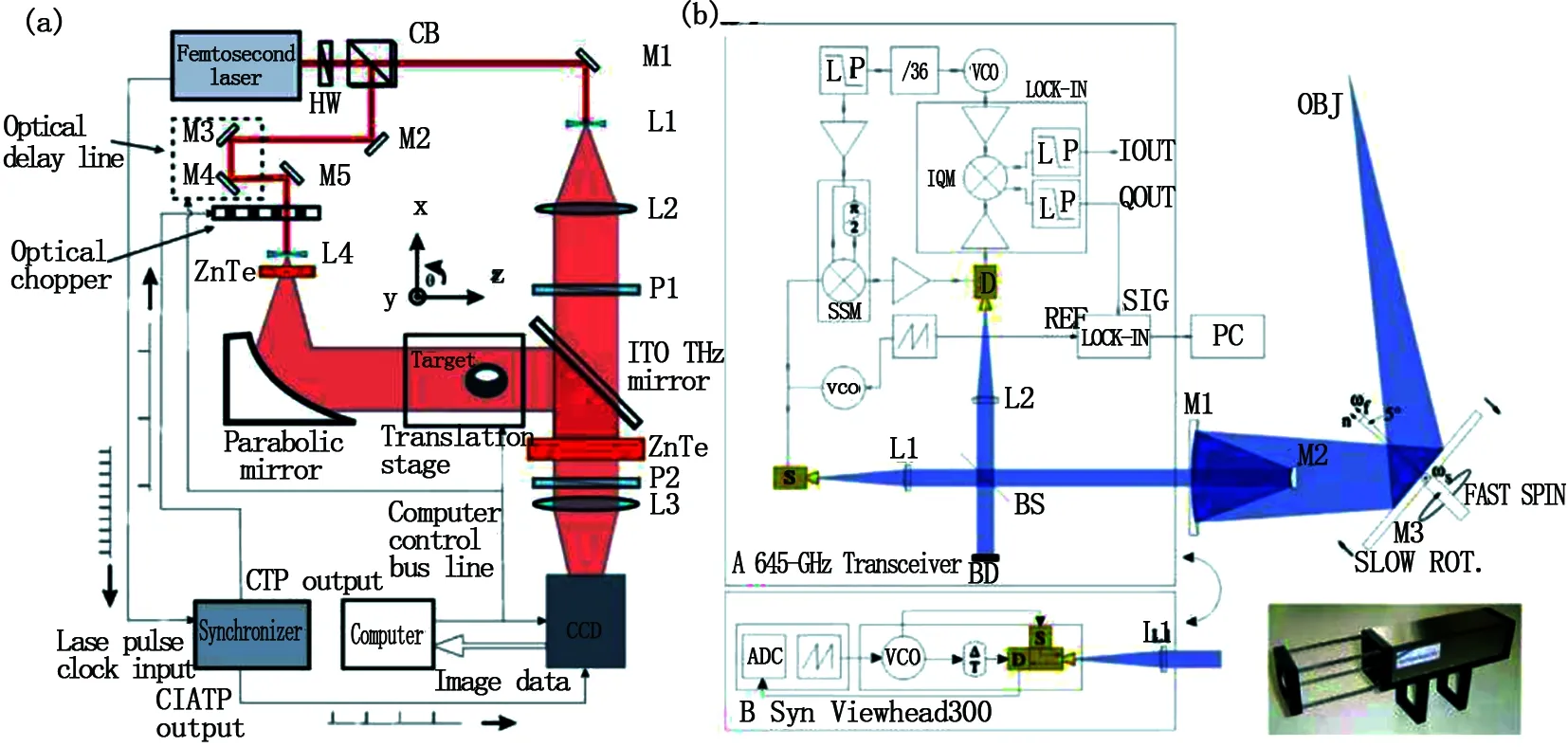
圖11 (a)太赫茲透射層析成像技術;(b)太赫茲反射層析成像技術Fig.11 (a) Transmission terahertz tomography; (b) Reflection terahertz tomography
從太赫茲波成像技術的發展進程可以看出,該研究最大的瓶頸在于如何獲取穩定理想的太赫茲輻射波。獲取方式有倍頻、光電導或者激光震蕩等。但是采用倍頻或者光電導法的輻射源不容易達到輻射功率以及相干性等參量要求,而且這類方法輻射源的元器件較多,體積偏大,不利于實驗運用。而激光震蕩不僅可以產生連續的太赫茲波,而且輻射功率穩定、相干性良好,可以直接獲取樣品場復振幅。另外輻射源體積較小,相對廉價的實驗成本更有利于廣泛應用。當下主流的太赫茲激光器有:CO2抽運連續氣體激光器、自由電子激光器以及量子計量激光器等等。雖然目前較為先進的太赫茲成像技術已經具有動態檢測的能力,但由于波長較長,受限于阿貝原理,成像系統的分辨率不理想,只能達到幾百微米。相較于其他成像技術,太赫茲波成像技術在分辨率上仍有一定的發展空間。
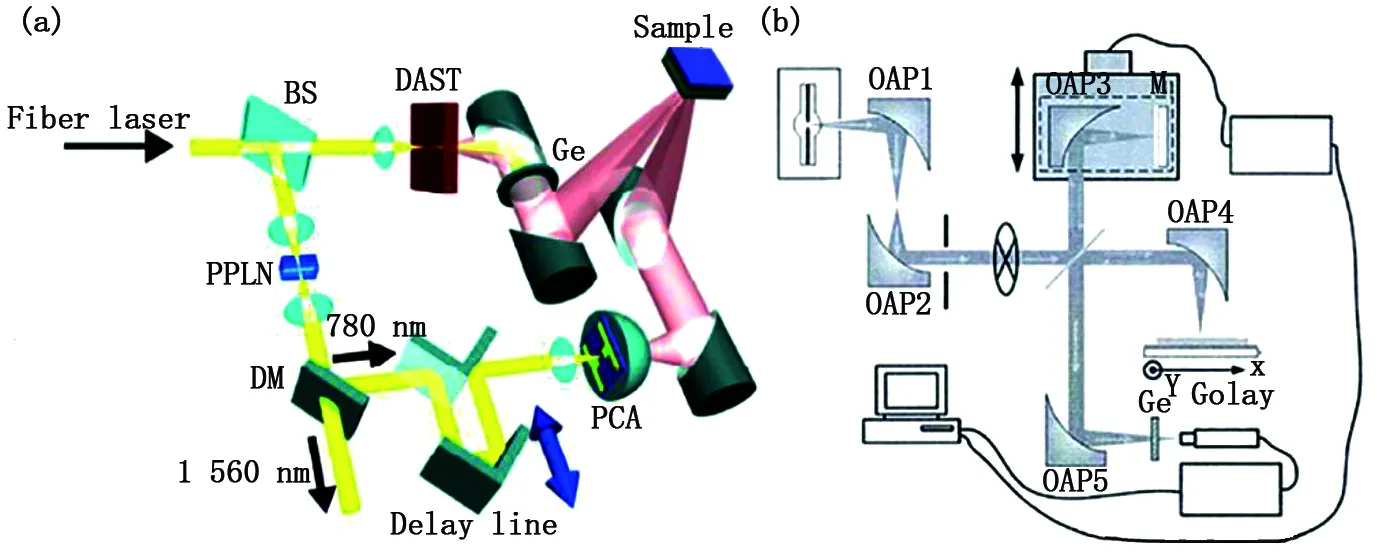
圖12 (a)太赫茲飛行時間三維成像技術;(b)太赫茲相干層析成像技術Fig.12 (a) High-resolution time-of-flightterahertz tomography; (b) Terahertz coherent tomography
4 結構光超分辨成像技術
從原理上講,成像系統的分辨率取決于光波長和物鏡數值孔徑(NA)的大小。根據阿貝衍射定律,傳統光學顯微手段極限橫向分辨率約為200 nm,導致顯微技術對小于光源波長特征尺度的微觀物質結構難以觀測。近年來,生命科學逐漸成為主流的研究方向,在該領域納米尺度成像需求的推動下,伴隨著光源、信號探測設備等新型器件的不斷進步,新的成像理論接踵而至[63]。其中可突破衍射極限的SIM可將系統分辨率提高到100 nm以內,甚至達到50 nm左右,被視為活體生物細胞觀測最有效的手段之一[64]。
4.1 二維結構光超分辨成像技術
最早從事SIM研究的小組主要有美國的Gustafsson團隊和英國倫敦的Heintzmann團隊。1999年,Heintzmann等首先提出了橫向調制激發顯微鏡[65](laterally modulated excitation microscopy,LMEM)的概念。他們利用水平方向激發的方式進行實驗,所得的高分辨率實驗結果印證了其高分辨率的成像能力,如圖13(a)所示。LMEM即是后來SIM的雛形。2000年,Gustafsson等發展了LMEM,并稱其為SIM,其基本思路是通過雙光束干涉的方法,在顯微物鏡焦平面形成高空間頻率余弦強度分布的條紋結構照明光場[66,67]。實驗測得該技術的橫向空間分辨率約為115 nm。2002年,Heintzmann等再次提出了飽和式激發顯微技術[68](saturated patterned excitation microscopy,SpEM)。該技術運用非線性飽和熒光激發,成像空間分辨率再次提升,實驗原理如圖13(b)所示。第二年他們運用二維光柵對SpEM實驗裝置進行了優化,二維光柵能同時產生兩個方向的結構光照明,通過計算機仿真運算,得到了57 nm的實驗結果[69]。
2005年,Gustafsson從實驗上進一步論證了SpEM技術的有效性,得到了50 nm左右的空間分辨率,并將此技術命名為飽和結構光照明顯微技術[70](saturated structured illumination microscopy, SSIM)。不過該技術中飽和熒光激發所需的高激發光強會損傷樣品,所以該技術不適于活體細胞檢測研究。2008年,Hirvonen等提出一種損傷性較低的新技術,其結構光的獲取方式改用可逆光轉換熒光蛋白[71],此類非線性光源無需高光強激發光進行熒光飽和,從原理上講是一大進步。但直到2012年,Gustafsson研究小組才用實驗證實了該理論。只不過他們雖然通過此方式獲得了非線性結構光照明,但實驗結果的空間分辨率仍然停留在約50 nm[72]。值得一提的是,早期的結構光照明顯微系統均使用衍射光柵產生結構照明光場,隨著SLM等新興器件在光學波前調控領域的廣泛使用,2009年,Hirvonen等首先采用早期的SLM替代光柵產生結構光條紋,成功實現了活細胞二維超分辨成像[73,74],如圖14所示。激光器發出的光經調制傳輸至反射式SLM接收面,形成的結構光條紋通過透鏡組調整經二向色鏡DM向下反射攜帶樣品信息,最后向上傳輸被CCD接收。
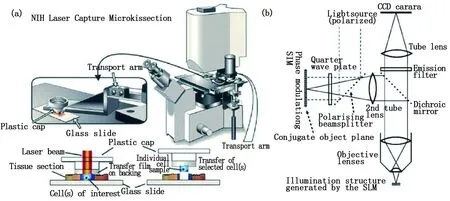
圖13 (a)橫向調制激發顯微鏡;(b)飽和樣式激發顯微技術Fig.13 (a) Laterally modulated excitation microscopy (LMEM); (b) Saturated patterned excitation microscopy (SpEM)
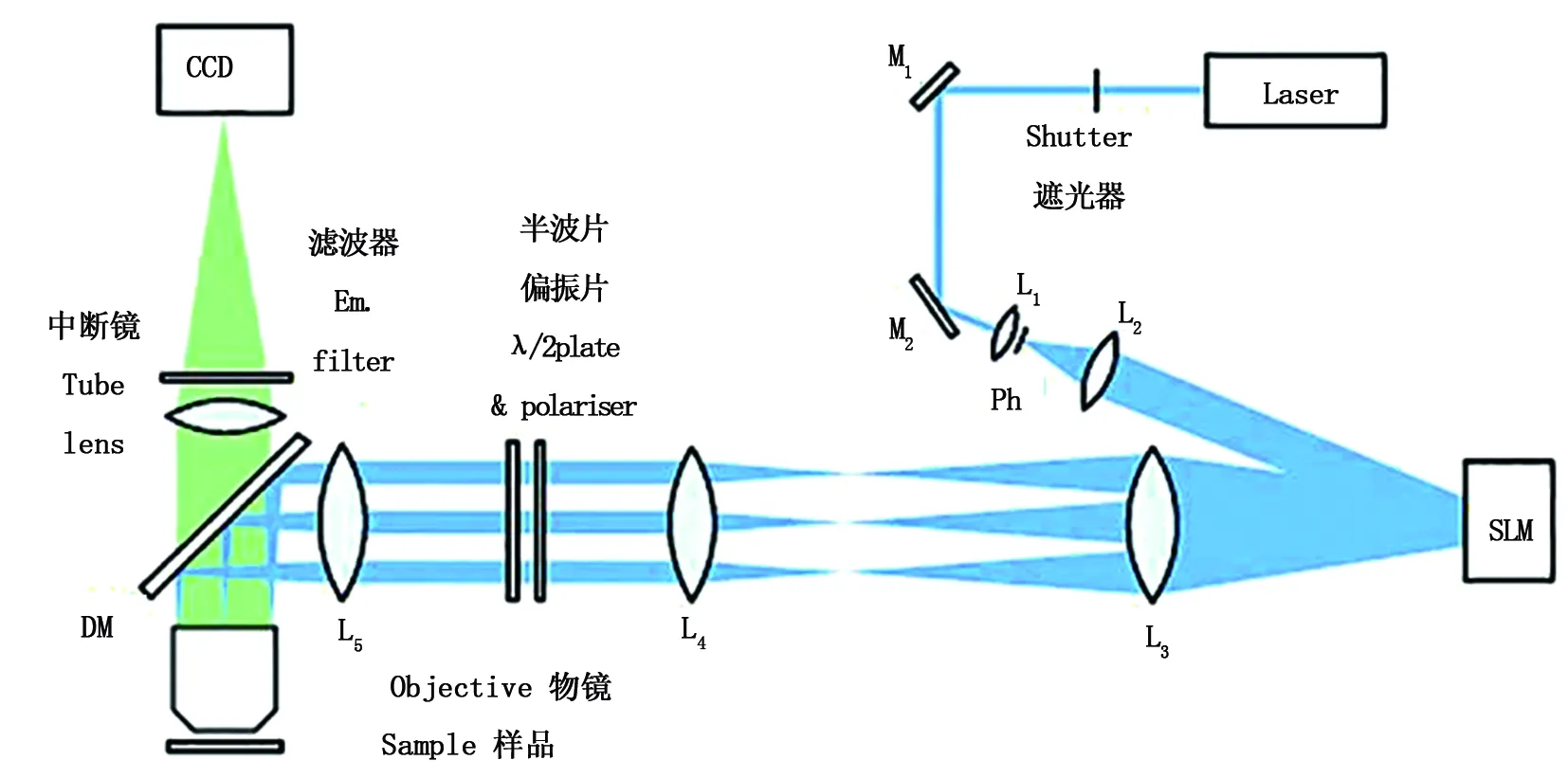
圖14 Hirvonen等的結構光超分辨技術Fig.14 Structured illumination microscopy (SIM) by Hirvonen
上述基于散射成像的SIM,雖然不需要對樣品進行熒光標定,但往往需要借助納米金微粒輔助成像來提升圖像對比度,應用范圍受限。2013年華中科技大學陳建玲等將SIM應用于相襯顯微成像[77](differential interference contrast,DIC),提出了一種超分辨結構光照明相襯成像技術[26](structured illumination differential interference contrast,SI-DIC),如圖15(b)所示。采用LED作為照明光源,光束同樣采用SLM產生結構光,光束經調制繼續向前傳輸進入DIC顯微鏡內,最后由CCD接收。選用聚苯乙烯小球為實驗樣品測試系統分辨率,得到了190 nm左右的實驗結果,相較傳統DIC分辨率有著明顯優化。雖然分辨率相對較低,但此技術結合了SIM的超分辨能力以及DIC對樣品無損傷、無熒光標定的優點,實現了樣品無侵入前提下較高質量的超分辨成像。
4.2 三維結構光超分辨成像技術
Gustafsson團隊于2008年實現了三維結構光照明超分辨熒光顯微成像,其雙向的三維成像分辨率都達到了100 nm,相較于傳統顯微技術分辨率有著2倍以上的提升[78-80]。裝置采用偏振光柵產生結構光,光束照射樣品攜帶信息并最終傳輸至CCD。基本光路如圖16(a)所示。2009年,該研究團隊用同樣的方式,將物理光柵替代為SLM來產生結構光照明,無需機械移動任何光學元件,大大縮短了結構模式的切換時間,從而實現了活細胞的超分辨成像[81]。2011年,Shao等基于SIM 獲得了活細胞3D超分辨圖像[82],并于第二年實現了雙色3D活細胞超分辨成像[83],該裝置采用空間不連續多模態激光光纖作為光源,液晶器件(LC)可調節結構光的偏振狀態,零級和一級衍射光可被旋轉掩模裝置選擇,結構光在物鏡后焦面匯聚攜帶樣品信息,最終由sCOMS接收記錄,實驗光路原理如圖16(b)所示。
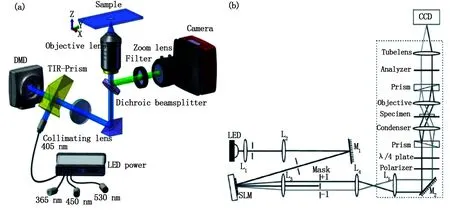
圖15 (a)數字微鏡結構光超分辨技術;(b)結構光照明超分辨微分干涉相襯顯微成像技術Fig.15 (a) Structured illumination microscopy (SIM) by digital micromirror device (DMD); (b) Structured illumination differential interference contrast (SI-DIC)
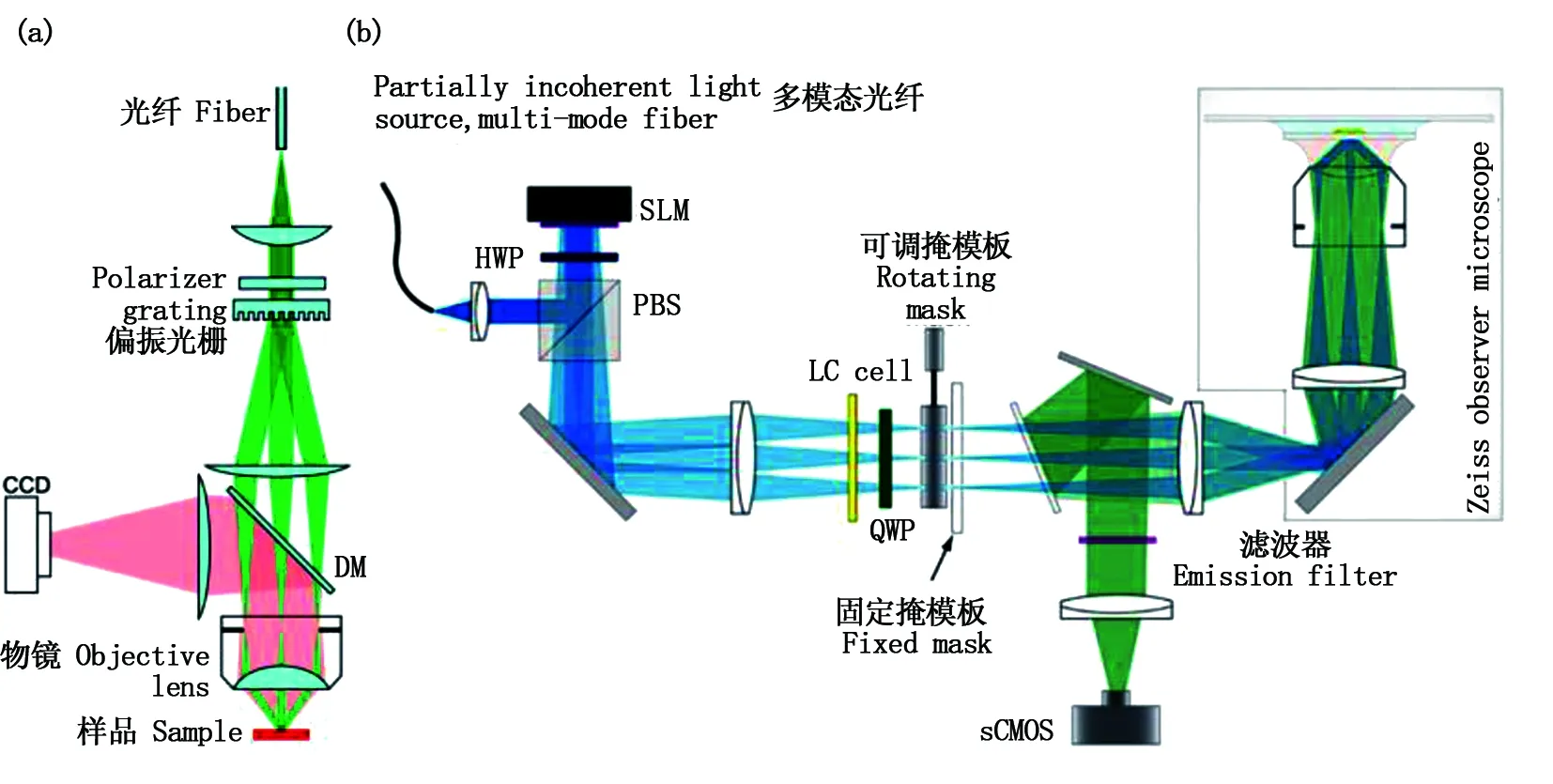
圖16 (a)Gustafsson的三維結構光照明超分辨成像技術;(b)雙色三維活細胞超分辨成像技術Fig.16 (a) 3D structured illumination microscopy (SIM) by Gustafsson; (b) 3D structured illumination microscopy (SIM) for living cell with two-tone
SIM和QpI技術在光束調制模塊都用到了SLM,但是調制的位置不同,QpI光束調制模塊針對攜帶樣品信息的干涉光,而SIM是針對光源發出的出射光。從實用性上講,SIM同樣具有低相干光QpI的優勢,能夠有效抑制散斑效應降低空間噪聲,增大系統分辨率,提高成像質量,實現超分辨成像。從靈活性上講,SIM還可以模塊化,可與其他技術相結合拓展更多的功能。另外,在三維重構方面,SIM不需要QpI相位恢復、解包等操作程序,只需要將獲取的多幅圖片進行疊加操作,過程簡單,耗時短,在生物細胞動態檢測和動力學行為分析領域具有潛在優勢。但當前SIM在對生物細胞成像時仍不能完全做到無損傷、無侵入,故需要在此方向上探究更安全的技術手段。
5 顯微成像技術的發展趨勢
隨著生命科學及其相關學科的飛速發展,人們迫切關注人體疾病發病機理、疾病診斷及治療手法等問題,生物細胞形態結構顯微成像以及亞表面特征識別研究越來越顯示出重要的意義與價值。在此過程中,科學家們不斷優化探索手段和研究技術,以便于更加深入的了解各類生命現象的本質。在眾多的探索手段和研究技術中,光學顯微這一具有悠久歷史的學科門類別具一格,已作為細胞檢測的主要技術。這一方向的研究熱度逐年升溫,吸引著大批研究學者的目光。各類基于光學原理的顯微技術紛至沓來,在細胞顯微成像、特征識別、參數測定以及動力學行為分析等領域的大量運用,很大程度上助推了生命科學的迅猛發展。
當下,QpI的主要研究對象仍為結構相對簡單的生物細胞,對此類細胞(如紅細胞)可實現顯微成像,定量分析。但對于內部結構較復雜的生物細胞(如白細胞、海拉細胞等)的研究還處于探索階段。由于這類生物細胞結構形態的特殊性,行之有效的相位恢復算法尚未提出。所以復雜結構生物細胞的顯微成像技術是一個發展方向。另外,相位體完整的三維信息解構才是技術發展的最終目標。TpM雖然能實現三維成像,還原樣品的形態分布和亞結構,但多角度掃描速度慢、效率低,不適合細胞的動力學行為分析。由此發展高效的三維QpI也是顯微成像技術的一個發展方向。
相較于其它光源顯微成像技術,太赫茲波成像技術一定程度上可以獲得更豐富的信息,在生物醫學成像、無損檢測、文物地質探測、安檢甚至軍事反恐等領域具有重要意義。但當下太赫茲輻射源種類繁多,有的輻射源體積龐大且價格不菲,大大限制了太赫茲成像技術的發展。提升其系統性能、優化實驗操作的同時降低使用成本是此類顯微成像技術的一個發展方向。另外,受限于波長的影響,太赫茲成像技術的分辨率較低(毫米量級),無法滿足生物組織與細胞高精度的觀測需求,而且在醫學光譜成像領域,還沒有完善的太赫茲光譜和成像技術標準。所以改良優化太赫茲成像技術分辨率的同時探尋太赫茲波在生物醫學診斷、生物細胞顯微成像領域的應用也是此類顯微成像技術的一個發展方向。
SIM可以打破衍射極限的限制,實現超分辨成像。不需要特別的熒光標記方法,分辨率較傳統顯微技術能提高一倍以上,在生物醫學研究領域具有很好的應用價值。但對于100 nm以下尺度生物細胞亞結構,SIM的分辨率仍顯不足。而且SIM在當前活細胞成像觀測中還存在光漂白、光毒性以及時間分辨率低等問題。隨著各類新型探針的發展,融合多種成像方式、優化正則圖像重構算法,推進其在生物醫學活體細胞動態成像方面的應用是顯微成像技術的又一發展方向。
6 結束語
本文介紹了基于高相干激光、低相干光、太赫茲波以及結構光的四類無標記顯微成像技術,對比分析了各類技術的原理及發展狀況,這些技術能夠提供微觀粒子的結構和形態特征等信息,為人類的探索研究提供了有力手段。在顯微成像技術的發展歷程中,其成像性能不斷提升,成像維度更加多元,應用范圍也愈發廣泛,取得了許多的研究成果。隨著人們對生命科學研究的關注熱度與日俱增,整合各類光源優勢致力于生物細胞顯微成像的發展將會是未來的研究重點。顯微成像技術有望不斷給生命科學、生物醫學等領域的研究帶來新的突破。
[1] 陳建玲. 結構光照明超分辨微分干涉相襯顯微成像技術[D]. 武漢:華中科技大學, 2013.
CHEN Jianling. Super-resolution differential interference contrast microscopy by structured illumination[D]. Wuhan: Huazhong University of Science and Technology, 2013.
[2] 李琦, 丁勝暉, 李運達, 等. 太赫茲數字全息成像的研究進展[J]. 激光與光電子學進展, 2012, 49(1):050006-1-050006-8.
LI Qi, DING Shenghui, LI Yunda,etal. Advances in research on THz digital holographic imaging[J]. Laser & Optoelectronics progress, 2012, 49(1):050006-1-050006-8.
[3] IKEDA T, GABRIEL p, DASARI R R,etal. Hilbert phase microscopy for investigating fast dynamics in transparent systems[J]. Optics Letters, 2005, 30(10):1165-1167.
[4] GABRIEL p, IKEDA T, BEST C A,etal. Erythrocyte structure and dynamics quantified by Hilbert phase microscopy[J]. Journal of Biomedical Optics, 2005, 10(6):060503-1-060503-6.
[5] GABRIEL p, IKEDA T, DASARI R R,etal. Diffraction phase microscopy for quantifying cell structure and dynamics[J]. Optics Letters, 2006, 31(6):775-777.
[6] CHALUT K J, BROWN W J, WAX A. Quantitative phase microscopy with asynchronous digital holography[J]. Optics Express, 2007, 15(6):3047-3052.
[7] NATAN T S, RINEHART M T, WAX A. Dual-interference-channel quantitative phase microscopy of live cell dynamics[J]. Optics Letters, 2009, 34(6):767-769.
[8] NATAN T S, ZHU Y Z, BADIE N,etal. Reflective interferometric chamber for quantitative phase imaging of biological sample dynamics[J]. Journal of Biomedical Optics, 2010, 15(3):030503-1-030503-7.
[9] ZHANG M G, MIKHAIL E K, GABRIEL p. Refractive index variance of cells and tissues measured by quantitative phase imaging[J]. Optics Express, 2017, 25(2): 1573.
[10] 郭瀾濤, 牧凱軍, 鄧朝, 等. 太赫茲波譜與成像技術[J]. 紅外與激光工程, 2013, 42(1):52-56.
GUO Lantao, MU Kaijun, DENG Chao,etal. Terahertz spectroscopy and imaging[J]. Infrared and Laser Engineering, 2013, 42(1):52-56.
[11] 蘇顯渝,張啟燦, 陳文靜. 結構光三維成像技術[J]. 中國激光, 2014, 41(2):0209001-1-0209001-10.
SU Xianyu, ZHANG Qican, CHEN Wenjing. Three-dimensional imaging based on structured illumination[J]. Chinese Journal of Lasers, 2014, 41(2):0209001-1-0209001-10.
[12] 劉宏翔, 姚建銓, 王與燁, 等. 太赫茲波近場成像綜述[J]. 紅外與毫米波學報, 2016, 35(3):301-309.
LIU Hongxiang, YAO Jianquan, WANG Yuye,etal. Review of THz near-field imaging[J]. Journal of Infrared and Millimeter Waves, 2016, 35(3):301-309.
[13] MOHAMMAD R, JAFARFARD S, TAYEBI B,etal. Dual-wavelength diffraction phase microscopy for simultaneous measurement of refractive index and thickness[J]. Optics Letters, 2014, 39(10):2908-2911.
[14] GABRIEL p, BASANTA B, HOA p. Diffraction phase microscopy with white light[J]. Optics Letters, 2012, 37(6):1094-1096.
[15] CHRIS E, BASANTA B, NGUYEN T,etal. Effects of spatial coherence in diffraction phase microscopy[J].Optics Express, 2014, 22(5):5133-5146.
[16] CHRIS E, BASANTA B, GABRIEL p,etal. Epi-illumination diffraction phase microscopy with white light[J]. Optics Letters, 2014, 39(21):6162-6165.
[17] pETER H. Terahertz technology[J]. IEEE Transactions on Microwave Theory and Techniques, 2002, 50(3):910-928.
[18] AUSTON D. picosecond optoelectronic switching and gating in silicon[J]. Applied physics Letters, 1975, 26(3):101-103.
[19] LEE C. picosecond optoelectronic switching in Gs As[J]. Applied physics Letters, 1977, 30(2):84-86.
[20] ZHANG X C, HU B B, Darrow J T,etal. Generation of femtosecond electromagnetic pulses from semiconductor surfaces[J]. Applied physics Letters, 1990, 56(11):1011-1013.
[21] 張蕾, 徐新龍, 李福利. 太赫茲成像的進展概況[J]. 量子電子學報, 2005, 22(2):130-134.
ZHANG Lei, XU Xinlong, LI Fuli. Review of the progress in T-ray imaging[J]. Chinese Journal of Quantum Electronics, 2005, 22(2):130-134.
[22] HELL W, WICHMANN J. Breaking the diffraction resolution limit by stimulated emission:stimulated-emission-depletion fluorescence microscopy[J]. Optics Letters, 1994, 19(11):780-782.
[23] BATES M, HUANG B, RUST M J,etal. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM)[J]. Nature Methods, 2006, 3(10):793-796.
[24] BETZIG E, pATTERSON H, SOUGRAT R,etal. Imaging intracellular fluorescent proteins at nanometer resolution[J]. Science, 2006, 313(5793):1642-1645.
[25] 袁操今, 馮少彤, 聶守平. 基于結構光照明的數字全息顯微術[J]. 中國激光, 2016, 43(6):0609003-1-0609003-12.
YUAN Caojin, FENG Shaotong, NIE Shouping. Digital holographic microscopy by using structured illumination[J]. Chinese Journal of Lasers, 2016, 43(6):0609003-1-0609003-12.
[26] CHEN J L, XU Y, LV X,etal. Super-resolution differential interference contrast microscopy by structured illumination[J]. Optics Express, 2013, 21(1):112-121.
[27] WAX A, NATAN T S, THOMAS M N,etal. parallel on-axis holographic phase microscopy of biological cells and unicellular microorganism dynamics[J]. Applied Optics, 2010, 49(15):2872-2878.
[28] NAZIF D, JURICA M, SOVIC I. Subtraction digital holography[J]. Applied Optics, 2003, 42(5):798-804.
[29] GAO p, YAO B L, MIN J,etal. parallel two-step phase-shifting digital holograph microscopy based on a grating pair[J]. Journal of the Optical Society of America B, 2011, 28(3):434-440.
[30] GAO p, YAO B L, MIN J,etal. parallel two-step phase-shifting point-diffraction interferometry for microscopy based on a pair of cube beams plitters[J]. Optics Express, 2011, 19(3):1930-1935.
[31] LUE N, GABRIEL p, IKEDA T,etal. Live cell refractometry using Hilbert phase microscopy[J]. Journal of physical Chemistry A, 2009, 113(47):13327-13330.
[32] GABRIEL p, YONGKEUN p, FELD M S,etal. Diffraction phase and fluorescence microscopy[J]. Optics Express, 2006, 14(8):8263-8268.
[33] GABRIEL p, FELD M S, TAKAHIRO I,etal. Diffraction phase microscopy[C]. Biomedical Topical Meeting, 2006.
[34] NATAN T S, RINEHART M T, WAX A,etal. Two-step-only phase-shifting interferometry with optimized detector bandwidth for microscopy of live cells[J]. Optics Express, 2009, 17(18):15585-15591.
[35] KUEHN J, COLOMB T, FLORIAN C,etal. Real-time dual-wavelength digital holographic microscopy with a single hologram acquisition[J]. Optics Express, 2007, 15(12):7231-7242.
[36] LAUER V. New approach to optical diffraction tomography yielding a vector equation of diffraction tomography and a novel tomographic microscope[J]. Journal of Microscopy, 2001, 205(pt 2):165-176.
[37] ANCA M, CUCHE E, FLORIAN C,etal. Cell refractive index tomography by digital holographic microscopy[J]. Optics Letters, 2006, 31(2):178-180.
[38] CHOI W, LUE N, DASARI R R,etal. Tomographic phase microscopy[J]. Nature Methods, 2007, 4(9):717-719.
[39] YOUNGCHAN K, HYOEUN S, KIM K,etal. profiling individual human red blood cells using common-path diffraction optical tomography[J]. Scientific Reports, 2014, 4(3):6659-6668.
[40] HASSAAN M, SHAMIRA S, MIR M,etal. Quantitative phase imaging for medical diagnosis[J]. Journal of Biophotonics, 2017, 10(2):1-29.
[41] ZERNIKE F. phase contrast, a new method for the microscopic observation of transparent objects[J]. physica, 1942, 9(10):974-980.
[42] GABRIEL p, LAUREN p D, LWAI H,etal. Fourier phase microscopy for investigation of biological structures and dynamics[J]. Optics Letters, 2004, 29(21):2503-2505.
[43] WANG Z, LARRY M, MIR M,etal. Spatial light interference microscopy[J]. Optics Express, 2011, 19(2):1016-1026.
[44] SRIDHARAN S, MIR M, GABRIEL p. Simultaneous optical measurements of cell motility and growth[J]. Biomedical Optics Express, 2011, 2(10):2815-2820.
[45] WANG Z, MILLET L, CHAN V,etal. Label-free intracellular transport measured by spatial light interference microscopy[J]. Journal of Biomedical Optics, 2011, 16(2), 026019-1-026019-9.
[46] MAJEED H, GABRIEL p. Breast cancer diagnosis using spatial light interference microscopy[J]. Journal of Biomedical Optics, 2015, 20(11):111210-1-111210-6.
[47] BASANTA B, KRISHNARAO T, GABRIEL p. Fourier phase microscopy with white light[J]. Biomedical Optics Express, 2013, 4(8):1434-1441.
[48] 何明霞, 陳濤. 太赫茲科學技術在生物醫學中的應用研究[J]. 電子測量與儀器學報, 2012, 26(6):471-483.
HE Mingxia, CHEN Tao. Application of terahertz science and technology in biology and medicine research[J]. Journal of Electronic Measurement and Instrument, 2012, 26(6):471-483.
[49] 左志高. 太赫茲相干層析成像及相關功能器件研究[D]. 華中科技大學博士學位論文, 2013:35-42.
ZUO Zhigao. A dissertation submitted in partial fulfillment of the requirements for the degree of doctor of philosophy in engineering[D]. Doctoral Dissertation of Huazhong University of Science and Technology, 2013:35-42.
[50] MAHON R J, MURpHY J A, LANIGAN W. Digital holography at millimeter wavelengths[J]. Optics Communications, 2006, 260(2):469-473.
[51] MCAULEY I, MURpHY J A, TRAppE N,etal. Applications of holography in the millimeter-wave and terahertz region[C]. SpIE, 2011, 7938(1):75-78.
[52] ZHANG Y, ZHOU W H. Terahertz digital holography[J]. Strain, 2008, 44(5):380-385.
[53] KNYAZEV B A, KULIpANOV G N, VINOKUROV N A. Novosibirsk terahertz free electron laser:instrumentation development and experimental achievements[J]. Measurement Science and Technology, 2010, 21(5):054013-054017.
[54] KNYAZEV B A, BALANDIN A L, CHERKASSKY V S,etal. Classic holography tomography and speckle metrology using a high-power terahertz free electron laser and real-time image detectors[C]. International Conference on Infrared Millimeter and Terahertz Waves, 2010:1-3.
[55] MARTIN S H, MYUNG K K, GREGORY D A,etal. Terahertz digital holography using angular spectrum and dual wavelength reconstruction methods[J]. Optics Express, 2011, 19(10):9192-9200.
[56] DING S H, LI Q, LI Y D,etal. Continuous-wave terahertz digital holography by use of a pyroelectric array camera[J]. Optics Letters, 2011, 36(11):1993-1995.
[57] 李琦, 胡佳琦. 太赫茲Gabor同軸數字全息記錄距離實驗研究[J]. 中國激光, 2014, 41(2):0209020-1-0209020-7.
LI Qi, HU Jiaqi. Experimental investigation on recording distance of terahertz Gabor in-line digital holography[J]. Chinese Journal of Lasers, 2014, 41(2):0209020-1-0209020-7.
[58] 王大勇, 黃昊翀, 周遜, 等. 連續太赫茲波同軸數字全息相襯成像[J]. 中國激光, 2014, 41(8):0809003-1-0809003-6.
WANG Dayong, HUANG Haochong, ZHOU Xun,etal. phase-contrast imaging by the continuous-wave terahertz in-line digital holography[J]. Chinese Journal of Lasers, 2014, 41(8):0809003-1-0809003-6.
[59] FERGUSON B, WANG S, GRAY D,etal. T ray computed tomography[J]. Optics Letters, 2002, 27(15):1321-1314.
[60] SIMON S W, ZHANG X. pulsed terahertz tomography[J]. Journal of physics D:Applied physics, 2004, 37(4):R1-R36.
[61] CHRISTIAN A W, WOLFF V S, HENNEBERGER R,etal. Fast active THz cameras with ranging capabilities[J]. Journal of Infrared Millimeter Terahertz Waves, 2009, 30(12):1981-1296.
[62] JUN T, HIROKI J, ICHINO S,etal. High-resolution time-of-flight terahertz tomography using a femtosecond fiber laser[J]. Optics Express, 2009, 17(9):7533-7539.
[63] 周興, 但旦, 千佳, 等. 結構光照明顯微中的超分辨圖像重建研究[J]. 光學學報, 2017, 37(3):0318001-1~0318001-12.
ZHOU Xing, DAN Dan, QIAN Jia,etal. Super-resolution reconstruction theory in structured illumination microscopy[J]. Acta Optica Sinica, 2017, 37(3):0318001-1-0318001-12.
[64] 文剛, 李思黽, 楊西斌, 等. 基于激光干涉的結構光照明超分辨熒光顯微鏡系統[J]. 光學學報, 2017, 37(3):0318003-1-0318003-11.
WEN Gang, LI Simin, YANG Xibin,etal. Super-resolution fluorescence microscopy system by structured light illumination based on laser interference[J]. Acta Optica Sinica, 2017, 37(3):0318003-1-0318003-11.
[65] HEINTZMANN R, CREMER C. Laterally modulated excitation microscopy:Improvement of resolution by using a diffraction grating[C]. proceedings of the SpIE, 1999, 3568:185-196.
[66] GUSTAFSSON M G L. Surpassing the lateral resolution limit by a factor of two using structured illumination microscopy[J]. Journal of Microscopy-oxford, 2000, 198 (part 2):82-87.
[67] COGSWELL C J. Doubling the lateral resolution of wide-field fluorescence microscopy using structured illumination[C]. proceedings of the SpIE, 2000:141-150.
[68] CREMER C, HEINTZMANN R, JOVIN T M. Saturated patterned excitation microscopy-a concept for optical resolution improvement[J]. Journal of the Optical Society of America A-Optics Image Science and Vision, 2002, 19(8):1599-1609.
[69] HEINTZMANN R. Saturated patterned excitation microscopy with two-dimensional excitation patterns[J]. Micron, 2003, 34(6-7):283-291.
[70] GUSTAFSSON M G L. Nonlinear structured-illumination microscopy:Wide-field fluorescence imaging with theoretically unlimited resolution[C]. proceedings of the National Academy of Sciences of the United States of America, 2005, 102(37):13081-13086.
[71] HIRVONEN L. Structured illumination microscopy using photoswitchable fluorescent proteins[J]. proceedings of the SpIE, 2008, 6861(3):15.
[72] REGO E H, SHAO L, MACKLIN J J,etal. Nonlinear structured-illumination microscopy with a photoswitchable protein reveals cellular structures at 50-nm resolution[J]. proceedings of the National Academy of Sciences of the United States of America, 2012, 109(3):E135-E143.
[73] HIRVONEN L M, WICKER K, MANDULA O,etal. Structured illumination microscopy of a living cell[J]. European Biophysics Journal, 2009, 38(6):807-812.
[74] pETER K, BRYANT B C, GRIFFIS E,etal. Super-resolution video microscopy of live cells by structured illumination[J].Nature Methods, 2009, 6(5):339-342.
[75] DAN D, LEI M, YAO B,etal. DMD-based LED-illumination super-resolution and optical sectioning microscopy[J]. Scientific Reports, 2013, 3(1):1116-1119.
[76] RUAN Y Y, DAN D, ZHANG M,etal. Visualization of the 3D structures of small organisms via LED-SIM[J]. Frontiers in Zoology, 2016, 13(1):1-10.
[77] NOMARSKI G, WEILL A R. Application a la metallographie des methods interferentielles a deuxondes polarizes[J]. Rev Metall-paris, 1955, 2(1):121-128.
[78] GUSTAFSSON M G L, SHAO L, CARLTON p M,etal. Three-dimensional resolution doubling in wide-field fluorescence microscopy by structured illumination[J]. Biophysical Journal, 2008, 94(12):4957-4970.
[79] GUSTAFSSON M G L, AGARD D A, SEDAT J W. I5M:3D wide-field light microscopy with better than 100 nm axial resolution[J]. Journal of Microscopy-oxford, 1999, 195(part 1):10-16.
[80] SHAO L, ISAAC B, UZAWA S,etal. I5S:wide-field light microscopy with100-nm-scale resolution in three dimensions[J]. Biophysical Journal, 2008, 94(12):4971-4983.
[81] HIRVONEN L M, WICKER K, MANDULA O,etal. Structured illumination microscopy of a living cell[J]. European Biophysics Journal, 2009, 38(6):807-812.
[82] SHAO L, KNER p, REGO E H,etal. Super-resolution 3D microscopy of live whole cells using structured illumination[J]. Nature Methods, 2011, 8(12):1044-1046.
[83] FIOLKA R, SHAO L, REGO E H,etal. Time-lapse two-color 3D imaging of live cells with doubled resolution using structured illumination[J]. proceedings of the National Academy of Sciences of the United States of America, 2012, 109(14):5311-5315.

