針灸輔助造影劑對小鼠大腦光聲對比度的增強作用
吳 丹,蔣華北,2*
(1.電子科技大學電子科學與工程學院, 四川 成都 610054; 2.南佛羅里達大學醫學工程系, 美國 佛羅里達州 33620)
0 引言
光聲層析成像技術(photoacoustic tomography,pAT)這種無損成像模式最近十幾年一直迅速發展,其以信息檢測為依據,是一種根據生物組織內部的光學吸收差異,通過探測超聲信號來獲取光聲信息的生物醫學光子成像方法,這種結構與功能醫學成像技術非常具有發展前景[1-5]。pAT技術可借助外源造影劑來增加被測物體與周圍背景組織間的成像對比度,也可提高成像深度以及成像分辨率,同時外源造影劑可以增強系統的檢測靈敏度,幫助定位識別特定的組織[6-10]。
貴金屬納米顆粒現已被廣泛用作光聲成像造影劑,其由于表面等離子體共振效應,對于特定的光有很強的吸收。貴金屬納米顆粒不但具有優越的光學特性,且具有成熟的制備工藝和優異的表面結合特性,在光學與生物醫學領域應用很廣[11-13]。貴金屬納米粒子的線性光學特性(消光,吸收與散射)受粒子尺寸、形狀、材料及周圍介質介電特性等因素的強烈影響[11,13]。一般的貴金屬納米顆粒對光的吸收比傳統的染色分子對光的吸收要大幾個數量級[13]。此外,貴金屬納米顆粒表面還可以進行聚乙二醇(pEG)修飾,這樣可以增強其在體內的循環時間,減少其細胞毒性,并且可以是納米顆粒更加穩定,減少其聚合[11,13]。目前有很多貴金屬納米顆粒作為光聲成像造影劑,主要有兩種材料,金和銀。金納米球型顆粒(Au nanoparticles)的吸收峰一般集中在520-550 nm可見光譜范圍內,其直徑在20-80 nm范圍內變化,其吸收波長顆粒直徑的增加而增加[13],它很適合被用于做光聲活體實驗。
針灸中針法是指在傳統中醫理論的指導下把針具(通常指毫針)按照一定的角度刺入患者體內,運用捻轉與提插等針刺手法來對其特定部位(穴位)進行刺激從而達到治療疾病的目的。穴位,學名腧穴,指人體經絡線上特殊的點區部位[14,15]。大量研究表明,針灸穴位對人和動物的調節作用,與刺激神經系統的作用和調節作用密切相關。針刺可以對周圍神經系統包括腦干,下丘腦,基底節和大腦皮層產生不同的影響[14]。我們之前的光聲成像研究表明,針刺涌泉穴(KI01)和陽陵泉穴(GB34)可以無創地增加活體小鼠大腦皮層血流動力學參數[腦血流(cerebral blood flow,CBF)、血紅蛋白(total hemoglobin,HbT)濃度][16,17]。
在這項研究中,我們發展了一種基于針灸輔助造影劑的方法。此方法中,靜脈注射pEG-Au納米顆粒溶液作為成像造影劑,同時通過結合針刺小鼠陽陵泉穴位(GB34)來增加小鼠大腦皮層血紅蛋白濃度的方式,共同提高小鼠大腦皮層脈管系統的光聲響應,提高大腦皮層血管與周圍背景組織間的成像對比度與成像分辨率。據我們了解,這是第一次同時利用上述兩種外源輔助方法來對小鼠大腦皮層脈管系統進行清晰地高對比度的光聲層析成像。
1 材料和方法
1.1 實驗動物
本研究中使用22只體重在27 g至35 g之間的雄性健康無特定病原體動物(specific pathogen free,SpF)癌癥研究所(institute of cancer research,ICR)小鼠。所有動物實驗都得到了學校動物倫理委員會的批準。所有的小鼠在實驗過程中均利用濃度為10%的水合氯醛溶液施加麻醉,腹腔注射給藥劑量為4 mL/kg體重。利用一個恒溫系統來幫助維持小鼠體溫在(37±1)℃,這對于實驗過程中降低小鼠死亡率是至關重要的。成像前,利用電推剪去除鼠頭部和右后肢的毛發,然后用脫毛膏進行二次備皮。根據需要,位于右后肢的陽陵泉穴位用輕微的標記點標記。在成像期間,將小鼠放置在自制固定架子中,其頭部,尾部和四肢被限制活動,在小鼠頭上涂抹超聲波耦合劑。
1.2 實驗儀器
本項研究工作,主要使用自主搭建的環形掃描pAT系統進行實驗研究(見圖1)。在使用532 nm脈沖Nd-YAG激光器(Brilliant b,Quantel)作為激發光源,脈沖持續時間為6-9 ns,最大脈沖功率為400 mJ,脈沖重復頻率為1.25 Hz。在這項工作中,動物頭皮表面的脈沖光功率為10 mJ/cm2,在皮膚能承受的激光能量安全閾值之內。固定小鼠的自制架子放在一個高度可調的升降臺上。激光出口下方放置一個水槽,底部中央有一個開口,利用用透明的聚乙烯薄膜密封。小鼠頭皮與薄膜間接接觸,為了最大化傳輸超聲波,中間涂有超聲耦合劑。激光束經由凹透鏡擴束,然后經過毛玻璃均勻化。小鼠頭部在出射光照射后吸收光能,并產生光聲信號,利用一個放置在距離成像中心45 mm處的5 MHz中心頻率超聲換能器探測該光聲信號。通過步進電機控制超聲換能器進行旋轉,超聲換能器以成像目標為中心,2度為步長進行360度旋轉,因此在一個成像實驗中檢測180個探測位置的信號,單幅圖像采集時間大約2分24秒,最后利用延遲疊加重構算法通過光聲信號重建出光聲腦圖像。
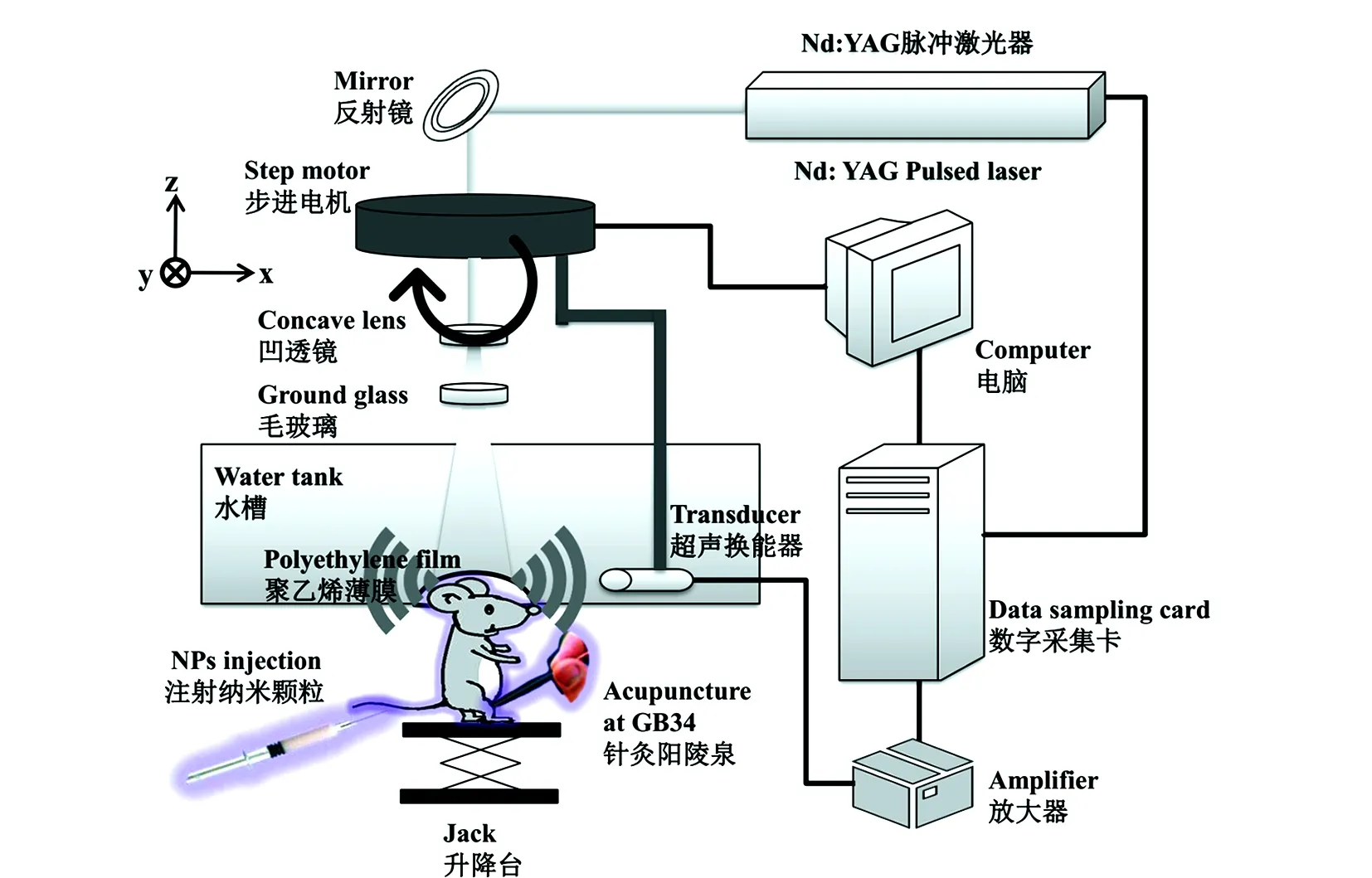
圖1 活體小鼠光聲層析成像系統結構圖Fig.1 Schematic of the home-made pAT system for in vivo mouse brain imaging
1.3 造影劑:金納米顆粒
在這項研究中,我們使用pEG-Au納米顆粒作為活體大腦光聲成像的造影劑。pEG-Au納米顆粒由成都盛泰爾生物醫藥科技有限公司合成。金納米顆粒的平均粒徑為40 nm,pEG包裹厚度為5-10 nm。掃描電子顯微鏡(scanning electron microscope,SEM)圖像顯示,溶液中具有45-50 nm尺寸的pEG-Au納米顆粒,參見圖2(a)。圖2(b)和2(c)分別描述了這種顆粒的吸收光譜和該溶液的實物照片。如吸收光譜所示,該納米顆粒在532 nm附近顯示出強烈的等離子體共振吸收峰。該溶液的濃度是1×1011Nps/mL或1.67×10-15mol/L(摩爾濃度)。圖2(d)表明,光聲信號幅度與pEG-Au納米顆粒溶液濃度之間存在正相關關系。此外,圖2(e)為裝有該溶液的離心管的高光學對比度pAT圖像。
1.4 針灸穴位選取
許多研究表明,針灸人或動物的特定穴位會引起功能性腦區的響應[18-25]。 陽陵泉穴(GB34)位于小鼠后肢的外側,在腓骨頭前下方的的凹陷處,皮下有股二頭肌,膝下外側動、靜脈和腓淺及腓深神經分布。GB34是足少陽之脈所入為合的合上穴,為八會穴之筋會[26]。大量的研究表明,針刺陽陵泉穴位時,患有急性腦卒中、帕金森病等神經性腦疾病的病人或動物會有不同程度的療效[27-31]。另外,本實驗室以往及近期的研究表明,針刺陽陵泉穴可以產生腦血流動力學改變,有助于緩解血管閉塞,改善體內小鼠腦血流灌注不足的血液供應[16,17]。本研究選擇位于小鼠右后肢的GB34作為刺激穴位(對比研究表明,針刺左側穴位與右側穴位之間無顯著性差異[16,17])。我們迅速地將無菌不銹鋼針(直徑:0.25 mm;長度:25 mm)垂直插入陽陵泉穴位處的皮膚中,深度為3-4 mm。然后我們手動將針頭以每分鐘60-70下的恒定頻率快速捻轉。與之前的研究操作方法一致,在針灸后的兩分半鐘,留針超過30分鐘。
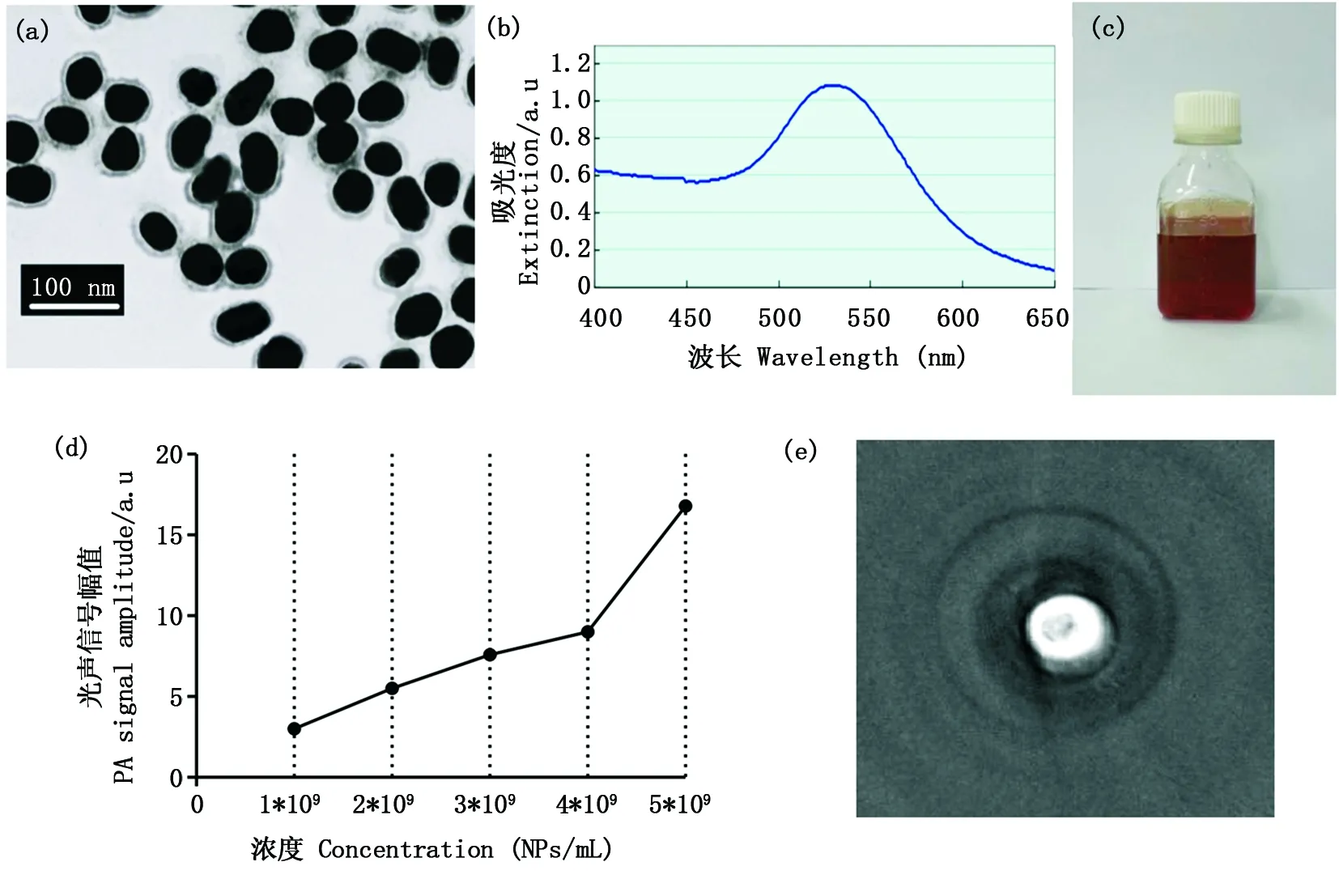
a:pEG-Au納米顆粒的SEM圖; b:吸收光譜圖;c:實物照片;d:光聲信號幅度與溶液濃度之間的關系曲線;e:裝有該溶液的離心管的光聲圖像。a: SEM image of the pEG-Au nanoparticles; b: Optical absorption spectrum; c: photograph of nanoparticle solution; d: Relationship between the solution concentration and relative pA signal amplitude; e: photoacoustic image of the tube containing solution.圖2 金納米顆粒的光學特性Fig.2 Optical properties of pEG-Au nanoparticles
1.5 實驗操作
為了評估在金納米粒子以及針灸陽陵泉穴位后小鼠大腦皮層脈管系統的光聲響應程度。我們設計了3組pAT實驗。各組小鼠進入麻醉狀態后,先將針灸位置與成像位置脫毛,在GB34穴位處做好標記,固定后進行光聲層析成像,整個準備過程大概需要20分鐘。小鼠每5分鐘進行一次pAT腦成像,所有小鼠都處在相同的實驗環境中。在第一組對照組實驗(Group I)中(Group I中使用6只小鼠,寫作n=6),我們將生理鹽水注射到小鼠尾靜脈中,在注射之前采集一幅圖像,在注射之后采集另外7幅圖像;第二組實驗(Group II,n=8)中,針刺陽陵泉穴位前后共采集8幅圖像;第三組實驗(Group III,n = 8)中小鼠接受兩輪外源刺激,第一輪中將pEG-Au Nps溶液連續兩次注射到小鼠尾靜脈中,每次注射劑量約為6.67×108Nps/g(體重),并且在注射前后共采集8幅圖像,之后同一批小鼠接受第二輪實驗,對每只小鼠在陽陵泉穴處施加針灸刺激,再采集7幅圖像,即Group III中每只小鼠從頭到尾共采集15幅圖像。在pAT實驗結束后,通過注射過量的水合氯醛讓小鼠安樂死。
1.6 統計分析
所有數值均以平均值±標準誤差(SEM)表示。 統計分析采用非配對t檢驗的方法,統計學顯著性定義為p≤ 0.05。
2 實驗結果與討論
2.1 對照組實驗
在這項研究中,為了評估在沒有外源刺激的實驗中,大腦皮層脈管系統在正常生理條件下的真實變化,故而設計一個對照組(Group I)。本組實驗中,每只小鼠都要接受尾靜脈生理鹽水注射。圖3(a)中顯示了Group I中的小鼠大腦皮層的一組光聲圖像,圖像右側的色標是經過歸一化的結果,圖3(b)表示Group I的時間軸。從圖中可以看出,相比于尾靜脈注射生理鹽水前,注射后的圖像中腦血管變得越來越不清晰,腦血管的光吸收以及成像對比度很明顯隨著整個時間軸呈下降趨勢,這個結果也許是由于小鼠在pAT實驗中,處于負壓狀態,負壓對血流有一定抑制作用影響。當動物的身體被綁在支架上,頭部被壓迫在聚乙烯薄膜下面時,可能會造成腦部暫時性的供血不足[32]。
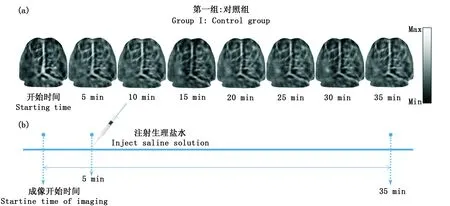
a:第一組實驗中的活體小鼠光聲腦圖像;b:第一組實驗時間軸a: In vivo photoacoustic images of a mouse brain from Group I; b: Experimental timeline for Group I圖3 對照組(第一組)實驗的光聲圖像Fig.3 photoacoustic images for the control group (Group I)
2.2 針灸組實驗
圖4(a)為針灸組(Groop II)中小鼠大腦皮層的八幅pAT圖像,圖4(b)表示Group II的時間軸。本組圖像中,利用了圖像相減的圖像處理方法,將針灸后的每一個時刻相對于針灸前增加的相對像素值部分用紫色色標來表示,即圖像中紫色代表腦血管光吸收或者光對比度增強的部分。與針刺前的圖像相比,針刺小鼠陽陵泉穴后,皮層靜脈血管能夠更清晰地顯像,皮層血管光學對比度得到增強。另外,在注射后15分鐘時,光吸收增長量到達峰值水平,之后光吸收增長量有所減少,但并未低于初始狀態,這可能是由于針刺效應在減弱。以上結果表明,針刺陽陵泉穴能促進CBF增強以及HbT濃度增加,這可能是由于血液供應增加和腦血管阻力降低所致血供改善,與之前本實驗室的研究結論一致[16,17],即針刺陽陵泉穴可激活一些大腦區域。然而,并不是所有的大腦區域在小鼠被針刺之后都具有增加的光學對比度。這表明針刺陽陵泉穴不會將小鼠皮層每一個腦區都激活。
2.3 造影劑組實驗以及復合組實驗
Groop III中小鼠接受兩輪外源刺激,第一輪(造影劑組,Groop III-1st)中將金納米顆粒溶液連續兩次注射到小鼠尾靜脈中,每次注射劑量約為6.67×108Nps/g(體重),并且在注射前后共采集8幅圖像如圖5(a)。在注射納米顆粒溶液后,大腦皮層血管與周圍背景組織間的成像對比度明顯大幅提高,與對照組的圖像相比,這個組的皮層脈管系統顯示的非常清晰。此外,注射納米顆粒之后造影劑點亮了一些“隱藏的”靜脈血管(由于其注射造影劑前對比度低而不可見),圖像中紅色部分代表第一輪腦血管光吸收或者光對比度增強的部分。可以看出,注射后15分鐘,光吸收增長量到達峰值水平。結果表明,造影劑可以有效地提高大腦皮層的對比度。在達到峰值后,由于腦血流很快會對納米顆粒有一定地清除,光吸收增長量緩慢下降,直到35 min后圖像采集結束時仍保持大于初始狀態的光吸收水平。此外,并非所有的大腦皮層區域光學對比度都體現出增強,這表明造影劑不能滲透到大腦皮層的每一個區域。
之后同一批小鼠接受第二輪實驗(復合組,Groop III-2nd),對每只小鼠在陽陵泉穴處施加針灸刺激,這時納米粒以及針刺陽陵泉穴同時作為外源刺激,再采集7幅圖像(見圖5(b)),即Group III中每只小鼠從頭到尾共采集15幅圖像。圖5(c)表示Groop III兩輪實驗的時間軸。在右腿外側針刺陽陵泉穴后,腦血管的對比度又出現第二輪的大幅提高,與第一輪的圖像相比,這個輪的皮層脈管系統顯示的更為清晰,圖像中藍色部分代表第二輪腦血管光吸收或者光對比度增強的部分。可以看出,在45 min處光吸收增長量到達第二個峰值,這是注射金納米顆粒溶液結合針刺小鼠陽陵泉穴位共同作用引起的小鼠大腦皮層脈管系統的光聲響應增強,Groop III驗證了針灸輔助金納米粒子的方法可以大大提高大腦皮層血管與周圍背景組織間的成像對比度與成像分辨率。
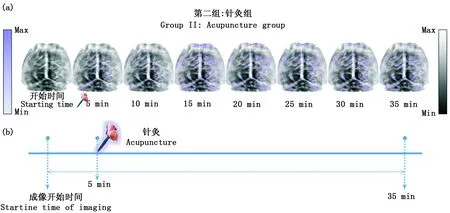
a:第二組實驗中活體小鼠光聲腦圖像;b:第二組實驗時間軸a: In vivo photoacoustic images of a mouse brain from Group II; b: Experimental timeline for Group II圖4 第二組實驗的光聲圖像Fig.4 photoacoustic images for the acupuncture group (Group II)
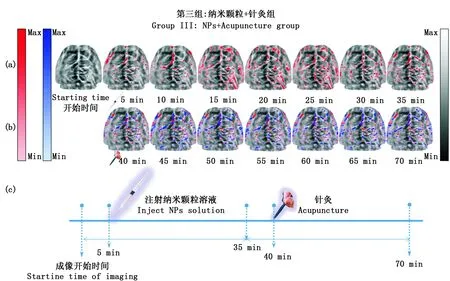
a,b:Group III-1st組和Group III-2nd組實驗中活體小鼠光聲腦圖像;c:第三組實驗時間軸a, b: In vivo photoacoustic images of a mouse brain from Group III-1st and Group III-2nd, respectively; c: Experimental timeline for Group III圖5 第三組實驗的光聲圖像Fig.5 photoacoustic images for the acupuncture group (Group III)
2.4 統計結果
我們根據上述三組實驗計算了的光聲腦圖像的相對光吸收變化率,對結果進行統計分析(具體參見圖6(a)),計算結果反映皮層脈管系統對單一或者復合外源刺激的響應。統計結果顯示,Group I的最大光吸收下降百分比為8.27%±6.05%(平均值±標準誤差SEM)。另外,試驗組(Group II,III)與對照組(Group I)之間有顯著性統計學差異(p<0.01)。Group II中針灸GB34引起的最大光吸收增長百分比為23.87%±15.95%,Group III-1st中造影劑引起的最大光吸收增長百分比為38.56%±50.82%。然后Group III-2nd中在兩者共同作用情況下,總的最大光吸收增長百分比為66.75%+70.87%,其最大增長率遠高于Group II和Group III-1st,并且大于兩者之和,由此可以推斷針刺陽陵泉穴位可能在一定程度上增加小鼠腦內金納米顆粒的傳遞。圖6(b)列出了Group I,II,III-1st以及III-2nd中腦血管光學對比度每隔5 min隨時間的變化情況。對于Group I,對比度先明顯下降,后保持在穩定水平。對于Group II和Group III-1st,對小鼠施加單一外源刺激后,腦血管對比度均在第15 min處出現峰值,之后呈現出緩慢的下降震蕩趨勢。對于Group III-2nd,對小鼠施加兩種外源刺激后,腦血管對比度在第10 min處出現統計學最大值,之后其變化呈現出緩慢的周期性震蕩趨勢。我們發現Group III-2nd組針刺引起的吸收統計峰值比Group II和Group III-1st早5 min。
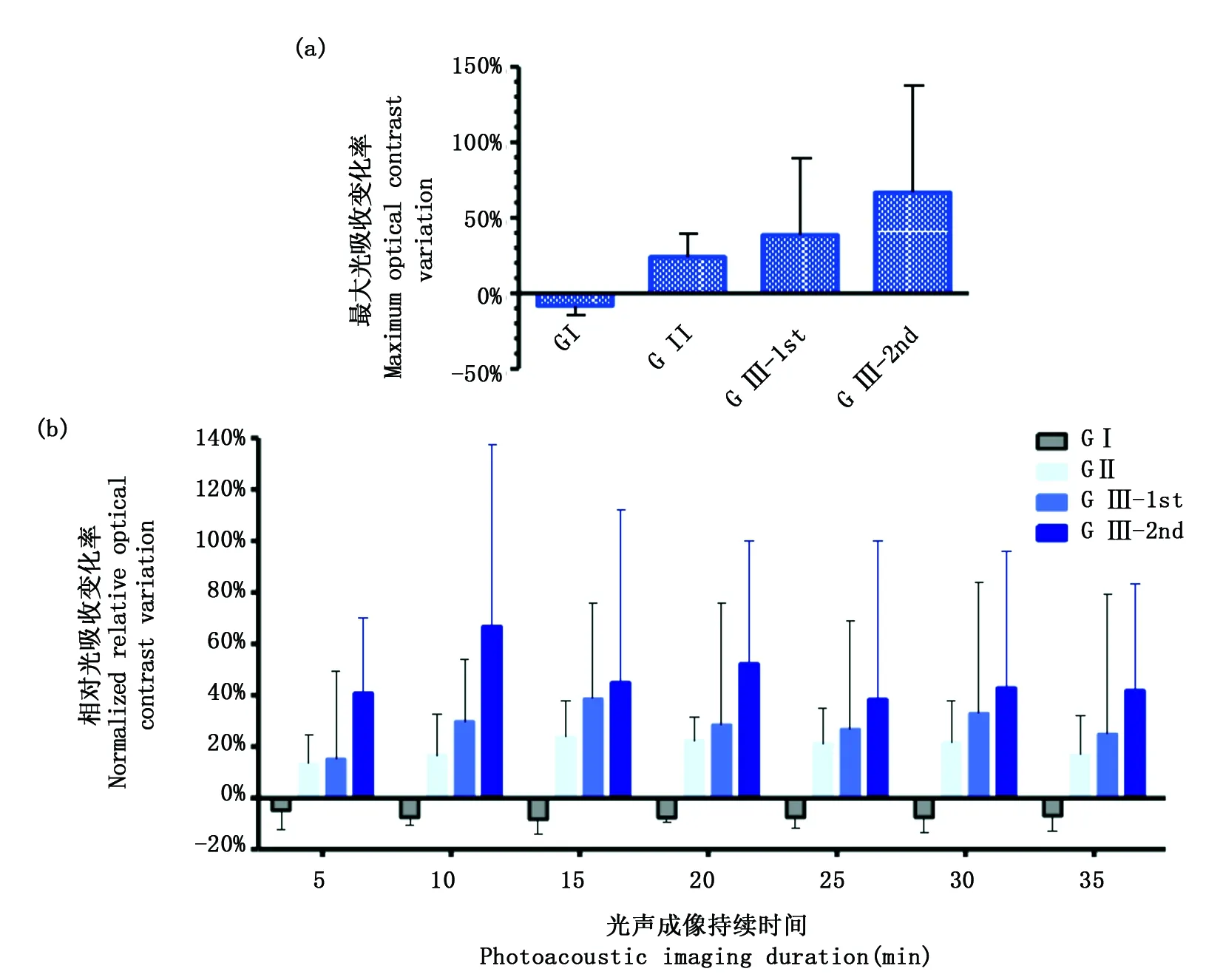
a:三組實驗中最大光吸收變化率的統計直方圖;b:三組實驗中隨時間軸改變的歸一化相對光吸收變化率的統計直方圖a: Histograms of maximum optical contrast variation for three groups of mouse experiments; b: Histograms of optical contrast variation over time for three groups of mouse experiments圖6 三組實驗的相對光吸收變化率統計結果Fig.6 Histograms of normalized relative optical contrast variation in the mouse brain for three groups of experiments
3 總結
本文開發了一種有效的提高對比度和成像分辨率的方法,該方法集合了兩個關鍵外源輔助方法,包括靜脈注射金納米顆粒溶液,以及針刺小鼠陽陵泉穴位(GB34)。利用自主搭建的pAT系統,我們成功地捕獲了由針灸輔助造影劑在活體小鼠大腦皮層中誘導的光學對比度隨時間的變化,證明了兩者共同作用產生的皮層光吸收增強的復合效應遠大于任何一種單獨作用產生的效應。結論揭示了該復合方法有助于更好提高小鼠大腦皮層脈管系統的光聲響應,提高大腦皮層血管與周圍背景組織間的成像對比度,并且能夠讓皮層血管更清晰的顯像。接下來,我們將利用靶向載藥金納米粒子應用于活體小鼠腦成像,這可能會進一步揭示針灸特定穴位與造影劑之間的相互作用機理,這將有助于研究促進造影劑以及藥物傳遞和分布的新方法。
[1] BELL A G. Upon the production and reproduction of sound by light[J]. Telegraph Engineers Journal of the Society of Telegraph Engineers, 1880, 9(34):404-426.
[2] BEARD p. Biomedical photoacoustic imaging[J]. Interface Focus, 2011, 1(4):602.
[3] TANG J, XI L, ZHOU J,etal. Noninvasive high-speed photoacoustic tomography of cerebral hemodynamics in awake-moving rats[J]. Journal of Cerebral Blood Flow & Metabolism Official Journal of the International Society of Cerebral Blood Flow & Metabolism, 2015, 35(8):1224.
[4] JIANG H. photoacoustic tomography[J]. IEEE Transactions on Medical Imaging, 2015, 34(12):2645.
[5] BO W, ZHOU J, CARNEY p,etal. A novel detachable head-mounted device for simultaneous EEG and photoacoustic monitoring of epilepsy in freely moving rats[J]. Neuroscience Research, 2014, 91(8):57-62.
[6] YANG H W, LIU H L, LI M L,etal. Magnetic gold-nanorod/ pNIpAAmMA nanoparticles for dual magnetic resonance and photoacoustic imaging and targeted photothermal therapy[J]. Biomaterials, 2013, 34(22):5651-5660.
[7] MUKAI M, SERIZAWA M. Silver nanoplate contrast agents forinvivomolecular photoacoustic imaging[J]. Acs Nano, 2012, 6(1):641-650.
[8] WANG B, ZHAO Q, BARKEY N M,etal. photoacoustic tomography and fluorescence molecular tomography:a comparative study based on indocyanine green[J]. Medical physics, 2012, 39(5):2512.
[9] pATEL M A, YANG H, CHIU p L,etal. Direct production of graphene nanosheets for near infrared photoacoustic imaging[J]. Acs Nano, 2013, 7(9):8147-8157.
[10] SHASHKOV E V, EVERTS M, GALANZHA E I,etal. Quantum dots as multimodal photoacoustic and photothermal contrast agents[J]. Nano Letters, 2008, 8(11):3953-3958.
[11] WU D, HUANG L, JIANG M S,etal. Contrast agents for photoacoustic and thermoacoustic imaging:a review[J]. International Journal of Molecular Sciences, 2014, 15(12):23616-23639.
[12] MILLSTONE J E, pARK S, SHUFORD K L,etal. Observation of a quadrupole plasmon mode for a colloidal solution of gold nanoprisms[J]. Journal of the American Chemical Society, 2005, 127(15):5312-5313.
[13] JAIN p K, LEE K S, EL-SAYED I H,etal. Calculated absorption and scattering properties of gold nanoparticles of different size, shape, and composition:applications in biological imaging and biomedicine[J]. Journal of physical Chemistry:B, 2006, 110(14):7238-7248.
[14] XU H, SUN H, CHEN S H,etal. Effects of acupuncture at Baihui (DU20) and Zusanli (GB34) on the expression of heat shock protein 70 and tumor necrosis factor α in the peripheral serum of cerebral ischemia-reperfusion-injured rats[J]. Chinese Journal of Integrative Medicine, 2014, 20(5):369-374.
[15] 趙敬軍, 李少源, 榮培晶, 等. 針灸穴位的作用及功能機制探討[J]. 世界科學技術:中醫藥現代化, 2014, 10(3):2076-2082.
ZHAO Jingjun, LI Shaoyuan, RONG peijing,etal. Investigation on effects and mechanism of acupoints[J]. Modernization of Traditional Chinese Medicine and Materia Medica-World Science and Technology, 2014, 10(3):2076-2082.
[16] CHEN B Z, YANG J G, WU D,etal. photoacoustic imaging of cerebral hypoperfusion during acupuncture[J]. Biomedical Optics Express, 2015, 6(9):3225-3234.
[17] LI T, XU X, CHEN B Z,etal. photoacoustic imaging of acupuncture effect in small animals[J]. Biomedical Optics Express, 2015, 6(2):433-442.
[18] CHUANG C M, HSIEH C L, LI T C,etal. Acupuncture stimulation at Baihui acupoint reduced cerebral infarct and increased dopamine levels in chronic cerebral hypoperfusion and ischemia-reperfusion injured Sprague-Dawley rats[J]. The American Journal of Chinese Medicine, 2007, 35(5):779-791.
[19] QIAN Y F, FAN X N, LI Y J,etal. Effects of acupuncture at different acupoints on cerebral blood flow in cerebral ischemia model rats[J]. Chinese Acupuncture & Moxibustion, 2009, 29(3):213-216.
[20] LI G, HUANG L, Cheung R T,etal. Cortical activations upon stimulation of the sensorimotor-implicated acupoints[J]. Magn Reson Imaging, 2004, 22(5):639-644.
[21] ALIMI D, GEISSMANN A, GARDEUR D. Auricular acupuncture stimulation measured on functional magnetic resonance imaging[J]. Medical Acupuncture, 2002, 13(2):18-21.
[22] SIEDENTOpF C M, GOLASZEWSKI S M, MOTTAGHY F M,etal. Functional magnetic resonance imaging detects activation of the visual association cortex during laser acupuncture of the foot in humans[J]. Neuroscience Letters, 2002, 327(1):53-56.
[23] YOO S S, TEH E K, BLINDER R A,etal. Modulation of cerebellar activities by acupuncture stimulation:evidence from fMRI study[J]. Neuroimage, 2004, 22(2):932-940.
[24] CHO Z H, CHUNG S C, JONES J p,etal. New findings of the correlation between acupoints and corresponding brain cortices using functional MRI[J]. proceedings of the National Academy of Sciences, 1998, 95(5):2670-2673.
[25] ZHANG W T, JIN Z, ZHANG L,etal. Evidence from brain imaging with fMRI supporting functional specificity of acupoints in humans[J]. Neuroscience Letters, 2004, 354(1):50-53.
[26] 賈琪. 淺談“筋會陽陵”[J]. 時珍國醫國藥, 2008, 19(12):2972-2973.
JIA Qi. On the “Yanglingquan, influential point of tendons”[J]. Lishizhen Medicine and Materia Medica Research, 2008, 19(12):2972-2973.
[27] YEO S, CHOE I H, VAN D N M,etal. Acupuncture on GB34 activates the precentral gyrus and prefrontal cortex in parkinson’s disease[J]. Journal of Integrative Medicine, 2014, 14(3):336.
[28] CHEN X, ZHANG H, ZOU Y. A functional magnetic resonance imaging study on the effect of acupuncture at GB34 (Yanglingquan) on motor-related network in hemiplegic patients[J]. Brain Research, 2015, 1601(7):64-72.
[29] 彭源, 張瑾, 張廷碧, 等. 經皮穴位電刺激對腦卒中患者偏癱下肢運動功能的影響[J]. 廣州醫藥, 2015, 46(1):19-22.
pENG Yuan, ZHANG Jin, ZHANG Tingbi,etal. Effect of transcutaneous accupoint electrical stimulation on motor function recovery of the lower extremity of stroke patients[J]. Guangzhou Medical Journal, 2015, 46(1):19-22.
[30] 韓笑, 寧艷哲, 李匡時, 等. 基于功能磁共振成像的針刺陽陵泉對腦卒中患者執行控制網絡影響研究[J]. 中華中醫藥雜志, 2017, 5(32):2128-2131.
HAN Xiao, NING Yanzhe, LI Kuangshi,etal. Immediate effects of acupuncture at Yanglingquan (GB34) on executive control network in stroke patients based on fMRI technique[J]. China Journal of Traditional Chinese Medicine and pharmacy, 2017, 5(32):2128-2131.
[31] LIM S, CHOE I. Acupuncture on LR3 and GB34 has a neuroprotective effect in pD rat model[J]. Experimental Neurology, 2003, 180(1):93-98.
[32] YUAN S, NING M, WANG L,etal. Hemodynamics effect of negative pressure on ischemic extremity[J]. China Journal of Modern Medicine, 2003, 13(11):13-14.

