中華絨螯蟹“水癟子”病超微病理和病理生理研究
楊宗英,曾柳根,王玉蘭,姚 毅,侯玉潔,雷小青,許亮清,熊春賢,楊先樂
(1.南昌市農業科學院,江西 南昌 330038; 2.上海海洋大學 國家水生動物病原庫,上海 201306)
中華絨螯蟹(Eriocheirsinensis)又稱河蟹,是我國特有的名特優水產品,也是我國重要的養殖經濟蟹類。隨著20世紀80年代初期中華絨螯蟹人工繁育技術取得成功以后,其繁育技術和養殖技術日趨成熟,中華絨螯蟹的人工養殖發展迅速[1]。近年來,隨著養殖模式的不斷改善和發展,養殖產量也逐年上升。江蘇省是中國中華絨螯蟹養殖大省,2014年河蟹產值達到了40億美元[2]。興化市是江蘇省重要的河蟹主養區,所生產的河蟹具有金爪、黃毛、青殼、白肚的特點,被授予中國“河蟹養殖第一縣”的稱號,然而,2015年大面積暴發的中華絨螯蟹“水癟子”病對興化市的中華絨螯蟹養殖業造成了沉重的打擊,興化市80%以上的塘口出現了該病,發病率達到30%~40%[3]。據文獻[4]報道,該病在2010年在江蘇省就有發生,但是當時發病率較低,并未引起高度重視,2015年該病的首次暴發使河蟹養殖戶損失慘重。病蟹甲殼發黑、殼薄且脆,肝胰腺顏色變淡、萎縮甚至糜爛呈糨糊狀,頭胸甲積液,附肢肌肉萎縮剪斷附肢也有水狀液體流出,為此養殖戶形象地稱之為“水癟子”病[5]。之前報道的中華絨螯蟹肝胰腺疾病主要是中華絨螯蟹肝胰腺白化癥,病蟹主要表現的癥狀是肝胰腺發白,發病期主要集中在10月份河蟹上市時,且雄蟹的發病率明顯高于雌蟹[6];“水癟子”病蟹表現的癥狀主要是吃食減少或停止吃食,肝胰腺顏色變淡、壞死,發病期主要集中在5—8月份,雄蟹和雌蟹的發病率沒有明顯的差異[5]。
本課題組之前對病蟹進行的寄生蟲檢查、病原微生物分離回感、無菌濾液回感及病變組織的電鏡觀察等病原學研究表明,河蟹“水癟子”病為非病原性疾病,是受到一些不利環境因素脅迫所導致的[7]。本文在之前研究成果的基礎上,利用生化分析和組織學等方法對采自中華絨螯蟹“水癟子”病流行區的病蟹進行超微組織病理和病理生理分析,旨在了解該病的生理生化特征及在細胞水平了解該病的組織器官損傷,為闡明該病的病理變化過程及探討致病機制提供科學參考,也為在養殖過程中對該病的防控提供一定的指導。
1 材料與方法
1.1 實驗動物
實驗用患病中華絨螯蟹采自江蘇省興化市安豐鎮發病養殖塘,規格為(107.20±6.14)g,健康蟹采自江蘇省張家港市中華絨螯蟹養殖基地,規格為(111.20±6.10)g,采樣時間均為2016年10月份。所選用的病蟹主要臨床表現為病蟹肝胰腺淡黃色或土黃色,鰓絲水腫或稍發黑,附肢發軟,附肢肌肉萎縮;健康蟹肝胰腺呈橘紅色,肌肉飽滿。
1.2 主要實驗藥物和器材
藥品:丙酮(分析純),戊二醛(分析純),磷酸緩沖液(分析純),冰醋酸(分析純),二甲苯(分析純),無水乙醇(分析純),苦味酸均購買于上海國藥集團;鋨酸(鋨含量1%)購買于上海榕柏生物技術有限公司;蠟塊,蘇木精,伊紅,Epon 812樹脂均購買于上海生工生物工程有限公司;堿性磷酸酶(ALP),酸性磷酸酶(ACP),谷丙轉氨酶(GPT),谷草轉氨酶(GOT),糖原(Glycogen),葡萄糖(GLU)和考馬斯亮藍總蛋白測試試劑盒均購買于南京建成生物工程研究所。
儀器:冷凍離心機(BECKMAN COULTER AgllegraX-15R)、紫外分光光度計(普析通用T6-新世紀)、組織勻漿機(IKA T18)、超薄切片機(LEICA UC7)、透射電鏡(日立 HT7700)、酶標儀(BIOTEK ELX808)。
1.3 實驗方法
1.3.1 血清生理生化指標的測定
將病蟹和健康蟹分別置于冰水混合物中麻醉,用不加抗凝劑的注射器從河蟹第三步足基部抽取血淋巴,4 ℃下,4 024g離心 30 min,取上清液,用于葡萄糖和甘油三酯含量,堿性磷酸酶、谷丙轉氨酶和谷草轉氨酶活力的測定。
血清中上述指標的測定嚴格按照南京建成試劑盒使用說明書操作。其中ALP和TG的測定采用微量酶標法,ALP分解磷酸苯二鈉產生游離酚和磷酸,酚在堿性溶液中與4-氨基安替吡啉作用形成紅色醌衍生物,在520 nm處具有最大吸收峰,其定義為100 mL血清在37 ℃與基質作用30 min 產生1 mg酚為一個酶活力單位,最終結果轉換為U·L-1;TG的測定采用GPO-PAP 酶法,最終生成的醌類化合物顏色的深淺與TG的含量成正比,在510 nm處具有最大吸收峰,單位為mmol·L-1;GOT和GPT的測定采用賴氏法,以卡門氏單位報告結果,卡門氏單位的定義為1 mL血清,反應液總容量3 mL,340 nm波長,1 cm光徑,25 ℃,1 min內所生成的丙酮酸,使NADH氧化成NAD+而引起吸光度每下降0.001為一個卡門氏單位,1卡門氏單位=0.482 U·L-1,最終GOT和GPT的單位均表示為U·L-1;血糖的測定采用葡萄糖氧化酶-過氧化物酶法,在505 nm處具有最大吸收峰,單位為mmol·L-1。
1.3.2 肝胰腺生理生化指標的測定
待病蟹和健康蟹麻醉,抽取血淋巴后,打開甲殼,取少量肝胰腺,分別稱重后,按照質量(g)∶體積(mL)=1∶9的比例加入0.86%冰冷的生理鹽水,于冰浴中勻漿,制備肝胰腺10%組織勻漿液。4 ℃,4 024g,離心30 min,取上清,用于測定肝胰腺中總蛋白和肝糖原含量,酸性磷酸酶和堿性磷酸酶活力。
1.3.3 超微病理
分別取15只病蟹和5只健康蟹的肝胰腺、鰓、肌肉等組織,切成1~2 mm3的小塊,用2.5%戊二醛溶液前固定,用0.1 mol·L-1磷酸緩沖液沖洗3次,1%鋨酸后固定,0.1 mol·L-1磷酸緩沖液沖洗3次,固定樣品經酒精、丙酮梯度脫水,Epon 812樹脂包埋,制備超薄切片,透射電鏡觀察,觀察病變組織的超微病理變化及可能存在的病原生物。
1.4 數據處理
試驗所得數據用平均值±標準差(mean±SD)表示;病理生理指標均為3個樣品的平均值,采用Microsoft Office Excel 2007和SPSS 19.0對均值進行差異顯著性檢驗,顯著水平設為P<0.05,極顯著水平設為P<0.01。
2 結果與分析
2.1 病蟹血清生理生化指標的變化
病蟹血清生理生化指標的變化見表1。病蟹血糖含量和谷草轉氨酶活力為(18.54±2.67 )mmol·L-1和(55.38±3.44)U·L-1,均顯著高于健康蟹的(9.03±1.14)mmol·L-1和(38.65±5.78)U·L-1(P<0.05);病蟹血清堿性磷酸酶活力、谷丙轉氨酶活力分別為(38.13±4.07)U·L-1和(36.90±2.05)U·L-1,均極顯著高于健康蟹的(24.85±2.27)U·L-1和(26.66±1.00)U·L-1(P<0.01);病蟹血清甘油三酯的含量為(0.73±0.05)mmol·L-1,極顯著低于健康蟹的(0.87±0.01)mmol·L-1(P<0.01)。
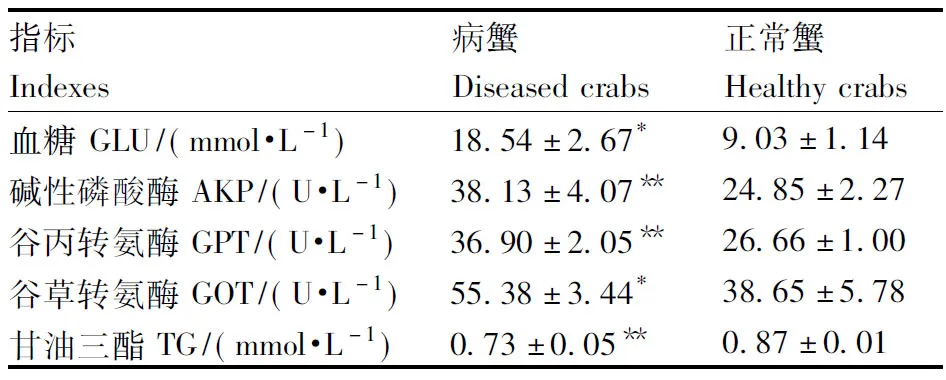
在同行數據間,“*”表示差異顯著(P<0.05);“**”表示差異極顯著(P<0.01)。下同。
Between the data on the same row, “*” indicates significant difference (P<0.05); “**” indicates significant difference atP<0.01. The same as below.
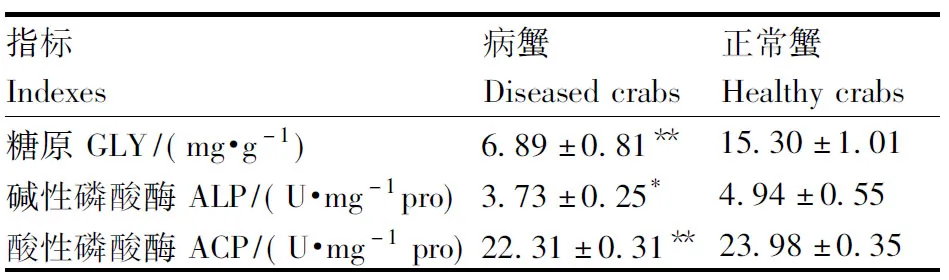
2.2 病蟹肝胰腺生理生化指標的變化
病蟹肝胰腺生理生化指標的變化見表2。病蟹肝糖原的含量為(6.89±0.81)mg·g-1,極顯著低于健康蟹肝糖原含量(15.30±1.01)mg·g-1(P<0.01);病蟹堿性磷酸酶活性為(3.73±0.25)U·mg-1,顯著低于健康蟹(4.94±0.55)U·mg-1(P<0.05);病蟹酸性磷酸酶活性為(22.31±0.31)U·mg-1,極顯著低于健康蟹(23.98±0.35)U·mg-1(P<0.01)。
2.3 病蟹肝胰腺超微結構病理變化
河蟹的肝胰腺由無數肝小管組成,肝小管是肝胰腺的結構和功能的基本單位,肝小管的中央是管腔。每一肝小管都是由位于基膜上的單層柱狀上皮細胞構成,細胞核排列整齊,細胞間界線清楚,上皮細胞分為胚細胞(EC)、分泌細胞(BC)、吸收細胞(FC)和儲存細胞(RC)。超微結構下,正常蟹肝胰腺上皮結構完整,管腔清晰,細胞間邊界清楚,R細胞管腔面具有發達且排列整齊的微絨毛,脂滴豐富,脂滴周圍具有豐富的線粒體和內質網,線粒體形狀規則,呈圓形或扁圓形,外膜平整,由內層膜折疊成的嵴排列緊密,尤其以靠近細胞頂端微絨毛處的線粒體數量較多,粗面內質網結構完整,內質網上附著有大量的核糖體(圖1-A、B)。
輕微病變肝胰腺,細胞間聯結清楚,微絨毛腫脹、斷裂、空泡化,R細胞中脂滴數量銳減,線粒體腫脹變形呈不規則狀,內嵴減少,部分線粒體大半體積或者整體呈空泡狀(圖1-C);F細胞中粗面內質網腫脹變形,內質網部分斷裂,出現一定數量的空泡(圖1-D),肝胰腺病變嚴重者,肝細胞內線粒體、內質網等細胞器大部分腫脹破裂,僅剩殘體(圖1-E),或者胞質完全降解,肝細胞出現空泡化壞死(圖1-F)。
2.4 病蟹鰓組織超微結構病理變化
中華絨螯蟹每條鰓都由具有支撐和運輸功能的鰓軸及向兩側發出的相互平行的鰓葉構成,正常鰓葉由外向內分別是角質膜,上皮細胞層和鰓腔,其中網狀的鰓腔由上皮細胞和柱狀細胞共同形成,鰓腔中有曲折迂回的通道,有少量游離的血細胞。超微結構下,正常河蟹鰓上皮細胞,細胞核結構完整,核內染色體分布均勻,細胞核周圍有大量的線粒體;角質層層面伸出許多指狀突起;上皮細胞頂膜具有豐富且排列緊密的微絨毛,微絨毛基部具有規則的角質膜下空腔;線粒體形狀規則,呈圓形或臘腸形,外膜平整,內膜向內折疊形成的嵴排列緊密(圖2-A、B)。
病變較輕的河蟹鰓上皮細胞,細胞核固縮,核內染色質呈異染色質化;角質膜變薄,角質層伸出的指狀突起數量減少;上皮細胞頂膜的微絨毛減少,排列疏松;角質膜下空腔變大,呈不規則狀;線粒體數量減少,基質稀薄,由內膜形成的嵴減少,部分線粒體腫脹,甚至空泡化(圖2-C);病變嚴重者,細胞核高度異染質化,邊緣皺縮,核膜模糊;細胞核周圍線粒體數量銳減,部分細胞器呈現空泡化,出現一定數量的溶酶體(圖2-D);病變最嚴重者,角質膜層伸出的指狀突起大部分腫脹,甚至破裂消失;角質膜下空腔變大,微絨毛幾乎全部破裂消失;大量線粒體空泡化,溶酶體數量增多,溶酶體和空泡化的線粒體或者小泡結合形成自噬體(圖2-E);上皮細胞中出現細菌顆粒(圖2-F)。
2.5 病蟹附肢肌肉超微病理變化
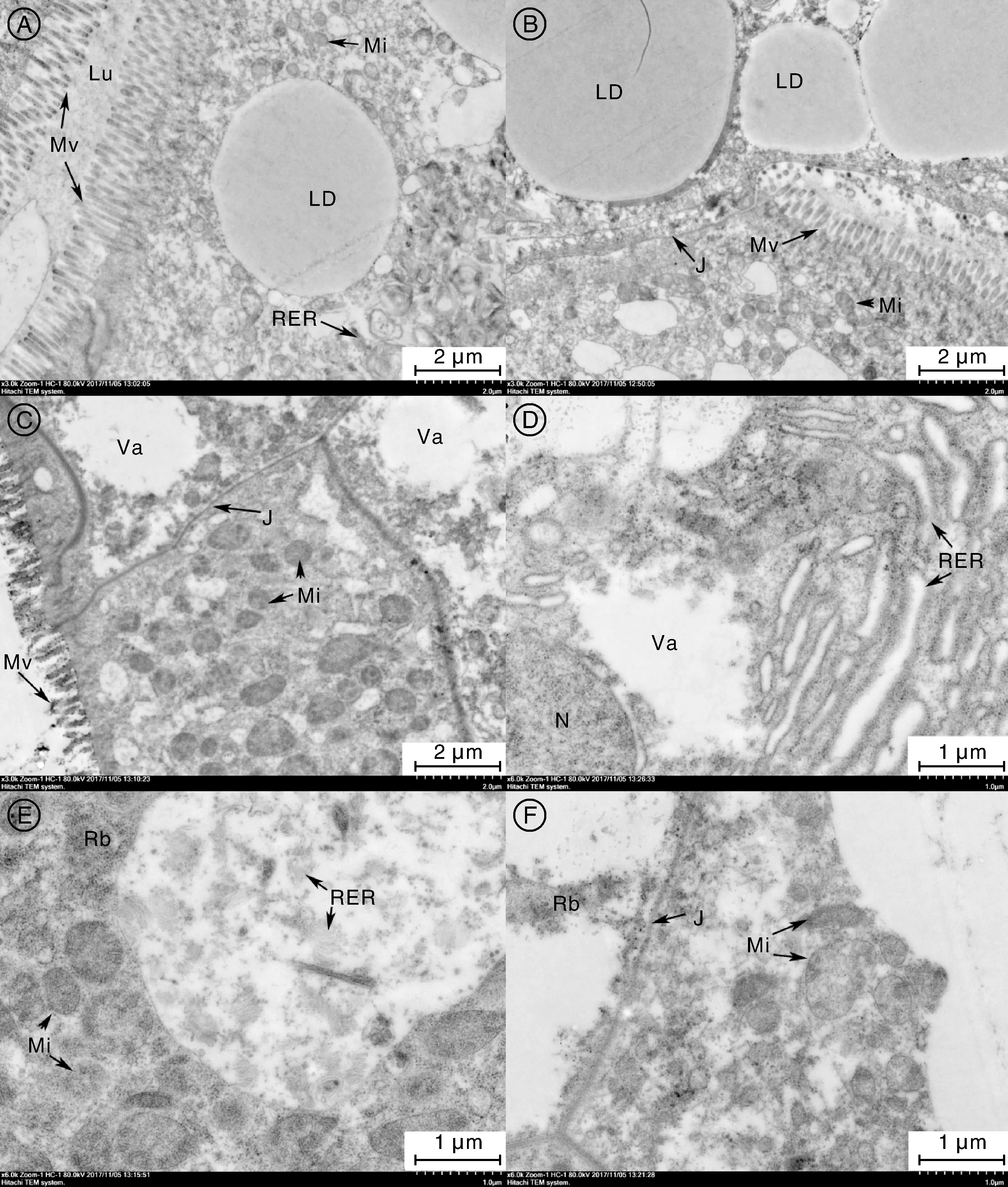
A,正常肝細胞,管腔(Lu)清晰,微絨毛(Mv)排列整齊,脂滴(LD)豐富,線粒體(Mi)和粗面內質網(RER)豐富;正常肝細胞,細胞聯結(J)清晰,→指示Lu為管腔,Mv為微絨毛,LD為脂滴,J為細胞聯結,Mi為線粒體,RER為粗面內質網;C,輕微病變肝細胞,細胞聯結清楚,微絨毛腫脹、斷裂,脂滴銳減,線粒體腫脹、內嵴減少或空泡化;D,嚴重病變肝細胞,內質網腫脹或斷裂為片層狀,部分細胞器破裂,只剩殘體,→指示Rb為殘余體;E,嚴重病變肝細胞,大部分細胞器腫脹破裂,僅剩殘體;F,壞死肝細胞,胞質完全降解,肝細胞出現空泡壞死。A, Normal hepatic cells, lumen (Lu) was clear, microvilli (Mv) arranged well, abundant lipid droplets (LD) , abundant mitochondria (Mi) and rough endoplasmic reticulum (RER); B, Normal hepatic cells, cell-cell junction (J) was clear, arrows point to lumen(Lu), microvilli (Mv), lipid droplets (LD), cell-cell junction (J), mitochondria (MI), rough endoplasmic reticulum (RER); C, Hepatic cells with mild histopathological changes, cell-cell junction was clear, swollen or fractured microvilli, decreased lipids droplets, mitochondria became swelling or vacuolar with the decreased crista; D, Hepatic cells with severe histopathological changes, swollen or fractured endoplasmic reticulum, some of the organelles were ruptured, some residual bodies appeared, the arrow points to residual bodies (Rb); E, Hepatic cells with severe histopathological changes, most of the organelles were swollen and ruptured and only the residual bodies was left; F, Necrotic hepatic cells, the cytoplasm was completely degrade and led to hepatic cells necrosis.圖1 病蟹和正常蟹肝胰腺超微結構Fig.1 Hepatopancreas ultrastructure of diseased and healthy crabs
中華絨螯蟹的附肢肌肉為橫紋肌,超微結構下,可見正常蟹肌纖維排列整齊,橫紋清晰,肌纖維間的肌質網豐富,線粒體多且基質濃密,由內膜折疊形成的嵴清晰可見(圖3-A、B)。病變蟹附肢肌肉肌纖維松散,部分肌纖維斷裂,肌質網部分解體,形成小泡;線粒體數量減少,且體積變小;部分肌細胞核呈高度異染色質化,細胞核明顯邊緣化(圖3-C、D)。
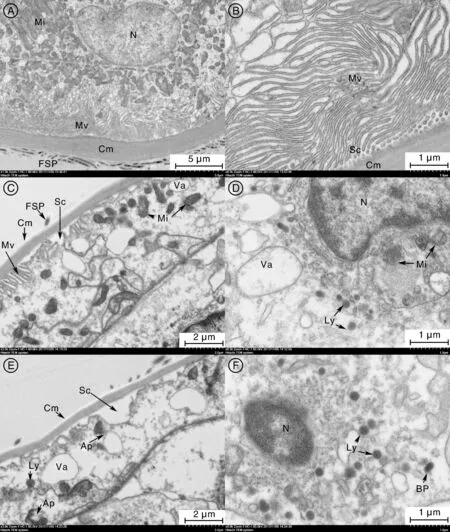
A,正常鰓,細胞核(N)形狀規則,核內染色質分布均勻,線粒體(Mi)豐富且形狀規則,角質層面伸出許多指狀突起(FSP);B,正常鰓,微絨毛(Mv)豐富且排列緊密,較少且排列規則的角質膜下空腔(Sc),→指示N為細胞核,Cm為角質膜,Mi為線粒體,FSP指狀突起,Mv為微絨毛,Sc為角質膜下空腔;C,輕微病變鰓上皮細胞,細胞核固縮,染色質呈異染色質化;角質膜變薄,指狀突起數量減少;微絨毛減少,排列疏松;角質膜下空腔變大,呈不規則狀;線粒體數量減少,基質稀薄,嵴減少,部分線粒體腫脹,甚至空泡化;D,嚴重病變鰓上皮細胞,細胞核高度異染質化,邊緣皺縮,核膜模糊;線粒體數量銳減,部分細胞器呈現空泡化,出現一定數量的溶酶體,→指示Ly為溶酶體,Va為空泡;E,壞死鰓上皮細胞,指狀突起大部分腫脹,甚至破裂消失;角質膜下空腔變大,微絨毛幾乎全部破裂消失;大量線粒體空泡化,溶酶體數量增多,溶酶體和空泡化的線粒體或者小泡結合形成自噬體,→指示AP為自噬體;F,壞死鰓上皮細胞,染色質散落,核膜模糊,部分斷裂,上皮細胞中出現細菌顆粒,→指示BP為細菌顆粒。A, Normal gill, the shape of nuclear was regular, the chromatin in the nucleus was evenly distributed, a large number of mitochondria was uniform in size, many finger shaped protuberance extended from the cutin membrane; B, Normal gill, abundant microvilli (Mi) arranged tightly, a small number of sub-cuticular space (Sc) arranged orderly, arrows point to nuclear (N), Cutin membrane (Cm), mitochondria(Mi), finger shaped protuberance (FSP), microvilli (Mv), sub-cuticular space (Sc); C, The gill epithelial cells with mild histopathological changes, nuclear was condensed, chromatin was partly heterochromatinized; the cutin membrane became thin, the number of finger shaped protuberance decreased; reduced microvilli arranged loosely; the sub-cuticular space became large and irregular; the number of mitochondria decreased, some mitochondria was swollen with reduced cristae and matrix or instead by vacuoles; D, The gill epithelial cells with severe histopathological changes, the nucleus was shriveled and the nuclear membrane was blurred, chromatin was highly heterochromatinized, there was a marked reduction in the number of mitochondria, some organelles were vacuolated, a certain number of lysosome appeared, arrows point to Va(vacuole), Ly(lysosome); E, Necrotic gill epithelial cells, most finger shaped protuberance were swollen or collapsed and disappeared, almost all of the microvilli was ruptured and disappeared, most mitochondria changed to vacuole, the number of lysosome increased and formed autophagosomes with vacuoles or vacuolar mitochondria, the arrow points to autophagosomes (AP); F, Necrotic gill epithelial cells, The chromatin was dispersed, the nuclear membrane was indistinct and partly ruptured, bacteria particles could be found in the necrotic gill epithelial cells, the arrow points to bacteria particles (BP).圖2 病蟹和正常蟹鰓組織超微結構Fig.2 Gill ultrastructure of diseased and healthy crabs

A,正常肌細胞,肌纖維排列整齊,肌質網豐富;B,正常肌細胞,線粒體多且內嵴排列緊密,MF示肌纖維、SR示肌質網、Mi示線粒體;C,病變肌細胞,肌纖維松散,部分肌纖維斷裂,肌質網部分解體,形成小泡;線粒體數量減少,且體積變小;D,病變肌細胞,部分肌細胞核呈高度異染色質化,細胞核明顯邊緣化,N表示細胞核。A, Normal muscle cells, the muscle fibers arranged well, the sarcoplasmic reticulum was well-developed; B, Normal muscle cells, there were a large number of mitochondria and the cristae arranged closely, MF was muscle fibers, SR was sarcoplasmic reticulum, Mi was mitochondria; C, The muscle cells with histopathological changes, the muscle fibers arranged loosely and partly ruptured, the sarcoplasmic reticulum partly disintegrated and formed small bubbles, the number and volume of mitochondria decreased; D, The muscle cells with histopathological changes, some nucleus of muscle cells were highly heterochromatinized, the nucleus was obviously marginalized, N was nucleus.圖3 病蟹和正常蟹附肢肌肉超微結構Fig.3 Appendage muscle ultrastructure of diseased and healthy crabs
3 討論
3.1 生理生化變化
甲殼動物中常可選用組織中的葡萄糖[8-9]、乳酸[9]以及血淋巴中的總脂、膽固醇、總蛋白、甘油三酯等指標含量的變化來評價機體的生理狀況[10]。機體在應對環境脅迫時,耗氧率升高,機體對能量需求量增加[11],研究表明蝦類在應對脅迫時主要是利用碳水化合物作為能源[12],當現存的碳水化合物不足以提供機體所需的能量時,機體則通過改變代謝途徑來滿足機體能量需求,主要是肌糖原或肝糖原分解為葡萄糖并運送至血淋巴[8,13]。如果由糖原分解的葡萄糖仍舊無法滿足機體需求,機體將出現“代謝妥協”[14],即機體將繼續動用自身的肌肉蛋白和儲存的脂肪來滿足不斷增加的能量需求,甘油三酯是中華絨螯蟹血清總脂中重要的組分,研究表明甘油三酯是蝦卵、攝食前幼體、成蝦的主要能源[15],本研究中病蟹肝糖原和血淋巴中甘油三酯含量下降,說明河蟹在環境脅迫下,所需能量增加,蟹體不僅要分解肝糖原功能,還需動用脂肪來滿足蟹體的能量需求。
磷酸酶在機體免疫,細胞自溶以及分化中起重要的作用[16]。堿性磷酸酶和酸性磷酸酶是動物體內重要的酶類,它們不僅可以分解正磷酸單酯為機體的磷代謝和核酸代謝提供磷酸基團[17],而且與營養物質的消化吸收有關[18],還有研究表明,這兩種酶是體內重要的解毒酶,在抗氧化脅迫方面具有重要作用,其活性高低可反映機體受危害的程度,一旦水環境受到污染堿性磷酸酶的活力就會受到影響,多種農藥對魚類和甲殼類堿性磷酸酶活性具有抑制效應[19-20]。甲殼動物相關研究中已把堿性磷酸酶看作是一種檢測甲殼動物免疫功能的指示酶[21-22],酸性磷酸酶常被用于檢測生物體某些器官的病變情況[23]。本研究中病蟹肝胰腺中堿性磷酸酶和酸性磷酸酶活性均降低說明機體受到了危害,同時也說明肝胰腺組織受到了損傷[23]。
谷丙轉氨酶主要存在于肝中,谷草轉氨酶主要存在于肝和心臟等組織細胞中,這兩種酶是動物細胞線粒體中重要的氨基轉移酶,在機體蛋白質代謝中起重要作用[24]。當組織損傷或中毒發生時,會引起起細胞通透性增加,導致細胞內兩種酶大量外泄[25]。本研究中病蟹血淋巴中兩種酶含量升高,說明河蟹肝胰腺受到了損傷[26]。而血清中堿性磷酸酶主要來自于肝和骨骼,是肝疾病損傷的輔助指標之一,其呈上升趨勢,進一步說明了病蟹肝胰腺組織損傷,功能受損[27]。
3.2 超微病理變化
肝胰腺是甲殼動物重要的免疫消化器官[28],肝胰腺中R細胞的主要功能是吸收和儲存脂肪、糖原等營養物質以及進行胞內消化[29-31],細胞內具有豐富的線粒體,線粒體是合成ATP的重要場所,其雙層膜和線粒體內嵴在能量合成和電子傳遞中起重要作用[32]。線粒體還是對各種損傷最為敏感的細胞器之一,其內膜皺褶形成的內嵴負責很多的生化反應,病蟹線粒體腫脹,甚至空泡化,內嵴被破壞,致使蛋白質合成受阻,必然抑制細胞內的能量代謝活動。F細胞具有大量的粗面內質網和核糖體,主要功能是合成和分泌消化酶[33-34]。粗面內質網是細胞內一個精細的膜系統,粗面內質網的主要功能是合成分泌性的蛋白質及多種膜蛋白、酶蛋白。病變肝胰腺F細胞中內質網腫脹,斷裂成大小不等的片段,受損嚴重。粗面內質網受損勢必會影響酶和其他蛋白質的合成及貯存,導致各項生理活動無法正常進行,機體免疫防御功能也會受到影響,免疫力下降。中華絨螯肝胰腺F和R細胞頂端的微絨毛及微絨毛表面的黏膜對物質轉運具有重要的作用,隨著新的營養物質進入到肝胰腺,微絨毛表面舊的黏膜脫落,新的黏膜形成,如此反復,豐富而排列整齊的微絨毛說明肝胰腺具有正常的生理功能[35],病蟹微絨毛腫脹、斷裂甚至消失,說明肝胰腺的生理功能已經受損。病蟹肝胰腺這些超微病理變化和紅螯光殼螯蝦受到亞硝酸脅迫[36],河蟹受到鋅離子脅迫[37]、鎘脅迫[38],日本蟳受到硫化物脅迫[39]表現出的病理特征相似。
正常中華絨螯蟹每條鰓都由具有支撐和運輸功能的鰓軸及向兩側發出的相互平行的鰓葉構成,正常鰓葉由外向內分別是角質膜、上皮細胞層和鰓腔。河蟹的鰓具有調節滲透壓、呼吸以及排泄等功能,因其與水環境直接接觸,是阻擋病原的第一道防線,易受到環境影響和病害損傷。上皮細胞是鰓的主要組成成分,上皮細胞頂端形成豐富的微絨毛,以增大上皮細胞的表面積,同時鰓上皮細胞中豐富的線粒體有利于河蟹的呼吸[40]。中華絨螯蟹鰓上皮細胞是特化了的上皮細胞,屬于離子轉運型上皮,質膜內褶上具有豐富的Na+、K+-ATP酶,與離子轉運有關,能夠調節河蟹的滲透壓和血液離子濃度[41-42]。角質膜是河蟹鰓組織中阻止病原侵襲的屏障[40]。病變河蟹鰓角質膜變薄使得河蟹對各種病原感染及環境脅迫因子敏感,微絨毛數量減少、破裂使鰓上皮細胞的表面積變小,影響河蟹的呼吸功能;線粒體等細胞器的腫脹、嵴減少或消失、空泡化可能是因為膜對鉀、氯離子的滲透性增加的結果;溶酶體數量增加,并和空泡化的小泡和線粒體結合形成自噬體,參與自噬作用,最終使鰓組織結構受到不可逆轉的損傷。這一結果也和呂曉燕等[36]對亞硝酸鹽脅迫下紅螯光殼螯蝦(Cheraxquadricarinatus),Xu等[39]對硫化鈉脅迫下日本蟳(Charybdisjaponica),盧敬讓等[43]對鎘脅迫下中華絨螯蟹,Yang等[44]對銅離子脅迫下中華絨螯蟹鰓結構觀察相似。
病蟹的附肢肌肉和肝胰腺及鰓相比,病變較輕,僅表現為肌肉萎縮,肌纖維松弛,肌質網水腫,線粒體萎縮,細胞核固縮且邊緣化,這一病理變化和營養因素導致的中華絨螯蟹肝胰腺白化癥,病理變化相似[45]。
3.3 發病原因及致病機理
本研究在進行河蟹病變組織超微結構觀察時,未見包涵體等病毒性顆粒,僅在發病嚴重的河蟹鰓組織中發現少量的細菌顆粒,而關于可能病原細菌的分離回感,作者已進行了分離回感試驗[7],經鑒定分別屬于弧菌屬、希瓦氏菌屬和不動桿菌屬,回感健康河蟹未出現“水癟子”病樣癥狀,將發病早期的河蟹進行抗生素治療也未見有任何效果,且病蟹一般不容易出現死亡,將病蟹剪碎直接飼喂健康蟹以及將病蟹和健康蟹混養,健康蟹均未出現“水癟子”病,由此可見河蟹“水癟子”病和病原關系不大。根據超微病理變化,可見肝胰腺中脂滴數量減少,肝細胞空泡化,甚至最后出現壞死;鰓上皮細胞受損與河蟹及其他甲殼動物受到重金屬及各種不適理化因子脅迫時表現出的病理結構相似。
有研究表明,甲殼動物在環境脅迫條件下,會降低自身活動水平,將自身儲存的營養物質主要用于維持機體的基本生理代謝[46]。在脅迫狀態下,機體分解代謝加強,合成代謝減弱,導致有些營養物質耗竭,此外,環境脅迫還可以擾亂機體的正常生理狀態,從而導致其食欲下降[47-49],“水癟子”病蟹吃食量減少或停止攝食,與這一病理特征相似,隨著脅迫時間的延長,河蟹的主要免疫消化器官肝胰腺結構受損,尤其是合成和分泌消化酶的F細胞受損,進一步影響河蟹的攝食。病蟹肝胰腺超微結構觀察可見病蟹肝胰腺R細胞中脂滴減少,研究表明,甲殼動物肝胰腺細胞的超微結構與其影響狀態存在密切的關系[50-52],當脂質營養缺乏時,中華絨螯蟹肝胰腺R細胞中脂滴減少[53],“水癟子”病蟹在攝食量減少的同時,脂質營養也相應缺乏,從而出現了肝胰腺中脂滴減少的癥狀。環境脅迫會提高機體的耗氧率,機體所需能量增加,河蟹面對不斷增加的能量需求,肝臟和骨骼肌最先響應[54], 河蟹的肌肉組織主要分布在步足、螯和胸部,是典型的骨骼肌,肝胰腺中肝糖原降解以提供葡萄糖供能,肌肉蛋白異化供能,為此河蟹的附肢肌肉發生萎縮,再加上病蟹攝食減少或停止,使蟹體消瘦,最終萎縮的附肢肌肉影響河蟹的活動能力,病蟹表現為活力下降。在脅迫后期,河蟹肝胰腺、鰓等組織病變壞死,組織內的血淋巴液外滲,同時大分子物質崩解入血,使蟹體滲透壓升高,外界的水分進入蟹體,病蟹甲殼內出現大量積液[55],同時積液滲透附肢導致附肢積水。肝胰腺是中華絨螯蟹重要的消化免疫器官[28],肝胰腺的病變影響了河蟹對營養物質的消化吸收,使蛻殼后的蟹無法獲得充足的營養物質,從而導致甲殼軟化。

