脊柱內鏡與椎間融合治療腰椎間盤突出癥伴終板骨軟骨炎的療效對比
鄧亦奇,孫付杰,汪明星,時廣力,鄒士東
(單縣中心醫院骨科,山東 菏澤 274300)
腰椎間盤突出癥伴終板骨軟骨炎大多起病隱匿,呈漸進性發展[1],且兩種疾病均能產生下腰痛癥狀,所以當腰椎間盤突出合并有Modic改變的終板炎時,腰痛的來源不明確,易被臨床醫師忽略[2]。研究表明Modic Ⅰ、Ⅱ型與下腰痛關系最密切,其中Ⅰ型向Ⅱ型轉化后下腰痛癥狀改善,其他Modic類型向Ⅰ型轉化后下腰痛癥狀加重,因而贊同對Modic Ⅰ、Ⅱ型的治療[3],但具體治療方式也有爭議[4]。
本研究回顧性分析采用經椎間孔或椎板間入路的經皮椎間孔鏡椎間盤切除術治療及椎間植骨融合內固定修復手術治療患者的資料,分析治療后癥狀緩解、功能改善情況,對腰椎間盤突出癥伴終板骨軟骨炎的內鏡治療效果進行評價。
1 資料與方法
1.1 一般資料 本組共116例,其中男66例,女50例;年齡為33~69歲,平均年齡42.7歲。根據治療方式不同分為兩組:采用脊柱內鏡微創手術治療55例,男35例,女20例;年齡為33~69歲,平均年齡41.2歲;累及L3~4節段3例,L4~5節段27例,L5S1節段25例。采取椎間融合修復開放手術61例,男31例,女30例;年齡為35~66歲,平均年齡43.1歲;累及L3~4節段5例,L4~5節段29例,L5S1節段27例。
1.2 納入及排除標準 納入標準:2015年3月至2017年2月在我院行腰椎間盤突出癥伴終板骨軟骨炎手術治療的患者;反復下腰痛超過6個月,或伴下肢麻木、放射痛及間歇性跛行,直腿抬高或股神經牽拉試驗陽性;腰椎MRI顯示椎間盤突出伴沿終板以及臨近的椎體內斑片狀或者帶狀的信號異常。排除標準:a)觀察療效困難者,如孕婦、年老體弱或合并嚴重的內科疾病;b)多節段或手術后復發腰椎間盤突出,伴有嚴重骨性椎管狹窄、脊柱側凸、腰椎不穩、腰椎骨折等;c)合并腰椎間盤感染性病變及脊柱結核、腫瘤等病變。
1.3 方法
1.3.1 脊柱內鏡組 患者采用經皮椎間孔鏡椎間盤切除術(Percutaneous transforaminal endoscopic discectomy,PTED)。手術局部麻醉,根據患者自身狀況采取俯臥或側臥位。經C型臂透視確定皮膚進針點,并在體表標記。采用德國Spinedos脊柱內窺孔鏡系統,逐層局麻,穿刺導針透視下針尖達到病變節段下位椎體上關節突前尖部,于關節突周圍注射局麻藥物,置入擴張管道逐級擴張,環鋸擴大椎間孔成形,安置工作通道置入內窺鏡系統。生理鹽水持續灌洗,經內鏡中央器械通道插入各種角度的抓鉗,切除部分纖維環及黃韌帶后探查神經根,摘除突出椎間盤,使神經根充分松解,雙極射頻消融椎間隙內松動的破碎髓核,充分灼燒伴有Modic改變的終板,同時避免使用抓鉗過多處理終板(見圖1~2)。術后輕緩退鏡拔出工作通道,縫合切口,檢查下肢活動。術后4~6 h后佩戴腰圍離床活動,根據腰部及下肢疼痛情況口服消炎鎮痛類藥物。

圖1 術中應用射頻消融電極充分灼燒病變間隙上下終板 圖2 術中關節鏡下可見突出間盤組織已去除,神經根松弛,減壓充分
1.3.2 椎間融合組 患者采用腰椎后路椎體間融合術(posterior lumbar interbody fusion,PLIF)。全身麻醉,俯臥位,取腰部后正中切口,長6~8 cm,逐層切開皮膚、皮下組織、筋膜,分離椎旁肌,顯露病變節段上下兩側關節突,透視下確定椎弓根螺釘進針點,擰入椎弓根螺釘。部分咬除椎板,切除黃韌帶,顯露神經根及硬脊膜,行側隱窩減壓,探查神經根及椎間孔,切開纖維環,取出髓核及病變的椎間盤組織。然后行椎間植骨及置入椎間融合器,放置釘棒及加壓,沖洗切口,放置引流管,縫合切口。術后24~48 h后根據引流量拔除引流管,佩戴腰圍離床活動,如有神經根激惹現象者予以小劑量激素、脫水藥物治療。
1.4 觀察指標及隨訪評估 a)詳細觀察記錄兩組患者術中及術后情況,包括:手術時間、手術切口長度、手術出血量及住院時間。b)術后1 d、術后6個月、術后12個月及之后每年隨訪1次。下腰痛疼痛程度采用視覺模擬評分(visual analogue scale,VAS)評價,手術前后癥狀改善及功能評估采用Oswestry功能障礙指數(Oswestry disability index,ODI)評價。根據改良MacNab療效評定標準評估療效,a)優:癥狀完全消失,恢復原來工作和生活;b)良:輕微癥狀,能從事較輕工作;c)可:癥狀減輕但仍有疼痛,不能工作;d)差:手術前后無明顯差別,甚至加重。
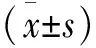
2 結 果
兩組患者手術隨訪時間12~24個月,平均17.8個月。脊柱內鏡組患者手術時間為(48.7±l1.6)min,手術切口長度為(0.8±0.1)cm,手術出血量為(13.2±6.7)mL,住院時間為(4.1±1.3)d;椎間融合組患者手術時間為(87.5±16.9)min,手術切口長度為(7.3±1.7)cm,手術出血量為(78.2±20.6)mL,住院時間為(7.5±3.6)d。脊柱內鏡組均優于椎間融合組,差異有統計學意義(P<0.05)。
脊柱內鏡組術后下腰痛疼痛VAS評分由術前的(8.1±1.2)分下降至(3.6±1.0)分,末次隨訪時降至(2.3±0.5)分,與治療前比較差異有統計學意義(P<0.05)。椎間融合組患者下腰痛疼痛VAS評分由術前的(8.2±1.4)分下降為術后(3.9±1.2)分,末次隨訪時降至(2.5±0.8)分,與術前比較差異有統計學意義(P<0.05)。脊柱內鏡組患者術后ODI評分較術前顯著下降,差異有統計學意義(P<0.05)。椎間融合組患者術后ODI評分同樣下降,術后6個月、末次隨訪時同術前比較差異均有統計學意義(P<0.05)。兩組患者治療前VAS、ODI評分比較差異均無統計學意義(P>0.05),術后及各次隨訪兩組間VAS、ODI評分比較差異無統計學意義(P>0.05),見表1。末次隨訪脊柱內鏡組優良率92.7%(51/55),椎間融合組優良率88.5%(54/61),兩組優良率比較差異無統計學意義(P>0.05),見表2。

表1 兩組治療前后及隨訪VAS、ODI比較

表2 末次隨訪MacNab療效評定比較
典型病例一為35歲男性患者,因腰痛5年伴右下肢疼痛2 d入院。入院時患者右下肢放射痛至小腿前外側,足背區麻木,右側直腿抬高及加強試驗(+),巴氏征(-),術前MRI示L4~5椎間盤巨大突出,L5S1椎間隙退變并輕度突出,伴終板T2加權像高信號,呈Modic改變。入院后行經皮完全內鏡經椎間孔入路椎間盤切除術,術后即感腰痛及下肢痛緩解。第3天出院,末次隨訪腰痛VAS、ODI較術前明顯下降,腰椎MRI與術前比較突出物消失,終板T2加權像高信號較前好轉,未行相關治療L5S1間隙終板較術前出現明顯高信號,呈Modic改變。手術前后影像學資料見圖3~4。典型病例二為40歲中年男性,因腰痛伴右下肢疼痛3年入院。查體右下肢放射痛至足跟,足底麻木,直腿抬高及加強試驗(+),巴氏征(-)。術前MRI示L5S1椎間隙退變并間盤突出,伴終板高信號,呈Modic改變。入院后行經后路腰椎植骨融合內固定術,術后腰痛及下肢痛緩解,末次隨訪腰痛VAS、ODI較術前明顯下降,X線片示椎間已融合,手術前后影像學資料見圖5~6。

圖3 術前MRI示L4~5椎間盤巨大突出,L5S1椎間隙退變并輕度突出 圖4 末次隨訪MRI示終板信號較前好轉,L5S1間隙終板(紅圈標注)呈Modic改變

圖5 術前MRI示L5S1椎間隙退變并間盤突出

圖6 椎間融合術后復查X線片提示植骨已融合
3 討 論
腰椎間盤突出癥伴終板骨軟骨炎是一種特殊病理類型的腰椎間盤突出癥[5],椎體終板是椎間盤的重要組成部分,具有承接緩沖負荷、保護椎體、防止髓核突入和控制椎間盤營養滲透的作用,其退變的病理過程復雜且與椎間盤退變關系緊密[6]。軟骨終板異常使椎間盤營養障礙、退變加速、硬度增加,纖維環應力異常容易在后外側形成裂隙,導致椎間盤突出,從而形成椎間盤退變和軟骨終板炎惡性循環[7]。隨著年齡變化軟骨終板會逐漸退變,其滲透性不斷降低,髓核水分不斷減少導致最終變性。當髓核空腔及裂隙變大后纖維環受累及,軟骨終板變薄,因裂隙原因可使血管進入到髓核,腰椎間盤內物質可進入受損終板一側椎骨。當腰椎承受的壓力負荷過高,會導致軟骨終板的損傷甚至骨折,在MRI上則表現為Modic改變,其中Modic改變的發生率為19%~59%,以Ⅰ型和Ⅱ型多見[8]。軟骨終板異常使椎間盤退變加速、硬度增加、營養障礙,纖維環應力異常使后外側形成裂隙引起椎間盤突出。
下腰痛癥狀為主的腰椎終板骨軟骨炎以保守治療較多,有研究認為抗生素在治療伴有Modic改變的慢性終板骨軟骨炎患者有較好療效[5],但合并Modic改變的腰椎間盤突出癥患者,腰痛的來源不明確,治療方式出現爭議。Shan等[9]對85例合并終板骨軟骨炎的腰突癥患者的治療方案進行隨機對照研究,表明保守治療患者隨訪MRI示突出的髓核吸收緩慢,治療效果不好。終板骨軟骨炎所引起的Modic退變其臨床轉歸以及對手術療效的影響已被證實[10],腰椎融合術加速了終板退變向機械性穩定轉變,這些改變是脊柱融合術良好預后的指標。Yang等[11]認為椎間融合術對伴有Modic退變的腰椎退行性疾患尤為重要,不僅可以提高骨融合率,還能維持脊柱穩定性。本研究結果顯示,無論采用脊柱內鏡或脊柱植骨融合術治療伴有終板退變的單節段腰椎間盤突出癥患者,術后隨訪VAS、ODI評分均優于術前,說明腰椎終板骨軟骨炎雖不能單獨作為手術的適應證,但對于伴有Modic改變的腰椎間盤突出癥而言,手術治療是有必要的。值得進一步關注的是,融合術侵襲性大,術后恢復時間延長,可能造成應力集中、臨近節段退變、腰背肌損傷等其他功能障礙,內鏡操作技術及器械的不斷改進為這種疾病的治療提供了新的途徑。
PTED技術治療腰椎間盤突出癥較傳統開放手術有諸多優勢,已被普遍認為是行之有效的技術方法[12],通過內鏡可以在高清視野下完成椎間盤摘除、椎板減壓、纖維環成形等細微操作。Wang等[13]研究發現,老化細胞的堆積在退變的椎間盤中與增殖能力下降、自我修復機制受損、炎性反應增加、細胞分解代謝增強等因素相關。王明月等[14]報道椎間盤退變或受到重復性損傷時,可上調炎癥因子如白細胞介素-6、前列腺素E2等的毒性遞質水平,通過終板與椎間盤的微孔結構進入軟骨終板引起局部的炎癥反應,從而引起腰痛癥狀。本研究兩組對比發現,脊柱內鏡微創髓核摘除同椎間融合治療效果相差無幾,考慮雖未像椎間融合術中去除炎性反應的退變終板,但脊柱內鏡在手術過程中通過射頻消融等操作,破壞了終板與椎間盤的微孔結構,去除了間盤內堆積的老化細胞,造成了相關鏈狀炎性反應傳遞受到阻礙,毒性遞質得到控制,對終板區域多采取雙極進行射頻灼燒,既可去除殘余間盤組織,同時可減少硬性器械如髓核鉗、抓鉗過多破壞終板,使內鏡微創治療獲得較好的術后隨訪。椎間融合是在切除椎間盤組織的基礎上,通過植骨將椎間關節融合,提供堅強固定,但其改變了手術節段的運動能力及生理狀態,增加臨近節段的退變和應力,并給接受手術患者帶來較大心理創傷,嚴重者需再次行手術治療。因此脊柱內鏡治療腰椎間盤突出癥伴終板骨軟骨炎存在傳統手術方式無法比擬的優點,提高了手術的精確性和安全性,避免了椎間融合術對機體較大的手術打擊,同時也減輕了患者的醫療負擔。
本研究認為微創脊柱內鏡手術治療也存在不足之處,一方面此術式手術適應證狹窄,未對巨大和嚴重骨性椎管狹窄、估計鏡下操作困難者進行相關性研究;另一方面無法對全部范圍的Modic改變進行破壞,術后仍可能會殘余椎間盤性的腰痛。同時研究樣本量有限,結果仍需大樣本、多中心的隨訪研究進一步證實。
綜上所述,本研究證實脊柱內鏡微創手術在治療腰椎間盤突出癥伴終板骨軟骨炎上同傳統脊柱椎間融合修復手術有相似效果,通過行突出椎間盤摘除、神經減壓、破壞終板微孔結構可獲得良好的療效,減輕了患者的疼痛并改善腰椎功能,提高了手術的精確性和安全性,同時避免了傳統手術對機體較大的手術打擊,也減輕了患者的醫療負擔。

