第26屆國際生物學奧林匹克競賽試題實驗4·生物化學
佟向軍 范六民 劉寶玉 王戎疆 張 立
(1 北京大學生命科學學院 北京 100871 2 天津市第一中學 天津 300051 3 北京師范大學生命科學學院 北京 100875)
總分:100 分
考試時間:90 min
共20 題
考試目的:在本次考試中,將分析酶的動力學和酶的抑制劑。
考試包括2 個主要部分,每個部分包含3 個子部分。
第1 部分(57.5 分)
1.1 酶動力學介紹(理論)(0 分)
1.2 使用合成底物類似物pNP-Gal 的工業α-半乳糖苷酶的酶動力學實驗(實驗操作)(問題1~2:40 分)
1.3 α-半乳糖苷酶的酶動力學數據分析(問題4~11:17.5 分)
第2 部分(42.5 分)
2.1 酶抑制劑介紹(理論)(問題11~13:2 分)
2.2 α-半乳糖苷酶的抑制實驗(實驗操作)(問題14:27 分)
2.3 α-半乳糖苷酶的抑制動力學數據分析(問題15~20:13.5 分)
在考試開始之前,建議首先瀏覽整個試卷以了解大致內容。由于大多數分數設置在實驗部分,所以建議在開始計算和回答理論問題之前(第1.3、2.1 和2.3 部分)首先完成1.2 和2.2 部分。
材料與設備
為了完成實驗工作,需要下面列出的材料。請確保可以獲取這些材料。如果發現材料缺失,請在考試開始15 min 之內舉手示意考務人員。
A.1 個p200 移液器。使用移液器p200 轉移體積為20~200 μL 的液體,除非另有說明。
B.1 個p1000 移液器。使用移液器p1000 轉移體積為200~1 000 μL,除非另有說明。
C.p200 移液器的96 孔吸頭盒。 除非另有說明,否則每次移液后應丟棄移液器吸頭。
D.p1000 移液器的96 孔吸頭盒。 除非另有說明,否則每次吸液后應丟棄移液管吸頭。
E.>30 個微量離心管(1.5 mL)
F.1 個微量離心管支架
G.2 個標有國家代碼+A 或B 的微量滴定盤
H.1 個微量滴定板模板
I.1 只秒表
J.1 支鉛筆
K.1 支記號筆
L.1 個計算器
M.1 把直尺
N.1 張用于示意考務人員的粉紅卡片
O.9 mL 2 mol/L Na2CO3(終止液)
P.6.5 mL 15 mmol/L pNP-Gal(底物)
Q.15 mL 超純水
R.5 mL 1 mmol/L pNP(標準溶液)
S.2 mL 0.024 mg/mL(酶)
T.5 mL 0.5 mol/L(抑制劑)
U.平板電腦觸控筆
第1 部分
1.1 酶動力學簡介
α-半乳糖苷酶可以催化α-半乳糖苷中末端半乳糖殘基的水解。通常,使用合成底物類似物對硝基苯基-α-半乳糖苷(pNP-Gal)測定α-半乳糖苷酶的活性,α-半乳糖苷被水解成半乳糖(Gal)和對硝基苯基(pNP)(圖1)。
pNP-Gal 是無色的,而pNP 產物為黃色并且其濃度可以通過微量滴定板讀數器確定405 nm處的吸光度。
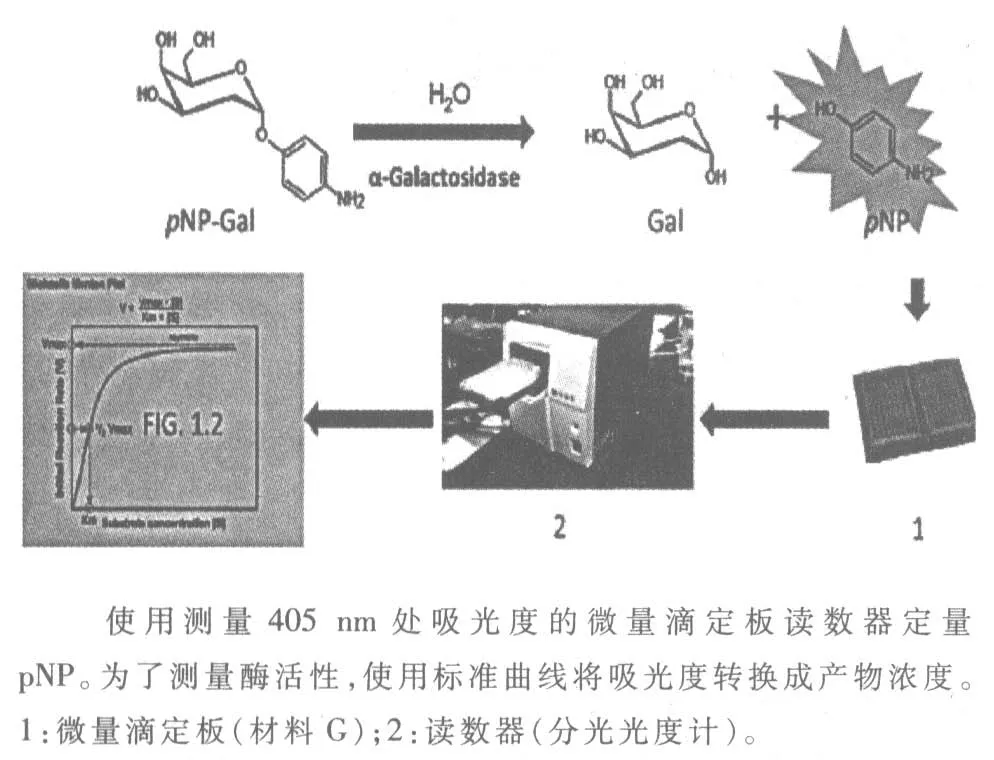
圖1 半乳糖苷酶活性測定示意圖
在第1 部分中,將對水解速率對底物濃度的依賴性進行研究。為了達到這一目的,描述這種關系的Michaelis-Menten 圖(圖2)可用于估計2 個重要參數Vmax和Km(參見圖2 的圖例)。 初始反應速率Vo 可以由Δ[P]/Δt 確定,該值是單位時間內(Δt)的產物濃度([P])的變化。

圖2 Michaelis-Menten 圖
Lineweaver-Burk 圖中的參數Vmax 和Km 可以分別從Y 軸和X 軸截距確定(圖3)。 通過繪制初始反應速率(1/Vo)與底物濃度(1/[S])的倒數的方法可以產生Lineweaver-Burk 圖。

圖3 Lineweaver-Burk 圖
1.2 工業α-半乳糖苷酶的酶動力學實驗
1.2.1 標準曲線 首先產生用于測量酶反應產物濃度(pNP)的標準曲線。 要產生標準曲線,你需要用終止液(Stop)稀釋1 mmol/L pNP 標準儲備溶液(Standard)。
問題1.標準曲線稀釋方案。
當需要使用時,要用終止液(Stop)稀釋1 mmol/L pNP標準儲備溶液(Standard)。 計算在500 μL 總體積中制備最終標準濃度所需的pNP 和終止液的體積。 在表1 中填入你的計算值。
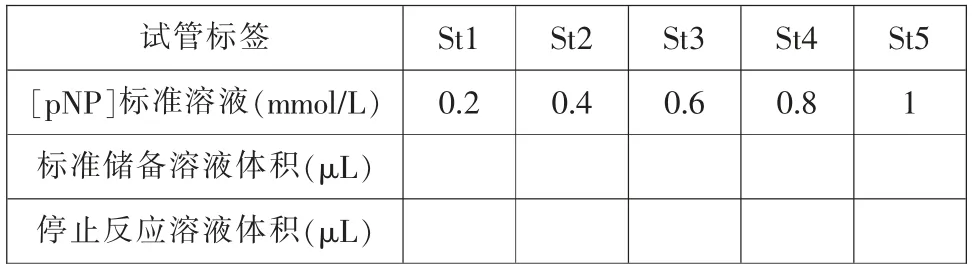
表1 稀釋方案制備標準曲線
繪制標準曲線的步驟:
A.用記號筆標記上表第1 行中5 個1.5 mL 微量離心管(St1~St5)。
B. 將不同體積的1 mmol/L pNP 標準儲備溶液(Standard)轉移到標記的1.5 mL 管中(使用相同的吸頭)。
C.根據上表中的計算,將不同體積的終止液(Stop) 轉移到標記的管中。 將微量離心管倒置5次,使其與標準溶液徹底混合。
D.將100 μL 超純水(Water)轉移到微量滴定板A 的A1~A5 和B1~B5 孔中(使用相同的吸頭,參見圖4 和/或使用微量滴定板模板幫助你移液到正確的孔中) 。
E.轉移50 μL 上述最終溶液到相同的微量滴定板孔中。 每種溶液被分別轉移到2 個不同的孔中(下標I 和II,圖4)。
F.使用p1000 移液器向每個pNP 標準A1~A5和B1~B5 孔中添加100 μL 終止液(Stop)。通過將混合物上下顛倒2 次徹底混合。

圖4 微量滴定板A
現在繼續進行第1.2.2 部分,將酶反應混合物置于你的微量滴定板上。
重要提示:考務人員在考試的最后10 min 內將不再接收任何微量滴定板。 如果你感覺無法及時完成1.2.2 的部分,請通過舉起粉紅卡片告知考務人員。 你的操作結果將顯示在問題2 中。
1.2.2 酶動力學實驗
步驟:
準備pNP-Gal 底物稀釋溶液進行動力學實驗。
A.標記5 個1.5 mL 管,標記為S1 至S5(表2)。B.將15 mmol/L pNP-Gal 底物儲備溶液(Substrate)用標準1.5 mL 管中的超純水(Water)進行稀釋(表2)。 稀釋溶液應通過將管顛倒倒置5 次徹底混合。

表2 酶動力學測定的底物稀釋方案
C.將50 μL 每種稀釋的底物溶液(表2)和50 μL 超純水(Water)轉移到微量滴定板A G1~G5 和H1~H5。(參見圖4 和/或微量滴定板模板)。
D.將定時器設置為5 min,并在將酶溶液移至第1 孔后立即開始計時,以開始第1 次酶促反應(SI1),如下所述。
E.移取50 μL 0.024 mg/mLα-半乳糖苷酶(Enzyme),從SI1 和SII1 開始加入G1~G5 和H1~H5 孔,并繼續以相同的順序和間隔持續到SII5 以開始每個孔中的酶反應(以下稱為“酶反應混合物”)。為確保良好的混合,快速但輕柔地將50 μL 的混合物在每個孔中進行上、下2 次移液。
F.孵育5 min 后,使用p1000 移液管加入100 μL 2 mol/L Na2CO3溶液 (Stop),以與你開始的步驟相同的順序和速度終止孔G1~G5 和H1~H5 中的每個酶反應。通過將混合物上、下移動2 次混勻。
問題2.酶動力學實驗。
舉起粉紅色卡片上交你的的微量滴定板。 測量后,所得值將自動顯示在表3 中。
注意:在考試的最后10 min 內不會接受微量滴定板。
表3
1.3 酶動力學的數據分析
現在,你的任務是通過α-半乳糖苷酶測定底物水解的動力學參數。
首先,使用表4 中的數據確定產物(pNP)的標準曲線線性函數。 使用標準曲線可以計算反應混合物中的產物濃度,進一步可以通過確定初始反應速率(V0)計算每個底物濃度。
表4 用于模擬微量滴定板A 的標準數據,這樣可以避免1.2 部分的錯誤。 在實際情況下,使用你自己的數據進行計算。
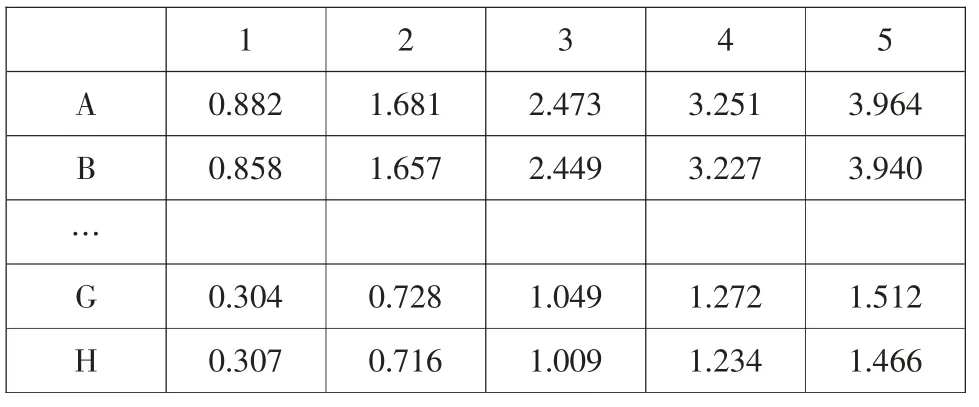
表4 用于計算的吸光度數據(微量滴定板的第1~5 列)
問題3.標準平均吸光度。
計算表5 中給出的標準曲線的每個重復測量的平均吸光度。 輸入小數點后3 位數。
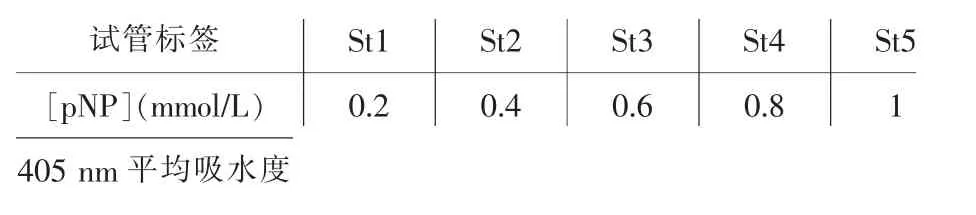
表5 標準曲線的平均吸光度
問題4.標準曲線線性函數。
在圖5 中,將pNP 的濃度(mmol/L)對應于吸光度(問題3 中計算出的平均A405nm)作圖。
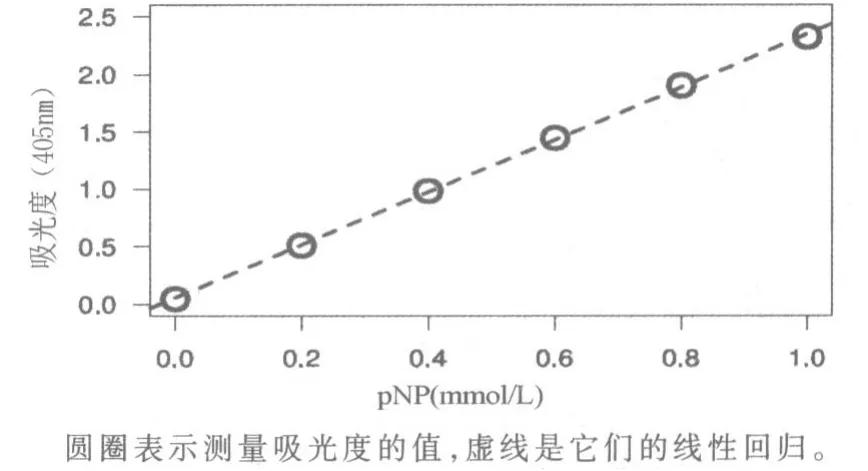
圖5 估測pNP 產品標準曲線
在數學上僅使用2 個數據點St1 和St5 的平均吸光度確定標準曲線線性函數(見下文)的a 和b。 為a 和b 給出小數點的后3 位。
A405(405 nm 處的吸光度單位)=a·[pNP](mmol/L)+b,其中a 是斜率,b 是Y 軸截距。
來自實驗部分1.2.2 的酶反應混合物的體積為150 μL。
問題5.反應時間。
將步驟中給出的反應時間單位設置為s。
問題6.動力學數據分析(無抑制劑)。
使用以下標準曲線方程式計算每種反應混合物的產物濃度:
A405吸光度=2.29×[pNP](mmol/L)+0.058。
初始反應速率V0可以從Δ[Product]/Δ 時間確定,即單位時間內產品濃度的變化。所有數字保留到小數點后3 位。
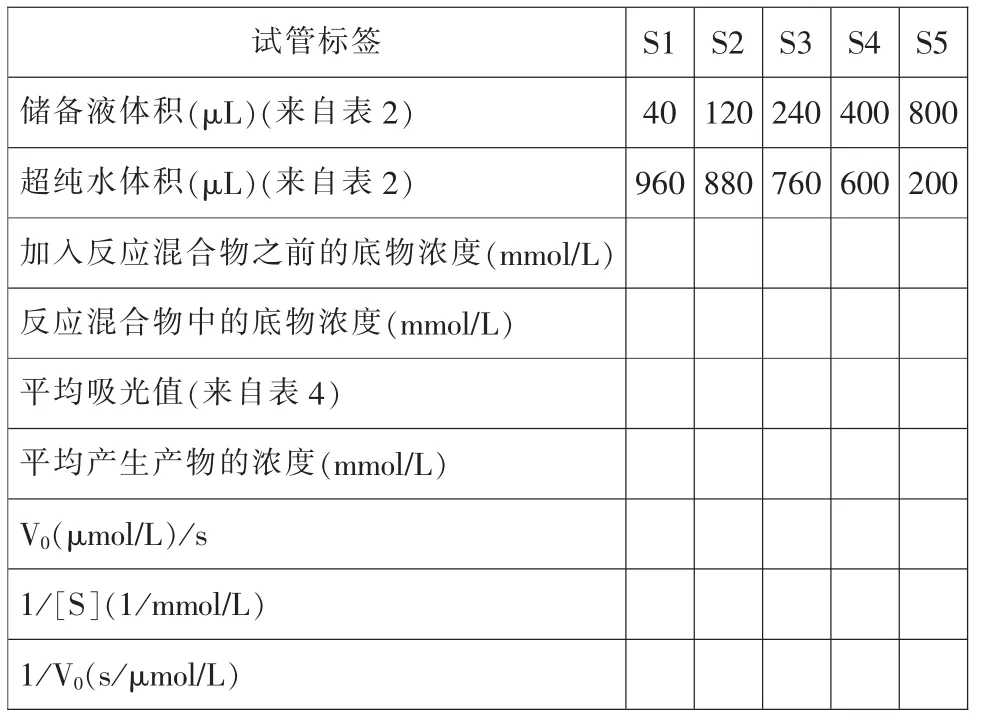
表6 分析數據
問題7.Michaelis-Menten 參數(圖形估計)。

圖6 Michaelis-Menten 圖
從Michaelis-Menten 圖以圖形方式估算Vmax和Km(圖6)。在小數點后給出1 位有效數字的答案。
問題8.Lineweaver-Burk 線性函數。
圖7 是表3 中S1~S5 數據點的Lineweaver-Burk 圖(1/V0對1/[S])。
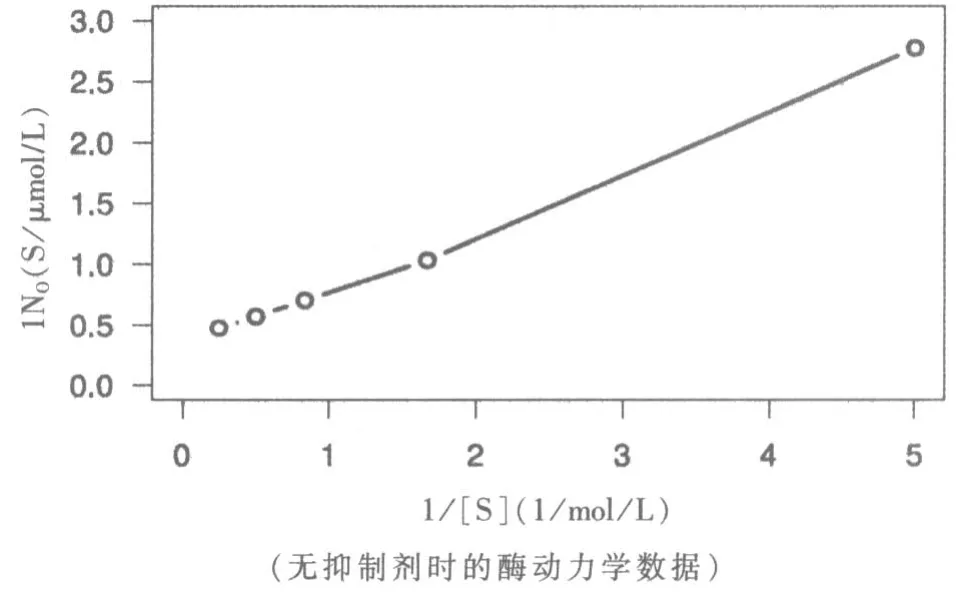
圖7 Lineweaver-Burk 圖
確定Lineweaver-Burk 圖中線性函數(圖7),給出S1 和S5 2 個數據點小數點后的3 位有效數字,即a 和b。
1/[Vo]=a×1/[S]+b
問題9.測定Vmax 和Km。
使用上面計算的線性函數(問題8)確定Vmax和Km。給出小數點后3 位數(不應進行單位轉換)。
問題10.反應混合物中的酶濃度。
用酶儲液濃度0.024 mg/mL 和酶的摩爾質量(75000 g/mol)計算反應混合物中的酶濃度(μmol/L)。給出小數點后3 位數。
問題11.轉化率常數。
催化速度常數kcat(1 個酶分子的反應速率)單位為1/s,計算公式如下:

計算出催化速度常數kcat,保留小數點后3 位。
2.1 抑制劑簡介
抑制劑是可以特異性結合酶的化合物,從而降低其活性并導致Km、Vmax 或兩者的明顯變化。 表觀動力學參數的變化可以從在抑制劑存在下進行的酶反應的Lineweaver-Burk 圖確定。 取決于與酶結合的方式,可逆抑制劑可以是競爭性的,非競爭性的或無競爭性的。
酶活性的抑制和動力學參數的明顯變化也可以在Michaelis-Menten 和Lineweaver-Burk 圖中顯現(圖8)。
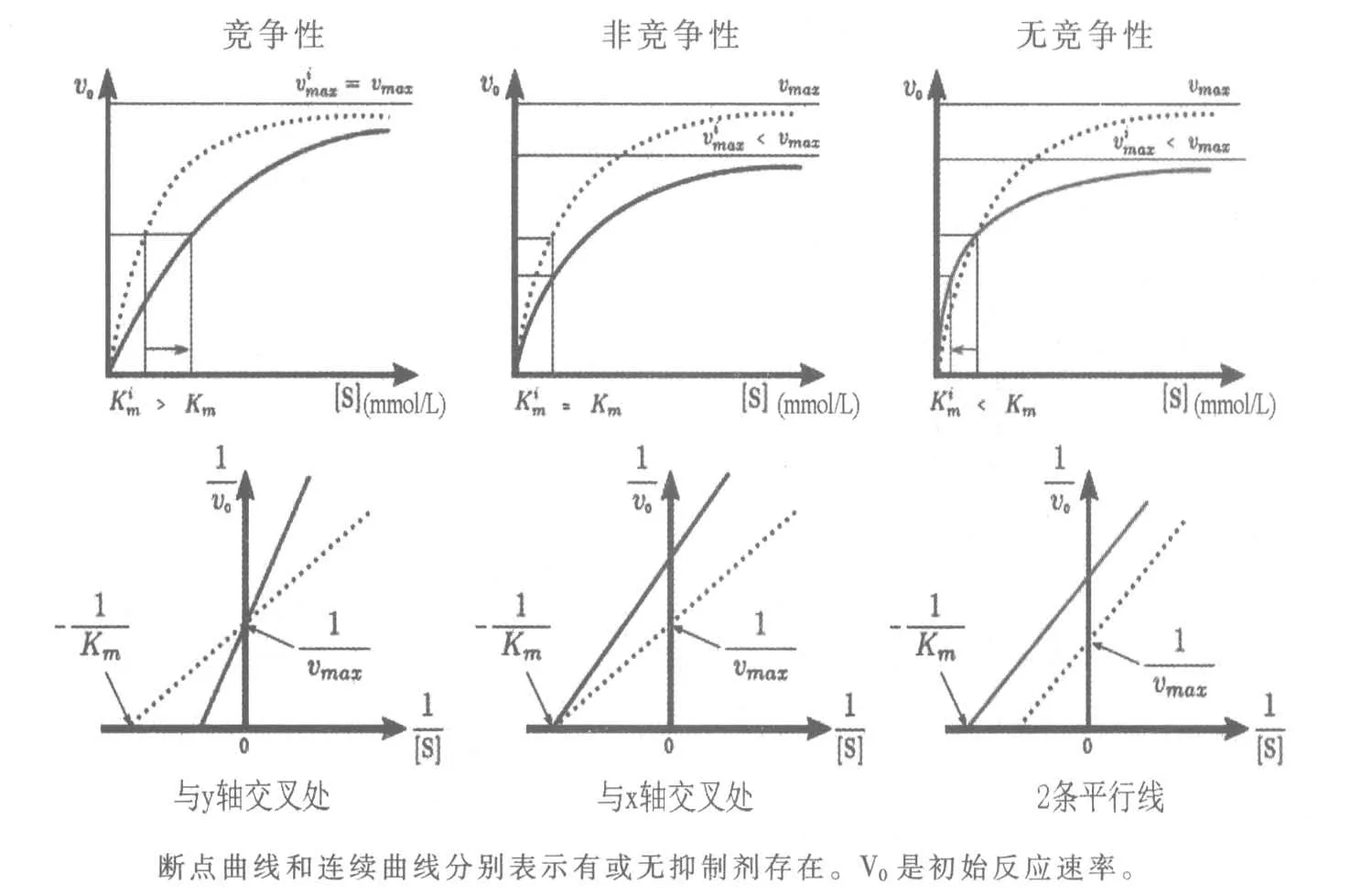
圖8 在Michaelis-Menten 和Lineweaver-Burk 圖中的抑制酶活性
抑制劑的特征在于其抑制平衡常數Ki,其定義為
其中[I]、[E]和[EI]分別是游離抑制性劑,游離酶和酶抑制劑復合物的濃度。對于競爭性抑制,在抑制劑存在下的表觀Km 被指定為Ki。 底物
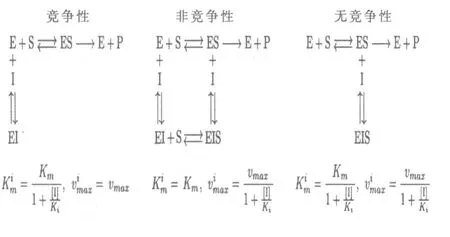
圖9
問題12.影響抑制劑的因素。
對于所有抑制類型,其抑制程度(即酶反應速率的降低)取決于(選擇下面最好的答案):
1)抑制濃度[I]2)底物濃度[S]
3)抑制劑的Ki4)[ES]的濃度
5)1,2 和3 的狀態6)1 和3 狀態
問題13.理解抑制劑的特性。
標示出以下語句的正確或錯誤:
在競爭性抑制中,底物濃度[S]的增加會降低或克服抑制效果。
2.2 對α-半乳糖苷酶的抑制作用(27 分)
這部分實驗類似于第1 b 部分。 α-半乳糖苷酶的抑制動力學實驗將在50 μL 抑制劑的存在下進行,其濃度為0.5 mol/L。
步驟:抑制動力學實驗底物制備。
A.根據表7 準備底物,這與你在第1.2.2 部分中所做的相似。注意應通過將試管倒置5 次混合溶液。

表7 用于動力學測定的底物稀釋方案
B.使用相同的移液管吸頭將50 μL 抑制劑(I抑制劑)轉移到微量滴定板B 孔A1~A5 和B1~B5中(見圖10 和/或微量滴定板模板)。
C.將50 μL 每種最終底物溶液(表7)轉移到相同的孔位置(A1~A5 和B1~B5)。

圖10 微量滴定板B
D.將定時器設置為5 min,并在開始第1 次酶反應后立即通過將酶溶液加入到第1 孔(ISI1)中開始,如下所述。
E.從ISI1 和ISII1 開始,將50 μL 的α-半乳糖苷酶(EEnzyme)加入孔A1~A5 和B1~B5,并繼續以與ISII5 相同的順序和速度開始酶反應。
F. 孵育5 min 后,使用p200 移液器加入100 μL 終止液(Stop),按照你開始加入時的相同順序和速度終止孔A1~A5 和B1~B5 中的每個酶反應。 在加入終止液后,立即將混合物上下移動2次,徹底混勻。
問題14.酶抑制劑動力學實驗。
舉起粉紅色卡片上交你的的微量滴定板。 測量后,所得值將自動顯示在表格(同表3)中。
注意:在考試的最后10 min 內不會接受微量滴定板。
2.3 α-半乳糖苷酶抑制動力學的數據分析
在本節中,你將利用第2.1 部分的理論和第2.2 部分提供的抑制數據(表8)計算抑制劑存在下的酶動力學參數。 用于抑制數據的Lineweaver-Burk 方程將與提供的假設的Lineweaver-Burk 方程進行比較,用于推導各種抑制類型和不受抑制的反應。當你確定抑制類型時,請使用這2 個方程式來確定相關動力學參數的變化,并使用相關方程來確定抑制平衡常數(Ki)。
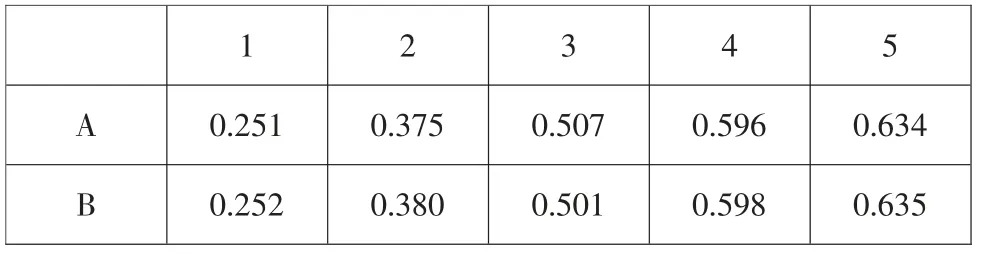
表8 抑制實驗的吸光度數據
問題15.抑制動力學數據分析。
計算并填寫表9。 為了以mmol/L 計算產物濃度,請使用問題6 給出的標準方程式:
吸光度A405=2.29×[pNP](mmol/L)+0.058。

表9
依據上表中抑制動力學數據IS1~IS5,產生Lineweaver-Burk 圖。
假設不受抑制的反應的Lineweaver-Burk 方程為:1/[Vo]=0.363·1/[S]+0.9908,將該線繪制在圖11 中。 請用此方程用于下面的計算,而不是你在1.3 部分中確定的方程式(圖7)。
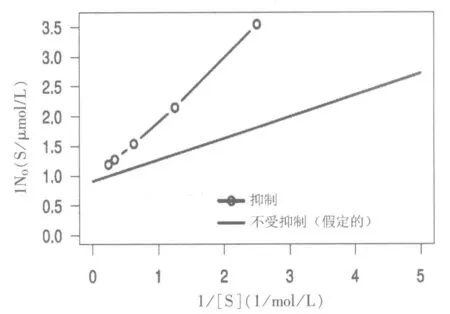
圖11 假設的非抑制性數據的Lineweaver-Burk 圖
問題16.線性函數(抑制反應)。
在存在抑制劑的情況下確定Lineweaver-Burk圖的線性函數(圖11),在數學上僅使用來自IS1和IS5 的數據。 a 和b 給出小數點后3 位。
1/[Vo]=a·1/[S]+b。
問題17.表觀動力學參數與抑制劑。
在抑制反應的Lineweaver-Burk 圖中確定存在抑制劑的表觀動力學參數。 給出小數點后3 位數(不需要進行單位轉換)。
問題18.確定抑制類型。
抑制劑對α-半乳糖苷酶有什么抑制作用? 與抑制酶的假設數據相比,基于抑制劑存在的動力學參數變化的大小,選擇最可能的抑制類型:
1)競爭性2)非競爭性3)不確定
問題19.底物濃度的影響。
根據你以上選擇的抑制類型,底物濃度的增加如何影響抑制? 選擇出正確答案:
1)抑制減弱2)無變化3)抑制增強
問題20.抑制常數。
如果添加到反應混合物中的50 μL 抑制劑的濃度為0.5 mol/L,則確定抑制常數(Ki)。 在小數點保留3 位數字(在此計算中不進行單位轉換)。
考試結束。
(第26 屆試題完)

