依那西普抗體的活性結構保護
房筱,李代禧,郭柏松,楊春生
(1. 上海理工大學 醫療器械與食品學院,上海 200093;2. 上海東富龍科技股份有限公司,上海 201108)
依那西普(etanercept),是全人源化腫瘤壞死因子(TNF-α)拮抗劑。它可以特異性地與TNF-α結合,競爭性阻斷TNF-α與細胞表面的受體結合[1],主要用于治療類風濕性關節炎[2]、強直性脊柱炎[3]、斑塊型銀屑病[4]、銀屑病性關節炎[5]、幼年特發性關節炎[6]以及中毒性表皮壞死松懈癥[7]等疾病。由于該類藥物復溶后的穩定性極差,故通常會加入海藻糖(trehalose,TRE)、蔗糖(sucrose,SUC)、甘露醇(mannitol,MAN)等保護劑作為輔料[8],以穩定抗體蛋白藥物的活性結構。在文獻[9]中選用海藻糖和甘露醇作為保護劑。雖然海藻糖對依那西普抗體蛋白具有保護效果,但在實際生產中不可能使用任何單一保護劑對藥物蛋白進行保護,獲得顯著的保護效果,通常需要考慮使用兩種或者兩種以上的保護劑來穩定蛋白質藥物的結構活性[10]。蛋白藥物制備中,有時不免要經歷低溫或冷凍干燥過程,在此過程中藥物分子活性結構容易發生改變,為此經常選擇一些活性保護劑加入藥物中,并研究藥物在溶液中和真空冷凍干燥條件下藥物分子的活性變化。
潘琦等[11]采用拉伸分子動力學和傘狀采樣研究了依那西普抗體蛋白的解離過程,通過計算其解離自由能,分析了依那西普抗體蛋白在真空干燥和水溶液環境下的穩定性,但對于其本身結構的變化情況、抗體蛋白與保護劑之間的相互作用,以及保護劑的保護作用機制并未進行深入研究。 而且隨著計算機運算能力和模擬算法設計的不斷改進,分子動力學方法越來越廣泛地應用于蛋白質的研究中[12]。
為此,本文以熱敏性抗體蛋白依那西普為研究對象,選擇海藻糖、蔗糖和甘露醇為保護劑,采用分子動力學模擬方法,對依那西普進行單一保護和復合保護研究。研究了在溶液和真空干燥環境下,保護劑對依那西普活性結構的保護作用與規律,以及保護劑的保護作用機制,從分子角度闡述保護劑對生物大分子的保護作用機理。
1 原理與方法
1.1 原理
分子間接觸數表征兩分子之間相互作用的強弱,在本研究中當兩個原子間的間距小于0.35 nm時,才認為原子間相互接觸,視作一個接觸數[13]。因此通過計算依那西普與保護劑以及依那西普與水之間的接觸數,以分別表征依那西普蛋白分子與保護劑分子和水分子之間作用力的強弱以及依那西普的優先作用傾向。接觸數越大,表明分子間的結合作用越強;反之結合作用越弱。
由于這3組體系分子數不同,含有的原子數也不同,因此模擬系統中保護劑和水分子原子總數差異較大。為了準確比較依那西普分子與不同保護劑或水分子結合作用的相對大小,本研究引用接觸系數的定義[13],定義依那西普的接觸系數CTW為
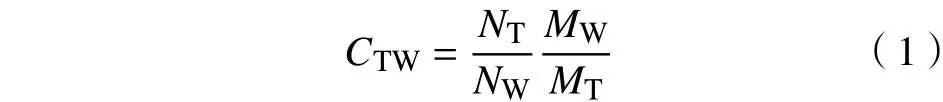
式中:NT為依那西普與保護劑的接觸數;NW為依那西普與水分子的原子接觸數;MT為保護劑分子的總原子數;MW為水分子的總原子數。CTW數值越大,表明依那西普與保護劑分子之間的結合作用越強,且依那西普是優先與保護劑作用的。
1.2 構建模型
依那西普晶體結構(PDB ID:3AVE)從PDB數據庫獲得,獲取地址為http://www.rcsb.org/pdb/explore/explore.do?structureId=3ave,具體分子結構如圖1所示。海藻糖、蔗糖、甘露醇的分子結構分別采用Gaussion 09化學軟件在B3LYP/6-31G*方法下進行結構優化[14],優化后的結構為最終結構,如圖2所示。
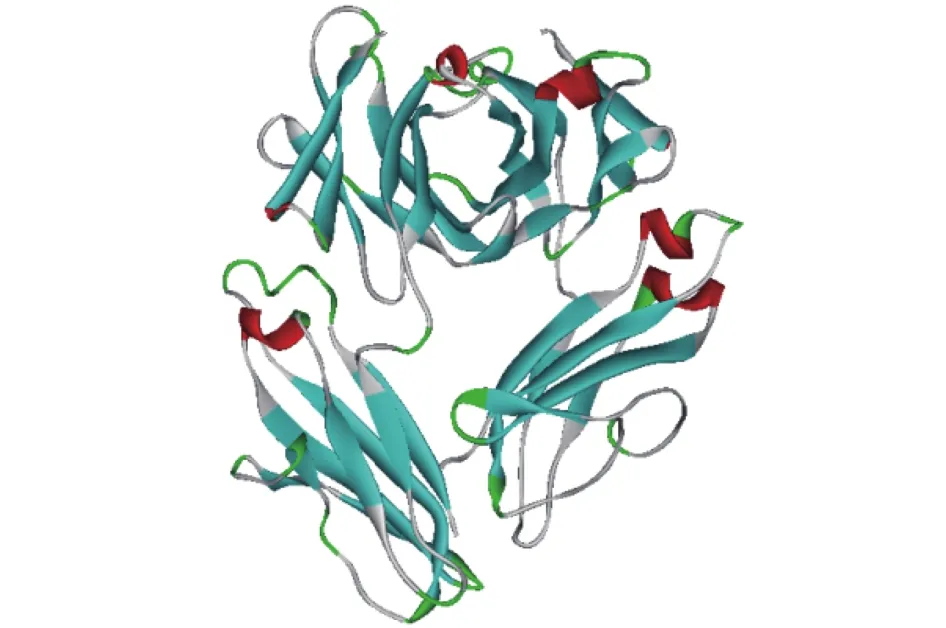
圖1 依那西普的三維結構Fig.1 Three-dimensional structure of etanercept
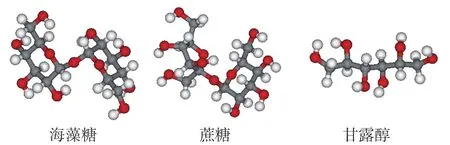
圖2 海藻糖、蔗糖、甘露醇的分子結構Fig.2 Molecular structures of trehalose, sucrose and mannitol
1.3 模擬方法
分子動力學模擬方法采用 Gromacs 5.1.4生物大分子軟件包[15],其中依那西普蛋白選用Amber99sb-ildn力場[16],水分子選用TIP3P模型[17]。在模擬過程中,時間步長設定為1 fs,范德華相互作用利用Lenard-Jones函數計算[18],截斷設為1.0 nm。為了修正范德華分子間的遠程相互作用,鄰近作用半徑設為1.0 nm,每10步重建一次鄰 近 列 表 。 采 用 PME( particle mesh Ewald) 方法[19]用于靜電相互作用的遠程修正,靜電相互作用的截斷設定為1.0 nm。
首先,建立 9 nm × 9 nm × 9 nm 的周期性體系,每個體系中分別添加相應的保護劑,添加離子中和體系電荷,共構建了3組保護體系以及1組對照體系,如表1所示。每個體系分別進行5 000步 的 能 量 最 小 化 , 再 以 LINCS(linear constraint solver)方法[20]限制所有化學鍵的鍵長,利用 Maxwell 分布方法[21]設置體系各原子的初始速度,并通過 Velocity-rescale方法[22]控制體系的溫度為 300 K,耦合常數為 0.1,同時系統壓力采用 Berendsen方法[23]設定體系的壓強耦合常數為0.5。對水溶液體系和真空環境體系分別進行5 ns的預平衡,再平衡 40 ns,得到均勻穩定的依那西普蛋白的水溶液體系和依那西普蛋白的真空環境體系。
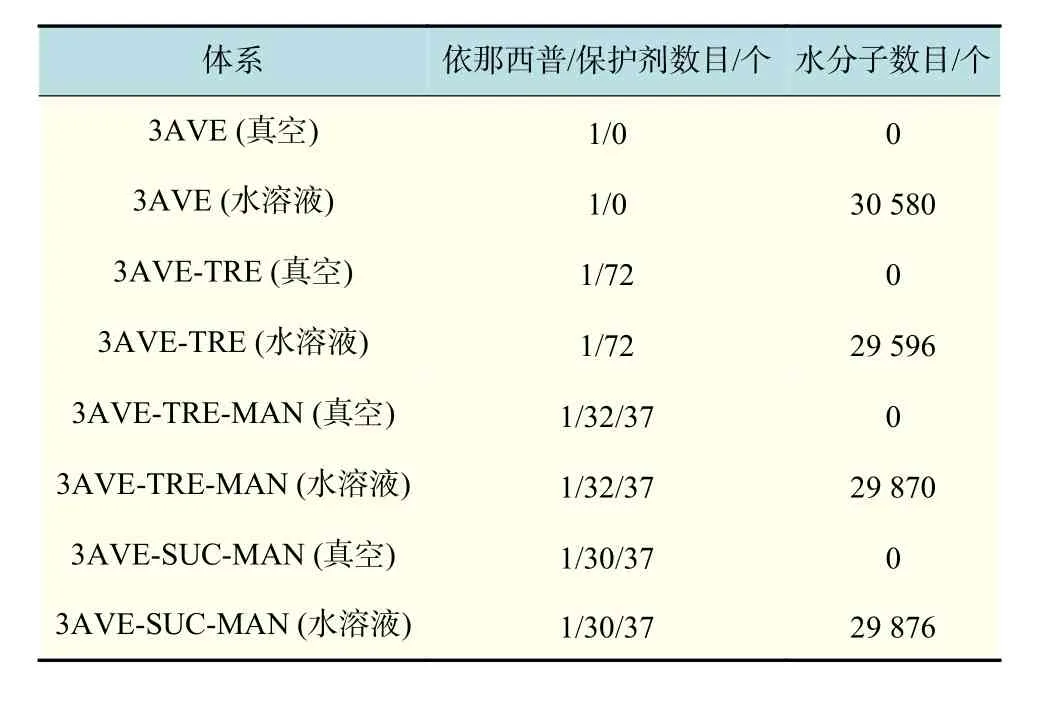
表1 依那西普4組保護體系的組成Tab.1 Composition of the four protective systems of etanercept
體系達到平衡后,取最后5 ns用于數據分析,采用SPSS19.0軟件中的單因素方差分析進行計算。對同一環境條件下,不同保護體系之間進行比較,運用單因素方差分析中的Tukey檢驗程序進行,所選取的置信區間為95%,并采用Origin8.0軟件對數據進行圖形化處理。
2 結果與討論
2.1 依那西普的結構穩定性分析
為了判斷分子動力學模擬過程中體系的穩定性,計算了主鏈相對于初始結構的均方根偏差(root mean square deviation, RMSD)。 RMSD 可以反映特定結構與初始結構的相似程度,均方根偏差值RMSD越低,表明特定結構與初始結構的差異性越小[24]。為此,分別計算了水溶液和真空環境下,依那西普在不同保護體系中的RMSD,如圖3所示,考察了不同環境及不同保護劑配方對抗體蛋白結構穩定性的影響。模擬平衡后,最后5 ns的RMSD之間的顯著性(檢測水平p = 0.05),在柱狀圖上用字母表示,字母相同表示無顯著差異,字母不同表示差異顯著。
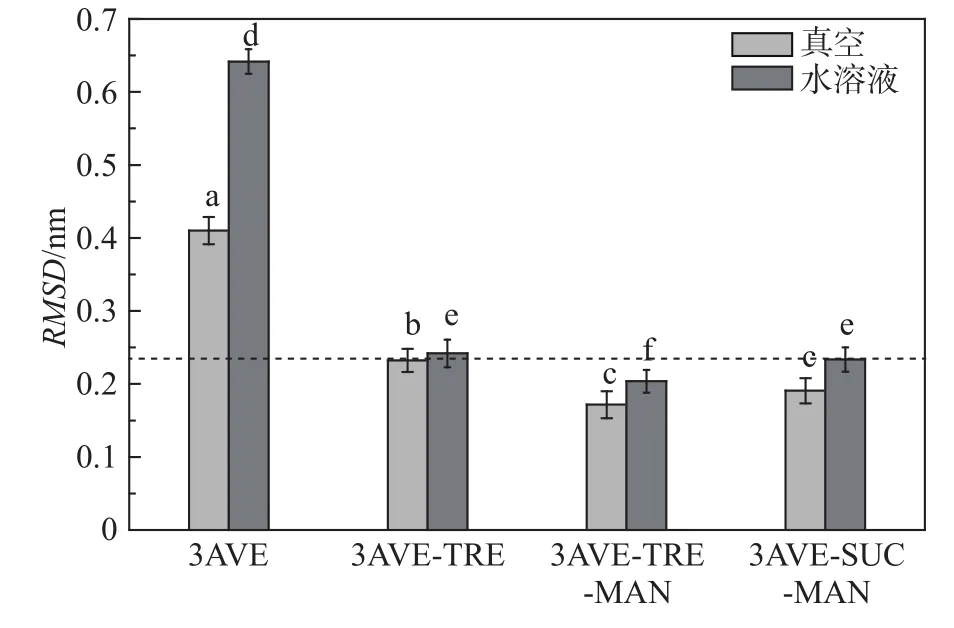
圖3 依那西普在真空干燥環境和水溶液中的RMSDFig.3 RMSD of each etanercept in vacuum drying and aqueous solutions environment
從圖3可以看出,真空環境中4種體系的依那西普RMSD比其在溶液中的RMSD低,其中海藻糖–甘露醇復合保護體系中依那西普的RMSD最低,此種復合保護劑對依那西普的穩定作用最強,與初始結構相比差異性最小。水溶液中4種體系的RMSD均比其各自在真空環境的RMSD略高,說明依那西普抗體蛋白在水溶液中的穩定性小于真空環境,溶液體系中水分子對蛋白藥物的穩定性有一定影響。加入保護劑后與未添加保護劑的抗體蛋白相比,其RMSD明顯降低,而且經過單因素方差分析后可以看出,具有保護劑的抗體蛋白的RMSD與未添加保護劑時相比具有顯著性差異,這說明保護劑能顯著提高體系中蛋白質的穩定性。在真空干燥環境中,具有復合保護劑的抗體蛋白的RMSD比純海藻糖保護體系的RMSD低,且具有顯著性差異,但是海藻糖–甘露醇復合保護體系及蔗糖–甘露醇復合保護體系中抗體蛋白的RMSD無顯著差異,這說明在依那西普活性保護過程中,在冷凍干燥條件下,復合保護體系能夠更好地保護抗體蛋白的活性結構。而在水溶液環境中,海藻糖–甘露醇復合保護體系的RMSD低于其他3組體系,且經過方差分析得出,其RMSD與其他3組相比具有顯著性差異。可見,海藻糖–甘露醇復合保護體系對依那西普活性結構保護效果最好。
為了檢測加入保護劑后對抗體蛋白原子的影響,計算了抗體蛋白中的主鏈原子的均方根漲落(root mean square fluctuation,RMSF),如圖 4 所示為抗體蛋白主鏈的均方根漲落值RMSF。
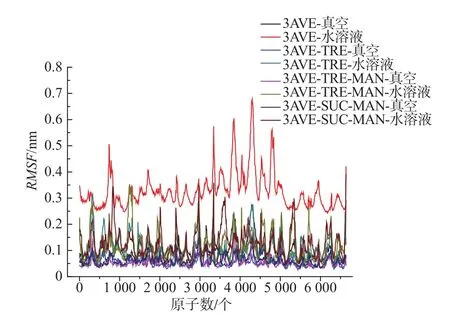
圖4 不同保護體系中依那西普主鏈的RMSFFig.4 RMSF of the etanercept’s main chain in different protective systems
由圖4可以得出,海藻糖–甘露醇復合保護體系中依那西普的RMSF最小,說明該保護劑與抗體蛋白存在較強的相互作用,能夠提高抗體蛋白的穩定性。在溶液體系中,依那西普在無保護劑的情況下,其RMSF較高,說明在純水溶液中依那西普抗體蛋白中的主鏈漲落幅度較大。而加入保護劑后,體系中原子漲落幅度有較明顯的降低,說明保護劑與抗體蛋白之間存在相互作用,從而降低了原子的運動強度,提高了蛋白體系的穩定性。加入保護劑后,抗體蛋白的主鏈漲落幅度相對較小,但還有一定漲落,說明保護劑并不能完全降低抗體蛋白原子的熱運動,分析其原因為保護劑并不是完全覆蓋在蛋白表面,不同保護劑具有選擇吸附性,且吸附區域不同,導致保護劑與抗體蛋白之間的相互作用存在強弱分布,如圖5所示。其中,橙色表示海藻糖;黃色表示蔗糖;紫色表示甘露醇。
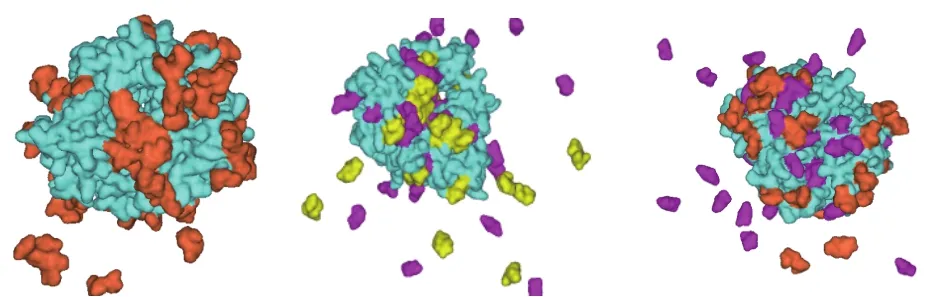
圖5 復合保護體系在依那西普抗體蛋白表面的吸附情況Fig.5 Adsorption of complex protective system on the surface of etanercept

圖6 依那西普與保護劑之間的平均相互作用能Fig. 6 Average interaction energy between etanercept and protectants
2.2 依那西普保護體系分子間的相互作用
依那西普抗體蛋白與保護劑分子間存在相互作用,通過比較分子間相互作用能以區分蛋白質與保護劑分子間相互作用力的強弱[25]。依那西普與不同保護劑之間的平均相互作用能如圖6所示。在水溶液環境中抗體蛋白與保護劑之間的相互作用能低于真空干燥環境,其原因是在水溶液中,保護劑、蛋白質、水三者之間均存在相互作用,保護劑均具有親水性,水分子與保護劑之間存在較強的相互作用,降低了保護劑與抗體蛋白之間的相互作用。在真空干燥環境中,海藻糖–甘露醇復合保護體系、蔗糖–甘露醇復合保護體系的相互作用能與純海藻糖體系相比具有顯著差異,說明單一保護體系對抗體蛋白的保護作用是有限的。在水溶液環境中,海藻糖–甘露醇復合保護體系與蔗糖–甘露醇復合保護體系的相互作用能值高于純海藻糖保護體系,且3種保護劑體系之間的相互作用能具有顯著差異,這說明復合保護劑與抗體蛋白之間有較強的相互作用,其中海藻糖–甘露醇復合保護劑與抗體蛋白的相互作用能較高。而兩種復合保護體系之間也具有顯著差異,說明海藻糖–甘露醇復合保護劑與抗體蛋白之間存在較多的分子間相互作用,這種復合保護體系更有利于穩定抗體蛋白的分子結構,這與差示掃描微量熱分析實驗結果海藻糖–甘露醇復合保護體系的保護效果最好是一致的[26]。
2.3 依那西普保護體系的分子間氫鍵作用
圖7為真空干燥環境與水溶液中依那西普與保護劑之間的氫鍵數。可以看出,真空干燥環境中抗體蛋白與保護劑之間的氫鍵數多于在水溶液中的氫鍵數,而在溶液中海藻糖–甘露醇復合保護與抗體蛋白之間存在較強的氫鍵相互作用,穩定抗體蛋白分子結構。通過單因素方差分析可以看出,真空干燥環境中抗體蛋白與保護劑之間的氫鍵數明顯多于兩者在溶液中的氫鍵數,由于在真空干燥環境中保護劑與依那西普蛋白之間形成了較多的分子間氫鍵,表現出較強的直接相互作用。而在水溶液環境中,由于大量水的存在,水與抗體蛋白、保護劑之間均存在分子間作用力,且部分保護劑與水的相互作用強于保護劑與抗體蛋白之間的相互作用。由于分子處在不停的運動中,部分保護劑與抗體蛋白接觸減少,使得保護劑與依那西普之間形成的分子間氫鍵較少,分子間的相互作用減弱。

圖7 真空干燥環境與水溶液中依那西普與保護劑之間的氫鍵數Fig.7 Number of hydrogen bonds between etanercept and protectants in vaccum drying and aqueous solution environment
在水溶液環境中,通過分析保護劑與抗體蛋白之間的氫鍵數的平均值和方差得出,復合保護體系中保護劑與抗體蛋白之間的氫鍵數多于單一保護體系兩者之間的數量,說明復合保護劑與抗體蛋白之間形成較多的氫鍵結合位置,也間接說明復合保護劑之間能夠協同交叉保護抗體蛋白。而且動力學和熱力學研究也表明,復合保護體系中保護劑與依那西普蛋白之間的氫鍵數目多于單一保護劑體系[11]。
由于保護劑對蛋白藥物的保護作用主要是通過分子間相互作用實現的,主要推動力是靜電相互作用,同時氫鍵也起到一定的作用[27]。有研究表明,糖類與蛋白質之間的氫鍵結合是抑制蛋白質在冷凍干燥過程中發生結構變性的主要原因[28],說明在冷凍干燥過程中蛋白質與保護劑之間形成的氫鍵,能夠降低熱振動和穩定體系的結構,有利于蛋白質的結構保持穩定性。通過分析保護劑與抗體蛋白之間的氫鍵,得出復合保護體系中保護劑與抗體蛋白之間的氫鍵相互作用強于海藻糖單一保護體系,而海藻糖–甘露醇復合保護體系對抗體蛋白的氫鍵相互作用最大。
2.4 依那西普保護體系的分子間接觸系數
圖8為溶液中抗體蛋白與保護劑之間的接觸系數。從接觸系數及方差分析中可以看出,復合保護體系的接觸系數遠大于單一保護體系,且海藻糖–甘露醇復合保護體系的接觸系數最大,為6.63。所以在溶液中復合保護體系中保護劑與蛋白質有較多的分子間接觸,在溶液中抗體蛋白不僅與保護劑之間存在分子間接觸,而且還與水之間存在較多的接觸,計算得出它們之間的接觸系數均大于1,說明在溶液中依那西普更易于與保護劑之間產生分子間接觸。在3種保護體系中,海藻糖–甘露醇復合保護劑與抗體蛋白之間的接觸能力更強,與抗體蛋白分子間產生的分子間結合作用也是最強。
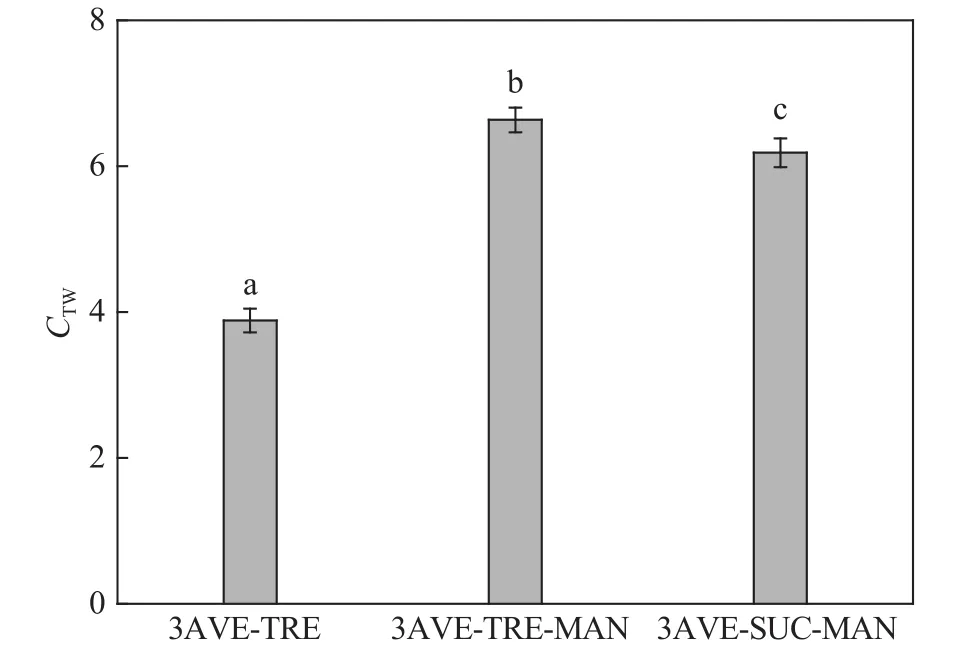
圖8 依那西普與保護劑之間的接觸系數Fig.8 Number of contact coefficient between etanercept and protectants
3 結 論
通過分析海藻糖–甘露醇復合保護體系、蔗糖–甘露醇復合保護體系、純海藻糖體系中保護劑與蛋白質之間的相互作用關系,并與不添加保護劑的體系相比,可以看出這3種保護體系對依那西普抗體蛋白均具有保護作用。其中,海藻糖–甘露醇復合保護體系與蔗糖–甘露醇體系對抗體蛋白結構活性的穩定作用強于純海藻糖保護體系,而海藻糖–甘露醇復合保護體系的對抗體蛋白保護作用更強。本文從分子水平上闡述了保護劑對抗體蛋白的保護作用機理,這不僅篩選出依那西普抗體蛋白的最適保護劑,而且還從理論上解釋了其活性保護作用規律。分子模擬方法與實驗篩選相比,不僅節省了大量的篩選時間、研究成本,而且能從理論上闡釋篩選出的保護劑對蛋白質的保護效果及作用機理,特別是針對大通量篩選最適保護劑,此種方法更能節約成本。隨著分子動力學模擬方法不斷發展,如模擬算法、分子力場的發展、模擬技術與分子數據庫相結合,相信以后此方法在諸多領域中會起到越來越重要的作用。

