腸道菌群調(diào)控下的食物過(guò)敏機(jī)制研究進(jìn)展
傅玲琳,謝夢(mèng)華,王 翀,黃健健,錢(qián) 怡,王彥波,*
近些年,食物過(guò)敏人群數(shù)量快速增加,調(diào)查發(fā)現(xiàn)約8%的兒童和4%的成人對(duì)一種或多種食物有過(guò)敏癥狀,這被認(rèn)為與環(huán)境變化和抗生素藥物使用等因素有關(guān)[1]。食物過(guò)敏是對(duì)無(wú)害食物蛋白質(zhì)(即過(guò)敏原)產(chǎn)生的不良反應(yīng),分為由免疫球蛋白(immunoglobulin,Ig)E介導(dǎo)、非IgE介導(dǎo)以及IgE和非IgE混合介導(dǎo)3 類(lèi),其反應(yīng)時(shí)間短,多在數(shù)分鐘到2 h內(nèi)引發(fā)各類(lèi)癥狀[2]。一般人攝入此類(lèi)食物蛋白質(zhì)通常因口服耐受產(chǎn)生IgG、IgM、IgA,從而清除抗原,機(jī)體不產(chǎn)生癥狀,但一些特殊人群攝入特定種類(lèi)的過(guò)敏原會(huì)產(chǎn)生IgE[3],從而快速引發(fā)機(jī)體多個(gè)部位不同的癥狀反應(yīng),如皮膚的瘙癢、紅腫、蕁麻疹,呼吸道的哮喘、咳嗽,胃腸道的惡心、嘔吐、腹瀉等;反應(yīng)嚴(yán)重時(shí)甚至導(dǎo)致休克和死亡[2]。食物過(guò)敏的產(chǎn)生與機(jī)體對(duì)食物抗原的口服耐受失調(diào)或者缺失有關(guān)[2]。研究表明,胃腸道中影響免疫耐受的兩個(gè)主要因素是食物本身和共生微生物的組成與功能[4];因此,口服耐受的形成及維持與機(jī)體腸道內(nèi)的共生微生物有密切關(guān)系。另外,特定益生菌菌株因其能夠修飾抗原、修復(fù)腸屏障功能、調(diào)節(jié)紊亂菌群結(jié)構(gòu)以及恢復(fù)局部或全身免疫調(diào)節(jié),從而增強(qiáng)機(jī)體的免疫耐受,因此具有緩解食物過(guò)敏的潛力[5]。
本文主要從口服耐受和食物過(guò)敏產(chǎn)生的分子及細(xì)胞水平機(jī)理出發(fā),闡述目前已報(bào)道的腸道共生微生物及其代謝產(chǎn)物調(diào)節(jié)食物過(guò)敏的主要機(jī)理,并歸納近些年文獻(xiàn)中報(bào)道的具有抗過(guò)敏效果的益生菌種類(lèi),以期為食物過(guò)敏的預(yù)防及治療提供新的思路,并最終減少食物過(guò)敏的發(fā)生。
1 食物過(guò)敏概述
1.1 食物過(guò)敏流行病學(xué)特點(diǎn)
地域環(huán)境、基因遺傳、膳食結(jié)構(gòu)、種族差異等是造成食物過(guò)敏流行病學(xué)地區(qū)分布差異的主要原因。研究表明多種因素會(huì)影響食物過(guò)敏的發(fā)病率,不可控因素如年齡(嬰幼兒比成人易對(duì)食物過(guò)敏)、性別(兒童中男孩發(fā)病率高)、種族(非白種人比白種人發(fā)病率高)以及遺傳基因及家族遺傳病等;還有一些可控的潛在因素如特征性皮炎、衛(wèi)生習(xí)慣、腸道菌群、維生素(VA和VD)缺乏、膳食結(jié)構(gòu)(脂肪過(guò)多)、抗氧化劑和抗酸劑的使用(影響過(guò)敏原的消化)等[6]。地域環(huán)境、膳食結(jié)構(gòu)使得不同地區(qū)食物過(guò)敏的主要過(guò)敏原種類(lèi)有所不同,如亞洲主要為甲殼類(lèi)及貝類(lèi)過(guò)敏,美國(guó)為花生及牛奶過(guò)敏[7]。年齡對(duì)過(guò)敏發(fā)病率也有很大影響,調(diào)查發(fā)現(xiàn)在對(duì)雞蛋、牛奶、小麥以及大豆過(guò)敏的兒童中,約70%~80%在成年后不再對(duì)相應(yīng)過(guò)敏原有過(guò)敏反應(yīng)[8-13],約50%在6 歲后就不再對(duì)雞蛋和牛奶過(guò)敏,而花生過(guò)敏兒童僅有20%在成年后不再過(guò)敏,堅(jiān)果過(guò)敏兒童中更是僅有10%[14-18]。
目前,對(duì)于同一地區(qū)或不同地區(qū)、同一人群或不同人群存在多個(gè)不同的食物過(guò)敏流行病學(xué)數(shù)據(jù),主要是因?yàn)閷?duì)于食物過(guò)敏的診斷還未有統(tǒng)一的標(biāo)準(zhǔn)。現(xiàn)臨床上多通過(guò)病史和體檢確認(rèn)過(guò)敏原、皮膚點(diǎn)刺實(shí)驗(yàn)(skin prick test,SPT)和血清抗原特異性lgE(specific IgE,slgE)檢測(cè)以及被奉為食物過(guò)敏診斷金標(biāo)準(zhǔn)的雙盲安慰劑對(duì)照的食物激發(fā)實(shí)驗(yàn)(double-blind,placebo-controlled food challenge,DBPCFC)等方法判斷食物過(guò)敏[18-19],這些方法各有優(yōu)點(diǎn)與不足,不同的研究者往往會(huì)根據(jù)自身情況采用不同的診斷方法,從而使得食物過(guò)敏的流行病學(xué)數(shù)據(jù)一般都是基于自我的報(bào)告研究,得出的食物過(guò)敏流行病學(xué)數(shù)據(jù)存在差異,沒(méi)有統(tǒng)一的標(biāo)準(zhǔn)和結(jié)果[18,20]。
1.2 口服耐受與食物過(guò)敏
1.2.1 腸道中食物抗原攝取
食物過(guò)敏原(大多為蛋白質(zhì))在進(jìn)入機(jī)體后,會(huì)經(jīng)過(guò)兩個(gè)階段被攝取吸收。第1階段:食物蛋白首先經(jīng)過(guò)胃腸道的消化分解變?yōu)樾》肿拥鞍谆蚨嚯摹Q芯勘砻鞯鞍椎南蕦?duì)過(guò)敏原的致敏性有影響,Untersmayr等[21]利用小鼠模型對(duì)比了抗酸劑、魚(yú)類(lèi)蛋白共同口服灌胃致敏小鼠和魚(yú)類(lèi)蛋白單獨(dú)灌胃致敏小鼠的致敏性差異,發(fā)現(xiàn)抗酸劑的使用會(huì)增加小鼠產(chǎn)生食物過(guò)敏的機(jī)率,表明酸(主要指胃酸)能降低食物蛋白的致敏性。這可能是因?yàn)槿羰澄锏鞍妆煌耆瑒t無(wú)法形成完整的與IgE結(jié)合位點(diǎn),故無(wú)法和嗜堿性粒細(xì)胞、肥大細(xì)胞表面的IgE結(jié)合,從而不能誘發(fā)食物過(guò)敏反應(yīng)[22]。第2階段:分解后的蛋白或多肽等主要通過(guò)5 種方式通過(guò)腸道屏障(圖1):1)腸道相關(guān)的淋巴組織(gut associated lymphoid tissue,GALT)中某些組織,如派式結(jié)(Peyer’s patches,PP)和孤立淋巴濾泡中的微褶皺(microfold cells,M)細(xì)胞,可通過(guò)跨細(xì)胞途徑從腸腔中攝取顆粒抗原(包括微生物)。隨后,這些抗原被呈遞到位于上皮細(xì)胞下方或者M(jìn)細(xì)胞基底表面創(chuàng)造的“口袋”中的樹(shù)突狀細(xì)胞(dendritic cells,DCs);同時(shí),周?chē)纳掀ぜ?xì)胞將產(chǎn)生趨化因子CCL20,與遠(yuǎn)端的DCs表面CCR6受體識(shí)別結(jié)合后使之遷移至此處[23];2)可溶性抗原通過(guò)上皮細(xì)胞的緊密連接擴(kuò)散通過(guò)腸上皮細(xì)胞[23-25];3)通過(guò)腸上皮細(xì)胞的跨細(xì)胞途徑[23-24];4)在某些條件下,腸上皮細(xì)胞能在基底外側(cè)表面表達(dá)主要組織相容性復(fù)合物(major histocompatibility complex,MHC)II類(lèi)蛋白,從而攝取抗原[23-24,26];5)CX3CR1+巨噬細(xì)胞通過(guò)延伸“觸角”攝取腸腔中抗原,并可將抗原呈遞給附近的CD103+DCs[27-29]。
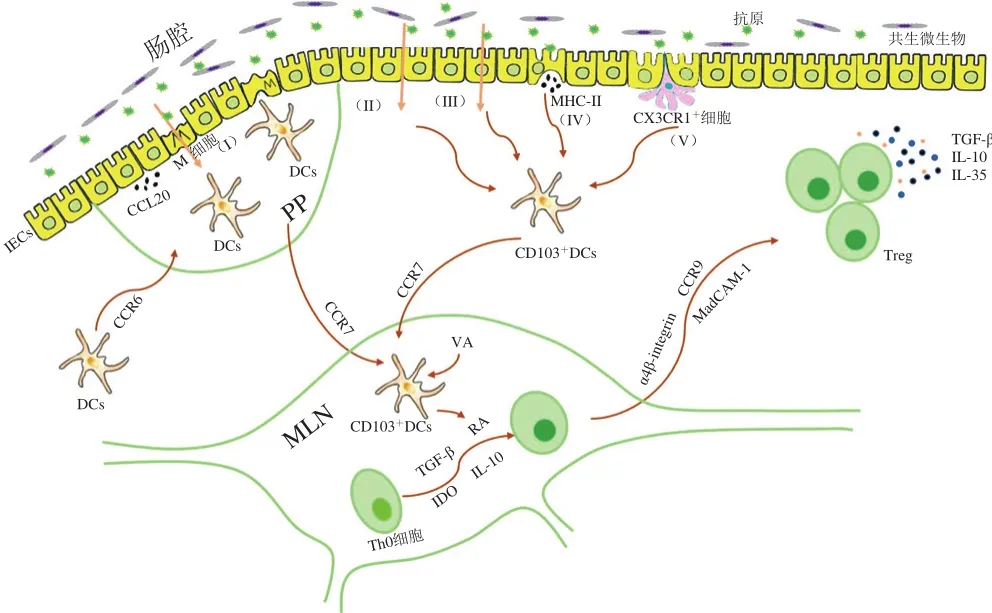
圖1 腸道相關(guān)的淋巴組織中抗原攝取及產(chǎn)生口服耐受的機(jī)理Fig. 1 Mechanisms of antigen uptake and oral tolerance to antigens in GALT
1.2.2 口服耐受產(chǎn)生機(jī)理
機(jī)體對(duì)自身抗原及無(wú)害的非自身抗原的免疫無(wú)應(yīng)答稱(chēng)為免疫耐受[2]。免疫耐受在機(jī)體正常生長(zhǎng)繁殖中起著至關(guān)重要的作用,人體對(duì)進(jìn)入機(jī)體的病原體會(huì)產(chǎn)生多種免疫應(yīng)答,從而清除病原體,而免疫耐受保證了機(jī)體對(duì)食物中外源蛋白不產(chǎn)生應(yīng)答。為維持免疫耐受,機(jī)體不但要識(shí)別自身抗原和非自身抗原,還要區(qū)分非自身抗原對(duì)機(jī)體是否有害[24],而胃腸道在這一過(guò)程中則扮演著重要角色。對(duì)于機(jī)體不同部位(腸道、皮膚等)、不同抗原(可溶性抗原、腸道微生物等),免疫耐受機(jī)理略有差異,本文側(cè)重于闡述食物蛋白通過(guò)腸道黏膜系統(tǒng)引起口服耐受。
如圖1所示,口服耐受主要由CD103+DCs介導(dǎo)[2],CD103+DCs攜帶已通過(guò)腸道屏障的抗原,遷移至腸系膜淋巴結(jié)(mesenteric lymph node,MLN)中,并將抗原呈遞給初始輔助性T細(xì)胞(helper T cells,Th)0,從而促進(jìn)Th0細(xì)胞分化為調(diào)節(jié)性T細(xì)胞(regulation T cells,Treg)[26],Treg的分化涉及多重機(jī)制:1)CD103+DCs受Aldh1a2調(diào)控表達(dá)視黃酸脫氫酶2(retinaldehyde dehydrogenase2,RALDH2),將VA轉(zhuǎn)化視黃酸(retinoic acid,RA),從而促進(jìn)Th0細(xì)胞分化為T(mén)reg,并提高Treg表面腸道歸巢受體CCR9的含量[30-32]。研究表明,視黃酸不僅能促進(jìn)T細(xì)胞的歸巢反應(yīng),還能促進(jìn)B細(xì)胞的歸巢反應(yīng),并且能與DCs分泌的白細(xì)胞介素(interleukin,IL)-5、IL-6產(chǎn)生協(xié)同作用,誘導(dǎo)IgA分泌[33]。2)CD103+DCs表面的αvβ8上調(diào)從而激活周?chē)鷿撛诘霓D(zhuǎn)化生長(zhǎng)因子-β(transforming growth factor-β,TGF-β),進(jìn)而促進(jìn)Treg分化和口服耐受的形成[34-35]。3)CD103+DCs自身也可產(chǎn)生TGF-β,從而促使Th0細(xì)胞分化為T(mén)reg[24,36]。4)CD103+DCs能夠表達(dá)一種參與色氨酸代謝的酶——吲哚胺2,3-雙加氧酶(indoleamine 2,3-dioxygense,IDO),促進(jìn)Treg分化[2,24]。研究表明,抑制IDO的活性將會(huì)抑制Treg分化,并轉(zhuǎn)而促使Th0細(xì)胞分化為T(mén)h1和Th17細(xì)胞[37]。隨后,MLN中的CD103+DCs誘導(dǎo)新形成的Treg表面上腸道歸巢受體CCR9、α4β7以及β7整合素的配體——黏膜血管地址素細(xì)胞黏附分子1(mucosal vascular addressin cell adhesion molecule 1,MadCAM-1)的表達(dá),從而使Treg從MLN遷移至小腸固有層(抗原被攝入的地方),從而形成或維持口服耐受[23,38-39]。口服耐受中涉及多種Treg,如產(chǎn)IL-10的Tr1、Th3、Foxp3+Treg[23],且目前大量研究表明Foxp3+Treg在口服耐受中起著至關(guān)重要的作用[4,29,32,39]。抗原特異性的Foxp3+Treg通過(guò)產(chǎn)生細(xì)胞因子TGF-β、IL-10、IL-35抑制腸道固有層中對(duì)食物的不良反應(yīng)[40]。
1.2.3 食物過(guò)敏產(chǎn)生機(jī)理
大量研究表明,食物過(guò)敏是由口服耐受被打破或缺失所引起,多種通路在此過(guò)程中發(fā)揮著重要的調(diào)控作用[29,32]。食物過(guò)敏原可經(jīng)口腔攝入或者與皮膚接觸,從而引發(fā)過(guò)敏反應(yīng),且有文獻(xiàn)報(bào)道,食物抗原經(jīng)口攝入易誘導(dǎo)口服耐受,而皮膚接觸則易誘導(dǎo)食物過(guò)敏[41]。
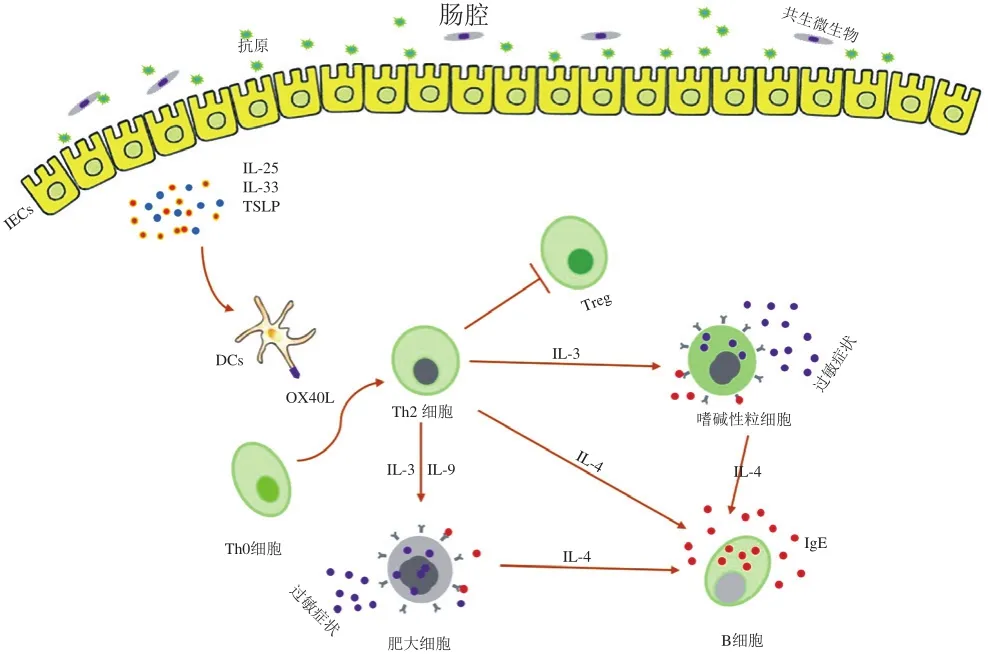
圖2 食物致敏的機(jī)理Fig. 2 Mechanisms contributing to food sensitization
如圖2所示,當(dāng)腸上皮細(xì)胞受損、腸道發(fā)生炎癥或黏膜佐劑作用時(shí),會(huì)增加抗原的滲透,同時(shí)腸上皮細(xì)胞就會(huì)分泌胸腺基質(zhì)淋巴細(xì)胞生成素(thymic stromal lymphopoietin,TSLP)、IL-33和IL-25(主要參與皮膚途徑致敏過(guò)程),從而上調(diào)DCs上OX40配體水平[2,42]。研究表明,這些細(xì)胞因子會(huì)促進(jìn)Th2細(xì)胞轉(zhuǎn)化,產(chǎn)生Th2型炎癥[42]。隨之,抗原由DCs等抗原遞呈細(xì)胞(antigen-presenting cells,APCs)收集并遞呈給淋巴結(jié)中的Th0細(xì)胞,激活的Th0細(xì)胞在IL-4的存在下分化為T(mén)h2細(xì)胞[43]。Th2細(xì)胞通過(guò)分泌IL-4促進(jìn)B細(xì)胞中Ig發(fā)生類(lèi)型轉(zhuǎn)換,從而產(chǎn)生抗原特異性IgE[2-3]。除此之外,Th2細(xì)胞也可通過(guò)IL-3、IL-9促進(jìn)肥大細(xì)胞和嗜堿性粒細(xì)胞分泌IL-4,從而也可激活B細(xì)胞。B細(xì)胞分泌的抗原特異性IgE能與抗原穿透部位的肥大細(xì)胞所表達(dá)的高親和力FcεRI受體結(jié)合,其余的抗體則通過(guò)淋巴系統(tǒng)進(jìn)入人體循環(huán),與血液中的嗜堿性粒細(xì)胞和遠(yuǎn)隔組織中的肥大細(xì)胞相結(jié)合,使機(jī)體致敏[2,44]。當(dāng)致敏機(jī)體再次攝入過(guò)敏原后,抗原會(huì)迅速與致敏肥大細(xì)胞或嗜堿性粒細(xì)胞表面的特異性IgE結(jié)合,使肥大細(xì)胞脫顆粒,釋放組胺、白三烯、5-羥色胺、趨化因子等,而嗜堿性粒細(xì)胞分泌大量IL-4、IL-13等細(xì)胞因子,從而產(chǎn)生過(guò)敏反應(yīng)組織特異性癥狀[3]。
多項(xiàng)過(guò)敏人群研究數(shù)據(jù)和食物過(guò)敏動(dòng)物模型結(jié)果表明,食物過(guò)敏的各類(lèi)癥狀主要是由于肥大細(xì)胞和嗜堿性粒細(xì)胞所引起的[2,45-46],正如上所述,肥大細(xì)胞脫顆粒,釋放組胺、白三烯等,嗜堿性粒細(xì)胞分泌大量IL-4、IL-5、IL-13等Th2型細(xì)胞因子,從而引發(fā)過(guò)敏反應(yīng)多種不良癥狀[3]。但近些年,有研究發(fā)現(xiàn)在花生過(guò)敏個(gè)體中,骨髓細(xì)胞也參與食物過(guò)敏的早期,如單核細(xì)胞、嗜中性粒細(xì)胞等[2,47-48]。Tordesillas等[47]采用質(zhì)譜流式測(cè)定花生過(guò)敏患者在短時(shí)暴露于花生過(guò)敏原后外周血中所有主要類(lèi)型細(xì)胞的激活情況,發(fā)現(xiàn)除嗜堿性粒細(xì)胞外,單核細(xì)胞、DCs、嗜中性粒細(xì)胞也被激活。類(lèi)似的,在雞蛋過(guò)敏患者的外周血單核細(xì)胞中也發(fā)現(xiàn)Toll樣受體(Toll-like receptor,TLR)和單核細(xì)胞被激活的現(xiàn)象[49]。很多研究者在不同的過(guò)敏原致敏動(dòng)物模型中發(fā)現(xiàn)了不同的現(xiàn)象,因此,對(duì)于食物過(guò)敏發(fā)生機(jī)制還沒(méi)有一個(gè)全面的、確切的定論,仍有待進(jìn)一步研究[2]。
2 腸道菌群(共生菌)調(diào)節(jié)食物過(guò)敏
2.1 腸道菌群與食物過(guò)敏之間的聯(lián)系
食物抗原在腸道內(nèi)(主要是小腸)被消化吸收,而腸腔中定居著成千上萬(wàn)種微生物,稱(chēng)為共生微生物,且從胃底部的十二指腸到直腸,腸腔內(nèi)微生物數(shù)量逐漸增加,結(jié)腸中微生物數(shù)量可達(dá)1011個(gè)/g內(nèi)容物[50]。大量研究表明,人體腸道中(特別是回腸和結(jié)腸)定居的大量微生物在機(jī)體腸道黏膜免疫系統(tǒng)中扮演著重要的角色,不僅能促進(jìn)體內(nèi)局部區(qū)域維持平衡,在黏膜外周也能調(diào)節(jié)對(duì)抗原的免疫應(yīng)答[51]。但腸道內(nèi)共生菌種類(lèi)及數(shù)量(統(tǒng)稱(chēng)為菌群結(jié)構(gòu))并不是一成不變的,它會(huì)受外部環(huán)境的影響而發(fā)生改變。研究表明,膳食結(jié)構(gòu)改變、抗生素的使用、順產(chǎn)還是剖腹產(chǎn)、母乳喂養(yǎng)、疫苗接種等都會(huì)改變腸道菌群結(jié)構(gòu)[52]。多項(xiàng)實(shí)驗(yàn)表明腸道菌群結(jié)構(gòu)發(fā)生變化會(huì)使機(jī)體內(nèi)一些保護(hù)體內(nèi)平衡的信號(hào)缺失,破壞Th1/Th2平衡,使其偏向Th2反應(yīng),從而誘發(fā)過(guò)敏及炎癥反應(yīng)[29,53],這也是近些年食物過(guò)敏高發(fā)的原因之一。
對(duì)過(guò)敏人群研究數(shù)據(jù)表明,使用抗生素會(huì)提高食物過(guò)敏的發(fā)病率,即使是幼年時(shí)期低劑量抗生素的攝入也會(huì)導(dǎo)致一個(gè)長(zhǎng)期的代謝和免疫應(yīng)答[54]。如Mets?l?等[55]發(fā)現(xiàn)母體在懷孕前/中以及孩子出生1 個(gè)月內(nèi)服用抗生素與嬰幼兒牛奶過(guò)敏發(fā)生率增加密切相關(guān)。此外,多項(xiàng)動(dòng)物實(shí)驗(yàn)研究也表明利用廣譜抗生素消除或減少腸道微生物,可加劇食物過(guò)敏反應(yīng)。如Stefka等[56]在花生過(guò)敏模型中,發(fā)現(xiàn)用抗生素處理新生小鼠,其體內(nèi)的花生特異性IgE和IgG1會(huì)增加。Cahenzli等[57]利用無(wú)菌小鼠構(gòu)建食物過(guò)敏模型,發(fā)現(xiàn)其體內(nèi)含有高水平IgE,且過(guò)敏癥狀更為嚴(yán)重。此外,有文獻(xiàn)報(bào)道將正常小鼠糞便或腸道微生物接種到無(wú)菌小鼠或抗生素處理小鼠體內(nèi),可有效減輕食物過(guò)敏癥狀。如接種梭狀芽孢桿菌(Clostridia,屬于厚壁菌門(mén);16S rRNA測(cè)序表明經(jīng)抗生素處理的小鼠腸道內(nèi)擬桿菌門(mén)和厚壁菌門(mén)的細(xì)菌數(shù)量顯著減少)到抗生素處理小鼠腸道內(nèi),可防止食物過(guò)敏的發(fā)生[56];但同時(shí)也發(fā)現(xiàn),在花生過(guò)敏模型中分別接種單形擬桿菌(典型的擬桿菌)和梭狀芽孢桿菌(典型的厚壁菌)到無(wú)菌小鼠體內(nèi),梭狀芽孢桿菌能顯著降低花生特異性IgE含量,而單形擬桿菌則無(wú)此功效[56]。在食物過(guò)敏的小鼠模型中,時(shí)常發(fā)現(xiàn)同一致敏組中,盡管大部分小鼠都表現(xiàn)出過(guò)敏癥狀,但仍有部分小鼠對(duì)于過(guò)敏原的攝入無(wú)免疫應(yīng)答,Diesner等[58]發(fā)現(xiàn),無(wú)免疫應(yīng)答小鼠的腸道內(nèi)有獨(dú)特的菌群結(jié)構(gòu),可防止食物過(guò)敏。
2.2 腸道菌群調(diào)控食物過(guò)敏的相關(guān)機(jī)理
雖然普遍認(rèn)為食物過(guò)敏的產(chǎn)生與腸道菌群的變化有很大關(guān)系,但現(xiàn)今對(duì)腸道菌群調(diào)控食物過(guò)敏的確切機(jī)理知之甚微、沒(méi)有明確的結(jié)論,這方面的研究仍然處于剛起步的階段。目前已經(jīng)發(fā)現(xiàn)的腸道微生物調(diào)節(jié)食物過(guò)敏的可能機(jī)理見(jiàn)圖3,主要包括以下幾個(gè)方面。
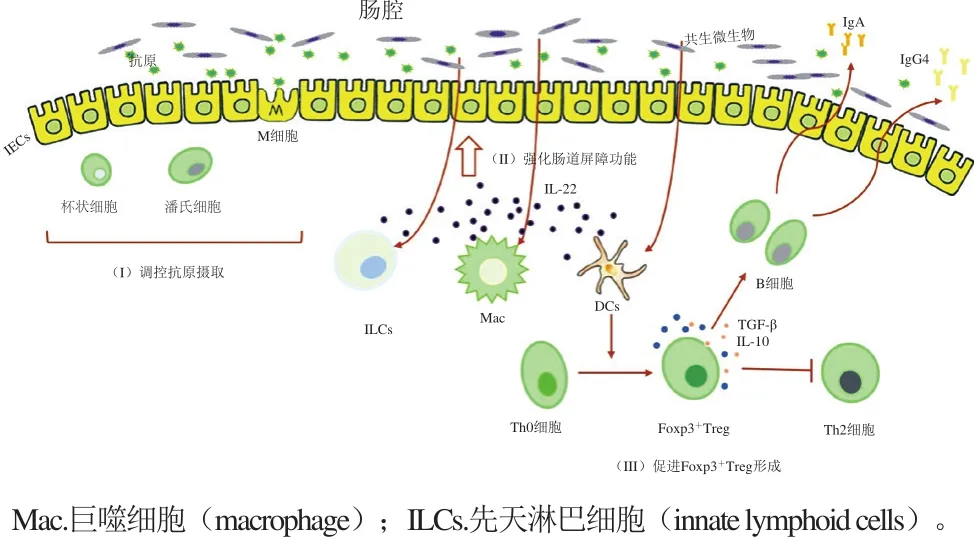
圖3 腸道微生物調(diào)節(jié)食物過(guò)敏的潛在機(jī)理Fig. 3 Potential mechanisms of action of intestinal microorganisms in regulating food allergy
2.2.1 腸道微生物與IEC旁多種細(xì)胞相互作用,調(diào)控抗原攝取,維持黏膜免疫平衡
IEC作為腸道屏障的重要組成部分,可通過(guò)其緊密連接調(diào)控腸腔的食物抗原進(jìn)入固有層[23]。腸道微生物可直接與IEC作用,促進(jìn)防御素的產(chǎn)生,從而加強(qiáng)腸道上皮細(xì)胞屏障功能[18]。IEC能表達(dá)TLR并產(chǎn)生細(xì)胞因子以應(yīng)對(duì)腸道內(nèi)微生物的不斷刺激[59]。IEC中的M細(xì)胞在微生物信號(hào)的刺激下可以遞呈抗原給DCs等APCs[29];杯狀細(xì)胞能夠分泌黏液形成一層屏障,阻斷大部分的微生物和IEC的直接接觸[60];潘氏細(xì)胞能夠產(chǎn)生抗菌肽,從而調(diào)節(jié)菌群結(jié)構(gòu)[61]。CX3CR1+細(xì)胞(疑似一種巨噬細(xì)胞)一般位于腸道固有層,主要參與從腸腔內(nèi)攝取抗原,但當(dāng)腸道菌群結(jié)構(gòu)發(fā)生變化,它會(huì)遷移至其他地方,從而降低抗原攝取影響口服耐受的形成[62]。現(xiàn)有研究也表明CX3CR1+細(xì)胞可產(chǎn)生IL-10從而促進(jìn)固有層中的Treg增殖[63]。
2.2.2 腸道微生物誘導(dǎo)IL-22產(chǎn)生,強(qiáng)化腸道屏障功能,防止食物過(guò)敏
IL-22僅能由血細(xì)胞產(chǎn)生,但其受體則由非血細(xì)胞(特別是黏膜中的腸上皮細(xì)胞)產(chǎn)生,在免疫細(xì)胞和腸道上皮細(xì)胞的交流中扮演著重要角色[64]。腸道微生物可以與DCs、巨噬細(xì)胞、先天淋巴細(xì)胞相互作用,促進(jìn)IL-22的產(chǎn)生,加強(qiáng)腸道上皮細(xì)胞屏障功能[18]。如1.2.2節(jié)所述,CD103+DCs在產(chǎn)生及維持口服耐受中起著至關(guān)重要的作用,但研究表明CD103+DCs可接收微生物信號(hào)(如鞭毛蛋白)產(chǎn)生IL-23,再誘導(dǎo)其他細(xì)胞產(chǎn)生IL-22,影響上皮細(xì)胞功能[29]。但也有研究表明,腸道嗜酸性粒細(xì)胞可以分泌嗜酸性粒細(xì)胞過(guò)氧化物酶激活CD103+DCs,使MLN中Th0細(xì)胞分化為T(mén)h2細(xì)胞而不是Treg[65]。ILC有多種類(lèi)型,ILC2能夠產(chǎn)生Th2型細(xì)胞因子,加劇食物過(guò)敏,而ILC3(特別是RORγt+ILC3)在其他細(xì)胞產(chǎn)生的IL-6、IL-23、RA調(diào)控下產(chǎn)出IL-22,強(qiáng)化IEC功能,促進(jìn)抗菌肽(如再生胰島衍生蛋白3β和黏液)的表達(dá)[29]。在穩(wěn)定狀態(tài)下,若小鼠缺乏RORγt+ILC3,其腸腔內(nèi)的微生物將更容易遷移至外周其他器官,但這可通過(guò)攝入IL-22改善[66]。
2.2.3 腸道微生物代謝產(chǎn)物可誘導(dǎo)Foxp3+Treg產(chǎn)生,從而促進(jìn)口服耐受,防止食物過(guò)敏
腸道中食物的代謝產(chǎn)物能夠向機(jī)體傳送一些信號(hào),從而調(diào)節(jié)機(jī)體免疫應(yīng)答。由于不同的膳食結(jié)構(gòu)給微生物提供的營(yíng)養(yǎng)物質(zhì)不同,就會(huì)產(chǎn)生不同的腸道菌群組成,從而引起不同的免疫應(yīng)答。如膳食纖維在腸道微生物的作用下可分解為短鏈脂肪酸(short-chain fatty acids,SCFAs),如乙酸、丙酸、丁酸,從而參與機(jī)體各個(gè)代謝途徑[32]。SCFAs是結(jié)腸細(xì)胞的能量源泉,不僅可作為組蛋白去乙酰化酶(histone deacetylase,HDAC)抑制劑通過(guò)單羧酸轉(zhuǎn)運(yùn)蛋白進(jìn)入細(xì)胞,還能通過(guò)G蛋白偶聯(lián)受體(G protein-coupled receptors,GPRs)傳遞信號(hào)[29]。研究表明Treg與GPRs傳送的信號(hào)、HDAC抑制均有所聯(lián)系[29]。SCFAs與GPRs結(jié)合后不僅可作用于腸上皮細(xì)胞激活炎性小體產(chǎn)生IL-18,從而強(qiáng)化腸道完整性、修復(fù)上皮細(xì)胞損傷[67],還可作用于DCs,從而促進(jìn)Th0細(xì)胞分化為Foxp3+Treg,并且也可直接作用于Foxp3+Treg,促進(jìn)其自我增殖[24]。研究表明,高膳食纖維飲食或直接口服灌胃乙酸、丙酸、丁酸均能夠提高無(wú)菌小鼠或抗生素處理小鼠體內(nèi)Foxp3+Treg的比例[32]。除此之外,也有文獻(xiàn)報(bào)道,微生物能夠直接作用于Th0細(xì)胞,促進(jìn)其分化為Foxp3+Treg[18]。如梭狀芽孢桿菌通過(guò)在結(jié)腸固有層中誘導(dǎo)產(chǎn)生高TGF-β的環(huán)境,從而促進(jìn)Foxp3+Treg分化[56]。形成的Foxp3+Treg細(xì)胞可通過(guò)TGF-β、IL-10、IL-35抑制炎癥反應(yīng),維護(hù)口服耐受[40]。另外,也有文獻(xiàn)報(bào)道,腸道微生物誘導(dǎo)形成的Foxp3+Treg能夠分泌TGF-β、IL-10,從而促進(jìn)分泌IgA/IgG4型B細(xì)胞產(chǎn)生更多IgA/IgG4進(jìn)入腸腔,維護(hù)免疫耐受[18]。Foxp3+Treg可以抑制Th2細(xì)胞,降低Th2型細(xì)胞因子和抗原特異性IgE[32]。
雖然腸道共生微生物影響結(jié)腸外其他部位的免疫應(yīng)答能力已在多個(gè)實(shí)驗(yàn)中得到證實(shí),但結(jié)腸(屬于大腸)中微生物的信號(hào)如何形成對(duì)小腸中食物抗原的免疫應(yīng)答仍然是一個(gè)懸而未決的問(wèn)題。目前對(duì)此的解釋大體有3種,第1種是通過(guò)淋巴細(xì)胞的遷移[51]。如圖1所示,DCs在CCR6調(diào)控下,從遠(yuǎn)處遷移至M細(xì)胞附近,以遞呈抗原;MLN中的Treg在歸巢受體CCR9和α4β7作用下遷移至小腸;CD4+T細(xì)胞在α4β7和GPR15信號(hào)作用下會(huì)遷移至結(jié)腸部位[51]。這表明GALT中的免疫應(yīng)答雖然是高度分區(qū)的,但卻不是嚴(yán)格不變的,結(jié)腸中淋巴細(xì)胞可通過(guò)淋巴管網(wǎng)絡(luò)或體液循環(huán)遷移至小腸中,從而影響小腸中對(duì)食物抗原的應(yīng)答[68]。第2種是微生物誘導(dǎo)某些淋巴細(xì)胞群產(chǎn)生細(xì)胞因子,后者通過(guò)多種循環(huán)進(jìn)入其他位置,從而直接參與免疫反應(yīng)[51]。如2.2.2節(jié)所述,結(jié)腸中的ILC可通過(guò)產(chǎn)生IL-22從而影響小腸中抗原的攝取。結(jié)腸中的Foxp3+Treg也能釋放抗炎細(xì)胞因子,后者在小腸中可促成耐受壞境[51]。第3種就是結(jié)腸中微生物代謝產(chǎn)物通過(guò)血液循環(huán)到達(dá)機(jī)體其他部位,從而發(fā)揮作用,典型代表就是SCFAs[29]。SCFAs參與血液循環(huán),可在門(mén)靜脈、肝和周?chē)o脈中檢測(cè)到[69]。正如2.2.3節(jié)所述,SCFAs能夠促進(jìn)口服耐受,防止食物過(guò)敏。雖然有這3 種解釋?zhuān)菍?duì)于大腸中的微生物信號(hào)調(diào)控小腸中食物抗原引起的免疫反應(yīng)的確切機(jī)理仍不清楚,需進(jìn)一步研究。
3 益生菌治療食物過(guò)敏
益生菌是一類(lèi)對(duì)宿主有益的活性微生物,是定植于人體腸道、生殖系統(tǒng)內(nèi),能產(chǎn)生確切健康功效從而改善宿主微生態(tài)平衡、發(fā)揮有益作用的活性有益微生物的總稱(chēng)。2006年,世界衛(wèi)生組織和聯(lián)合國(guó)糧農(nóng)組織定義益生菌為“攝入適量且對(duì)宿主有益的活性微生物”。有研究報(bào)道,當(dāng)機(jī)體中食物過(guò)敏風(fēng)險(xiǎn)增加時(shí),益生菌可促進(jìn)腸內(nèi)抗原的降解/結(jié)構(gòu)修飾,調(diào)節(jié)促炎因子的分泌,促使腸道內(nèi)異常原生微生物菌群正常化,改善腸道屏障功能,從而影響腸道微環(huán)境和免疫系統(tǒng)[5]。因此很多研究人員考慮是否可以通過(guò)益生菌來(lái)調(diào)節(jié)腸道菌群,從而預(yù)防及治療食物過(guò)敏。
3.1 益生菌在治療食物過(guò)敏中的應(yīng)用
近些年,利用益生菌治療食物過(guò)敏的案例很多,所使用的益生菌種類(lèi)也有很多,但主要為乳桿菌屬和雙歧桿菌屬,表1列舉了一些文獻(xiàn)中報(bào)道的有治療食物過(guò)敏效果的益生菌。文獻(xiàn)研究結(jié)果表明,益生菌主要通過(guò)調(diào)節(jié)過(guò)敏小鼠體內(nèi)的細(xì)胞平衡(包括Th1/Th2、Th17/Treg)以及Ig(包括IgE、IgG1、IgG2a、IgA)的產(chǎn)生,從細(xì)胞因子產(chǎn)出、細(xì)胞分化、抗體分泌這幾個(gè)方面調(diào)節(jié)食物過(guò)敏癥狀;但益生菌調(diào)節(jié)食物過(guò)敏與腸道菌群結(jié)構(gòu)變化之間的確切關(guān)系,益生菌改變菌群結(jié)構(gòu)后向機(jī)體傳達(dá)何種能預(yù)防食物過(guò)敏的信號(hào),以及整個(gè)過(guò)程的免疫通路調(diào)節(jié)機(jī)制仍然沒(méi)有結(jié)論,有待進(jìn)一步研究。
3.2 未來(lái)抗過(guò)敏益生菌研究的發(fā)展方向
雖然大量文獻(xiàn)都報(bào)道益生菌有預(yù)防或治療食物過(guò)敏的潛力,但并不是每一種益生菌都有此功效,因?yàn)橐嫔鷮?duì)食物過(guò)敏的調(diào)節(jié)作用由菌株種類(lèi)決定,具有特異性。如2.1節(jié)中所述,在花生過(guò)敏小鼠模型中分別接種梭狀芽孢桿菌和單形擬桿菌,梭狀芽孢桿菌能治療花生過(guò)敏,而單形擬桿菌則不能[56]。因此,篩選出具有抗過(guò)敏功效的益生菌成為應(yīng)用益生菌預(yù)防及治療食物過(guò)敏的首要問(wèn)題,但目前對(duì)抗過(guò)敏益生菌的篩選多是采用動(dòng)物實(shí)驗(yàn)進(jìn)行摸索,實(shí)驗(yàn)周期長(zhǎng)、盲目性大,成果甚微,故建立有效、簡(jiǎn)便的篩選方法可能是抗過(guò)敏益生菌研究的一個(gè)方向。此外,抗過(guò)敏益生菌的研究大多是針對(duì)一種益生菌或者兩種,多種益生菌組合的研究較少;而單種益生菌抗過(guò)敏的作用具有局限性,只能調(diào)節(jié)部分過(guò)敏癥狀或者只對(duì)特定的過(guò)敏原才有效果。因此,未來(lái)可考慮多種益生菌的協(xié)同作用或者益生菌與益生元的結(jié)合使用,從而更有效預(yù)防及治療食物過(guò)敏。另外,雖然有很多抗過(guò)敏益生菌的研究,但目前對(duì)益生菌的抗過(guò)敏效果仍然有一些爭(zhēng)議。有研究表明,雖然益生菌能夠降低機(jī)體內(nèi)總IgE水平,減緩過(guò)敏特征性癥狀,但并不能減輕哮喘或呼吸困難的癥狀[70],而且益生菌治療食物過(guò)敏大多數(shù)據(jù)均建立于動(dòng)物實(shí)驗(yàn)的基礎(chǔ)之上,臨床上少量的應(yīng)用還只局限于觀察現(xiàn)象,鮮有研究應(yīng)用益生菌治愈食物過(guò)敏機(jī)制的案例。因此,未來(lái)抗過(guò)敏益生菌的研究應(yīng)不再局限于動(dòng)物實(shí)驗(yàn)而逐步向臨床應(yīng)用邁進(jìn),將益生菌真正應(yīng)用于治療食物過(guò)敏。
4 結(jié) 語(yǔ)
對(duì)食物抗原的口服耐受的形成與維持涉及多種物質(zhì)、組織、細(xì)胞之間復(fù)雜的相互作用,包括食物抗原、腸道共生微生物、MLN、PP、LP、IECs、APCs、淋巴細(xì)胞等,這些相互作用對(duì)機(jī)體正常的生長(zhǎng)發(fā)育和內(nèi)環(huán)境穩(wěn)態(tài)至關(guān)重要。而口服耐受被打破或者缺失往往會(huì)導(dǎo)致食物過(guò)敏的發(fā)生,使機(jī)體多個(gè)部位、組織產(chǎn)生不良反應(yīng)。大量研究表明,腸道菌群在機(jī)體免疫系統(tǒng)的形成和功能調(diào)節(jié)中扮演著不可或缺的角色[6,29,51]。腸道微生物與腸上皮細(xì)胞、巨噬細(xì)胞、樹(shù)突狀細(xì)胞、先天免疫細(xì)胞等相互作用,能直接或者通過(guò)產(chǎn)生IL-22間接增強(qiáng)腸上皮細(xì)胞屏障,控制食物抗原的攝取,并且通過(guò)誘導(dǎo)Foxp3+Treg細(xì)胞的形成抑制Th2型反應(yīng),同時(shí)可產(chǎn)生IL-10、TGF-β促進(jìn)IgA、抗原特異性的IgG4的分泌,從而增強(qiáng)免疫耐受,防止食物過(guò)敏的發(fā)生。益生菌能夠調(diào)節(jié)腸道菌群結(jié)構(gòu)并且副作用甚小,因此成為近些年預(yù)防及治療食物過(guò)敏的熱點(diǎn),但目前對(duì)于腸道菌群調(diào)節(jié)食物過(guò)敏的機(jī)制以及益生菌緩解食物過(guò)敏的研究都處于初步階段,仍需科研工作者花費(fèi)大量時(shí)間和精力去進(jìn)一步探索。

