普通小麥 TaTFL1基因的克隆及表達特性研究
何慶夢,高 翔,2,楊明明,2,董 劍,2,李曉燕,2,趙萬春,2
(1.西北農林科技大學農學院,陜西楊凌 712100; 2.陜西省小麥工程技術研究中心/陜西省小麥新品種培育工程研究中心,陜西楊凌 712100)
小麥產量由單位面積穗數、穗粒數和粒重構成。由于受品種遺傳特性和壞境條件的制約,粒重的增加幅度相對有限;而穗粒數的變異相對較大,所以通過提高穗粒數來提高小麥單產的潛力大于通過增加粒重的潛力[1]。而穗粒數的形成主要取決于每穗分化小穗數、每穗分化小花數和分化小花的結實數,其中每穗實際分化的小穗數對穗粒數的形成具有重要意義。前人在對控制小穗數基因的研究中發現, Photoperiod-1( Ppd-1)基因能夠通過抑制FLOWERINGLOCUST(FT)基因的表達來增加小麥穗粒數[2]。而擬南芥 Terminal Flower 1(TFL1)與FT基因也表現出了明顯的相互抑制,在擬南芥和水稻等植物中過表達 TFL1及其同源基因也表現出了成花數的增加[3-4]。由于 Ppd-1與 TFL1基因都能抑制FT基因的表達,因此 TaTFL1也可能對小麥的穗部發育及其小穗數的形成具有重要的作用。
迄今,對 TFL1基因的研究主要是在擬南芥和水稻等模式植物中進行。 TFL1基因在擬南芥中被首次發現,Shannon等[5]通過對擬南芥進行EMS誘變,得到了頂端成花的 tfl-1( terminal flowerl-1)突變體,該突變體提早開花,花序發育受到抑制,且花序被頂花和1~2個側花所組成的花序結構所終止。TFL1被認為在莖端阻止接受LEAFY(LFY)、APETALA1(AP1)傳導的信號,又或是延遲LFY、AP1的上調,以此來抑制LFY、AP1的活性,形成合適的花序結構;LFY、AP1則在花分生組織頂端的外圍抑制 TFL1的轉錄,形成并維持花分生組織的特性[6-8]。在對黑麥草的研究中發現, LpTFL1基因在除成熟的種子外的組織中都有表達,并受到溫度與長日照的調控[9]。另外,長日照條件也能誘導 TFL1在植株的營養頂端分生組織中產生較弱水平的表達,隨后其表達開始逐漸增強[12]。而水稻中的4個 TFL1同源基因則分別表現出不同的時空表達模式,且有3個基因主要在次級分生組織中表達, Oscen1基因在各時期各組織中都有微弱的表達;而 Oscene2在根和黃化苗中的表達量較強; Oscen3在除葉片外的其他組織表達量較高; Oscen4基因在葉片和葉鞘中未檢測到表達,而在根部與黃化苗中表達強烈,在花序和幼苗中表達較弱[11]。Serrano等[3]對擬南芥 TFL1的5′和3′端的順式調控元件進行研究,發現其表達是基于不同的順式調控區,且3′端的編碼序列對 TFL1的表達最為重要。Guan等[12]在探究激素對擬南芥花序發育影響的研究中發現,細胞分裂素和生長素可能通過誘導分生組織特征基因 TFL1的表達來調節擬南芥花序的形態建成及發育過程,表明激素也參與調控 TFL1基因的表達。這些研究表明, TFL1及其同源基因的表達受諸多因素的影響,在不同植物中存在一定的表達模式差異。
TFL1及其同源基因在植物開花及花序結構的發育中具有重要的作用,且該基因控制植物開花和花序結構的機制可能相對保守[13]。但小麥中尚未見到對該基因的表達特征的相關研究報道。本研究通過克隆小麥第五同源群上 TaTFL1部分同源基因,并利用生物信息學技術對其序列組成、結構特征及進化關系進行初步分析,對啟動子區順式作用元件進行預測,進一步運用qRT-PCR技術分析 TaTFL1在小麥不同組織中的表達特征,以期為進一步探究該基因的功能機制奠定理論基礎。
1 材料與方法
1.1 供試材料
普通小麥中國春(CS)由西北農林科技大學小麥品質實驗室提供,部分種子在室內培養,在種子萌發后的2、5和10 d分別收集幼根和葉片,并用液氮處理后置于-80 ℃保存備用。同時以室內培養的中國春的幼苗為材料,采用CTAB法提取基因組DNA。部分中國春的種子種植于田間,自小麥種植后分別采集1~2 cm、2~4 cm、4~5 cm和5~6 cm幼穗,同時采集花前穗下莖、穎殼和旗葉以及花后5、10和15 d的穗下莖、穎殼、籽粒和旗葉,用液氮速凍后置于-80 ℃保存備用。
1.2 RNA的提取及cDNA第一鏈的合成
RNA的提取按照RNAprep Pure Plant Kit(天根,北京)說明書進行,并通過瓊脂糖凝膠電泳檢測所提取RNA的完整性,使用NanoDropTMOne(Thermo Scientific,美國)測定RNA的濃度。然后根據PrimeScriptTMRT reagent Kit with gDNA Eraser(TaKaRa,日本)說明書合成cDNA第一鏈。
1.3 TaTFL1基因及其啟動子的克隆
根據NCBI(https://www.ncbi.nlm.nih.gov/)已公布的擬南芥 TFL1基因(GenBank登錄號:NM_120465.3)序列在Ensembl plants(http://plants.ensembl.org/Triticum_aestivum/Tools/Blast?db=core)進行在線比對,利用比對的最優結果設計特異性引物(表1),以中國春gDNA及cDNA為模板進行擴增。PCR體系與程序參考2×Es Taq MasterMix(康為世紀,北京)說明書,其中循環數為30,退火溫度為62 ℃,延伸時間為5 min。PCR產物回收后與克隆載體pEASY-T1(全式金,北京)連接,轉化,挑選陽性克隆送公司測序,測序所得結果使用NCBI-BLASTN(https://blast.ncbi.nlm.nih.gov/Blast.cgi?PROGRAM=blastn&PAGE_TYPE=BlastSearch&LINK_LOC=blasthome)及DNAMAN 5.0進行序列比對分析。
在Ensembl plants中搜索得到 TaTFL1基因5′端上游2 500 bp大小的序列,并根據其保守區設計引物TP-F和TP-R(表1)進行擴增。PCR體系與程序參考2×Es Taq MasterMix(康為世紀,北京)說明書,其中循環數為30,退火溫度為60 ℃,延伸時間為2 min。利用Promoter 2.0 Prediction Server(http://www.cbs.dtu.dk/services/Promoter/)在測序結果中預測啟動子區域,再利用PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)對預測的啟動子區域進行順式調控元件分析。
1.4 TaTFL1基因的生物信息學分析
首先將測序結果提交至NCBI-ORF Finder(https://www.ncbi.nlm.nih.gov/orffinder/),預測 TaTFL1基因的ORF,利用NCBI-CDD(https://www.ncbi.nlm.nih.gov/Structure/cdd/docs/cdd_search.html)預測該基因編碼蛋白的結構域。然后,利用GSDS(http://gsds.cbi.pku.edu.cn/)預測基因外顯子-內含子結構。進一步,利用ExPASy-ProtParam(https://web.expasy.org/protparam/)、ExPASy-ProtScale(https://web.expasy.org/protscale/)、Cell-PLoc 2.0( http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/)、CBS-SignalP(http://www.cbs.dtu.dk/services/SignalP/)和CBS-ProtFun(http://www.cbs.dtu.dk/services/ProtFun/)等分別預測該基因編碼蛋白的理化性質、疏水性、亞細胞定位、信號肽及功能;利用NCBI-BLASTP(https://blast.ncbi.nlm.nih.gov/Blast.cgi?PROGRAM=blastp&PAGE_TYPE=Blast Search&LINK_LOC=blasthome)對所得序列進行同源搜索,獲得不同植物中TFL1同源蛋白序列及其登錄號,再通過DNAMAN 5.0和MEGA 6.0等軟件對TaTFL1同源蛋白進行序列比對及NJ系統進化樹的構建,bootstrap值設置為1 000,其他均采用軟件默認參數。
1.5 TaTFL1基因表達分析
由于 TaTFL1基因三個部分同源基因序列的一致性很高,因而未能設計出針對每一個基因組進行熒光定量的引物,而是根據三者共同的保守序列設計了共同的熒光定量引物,為避免cDNA中有未除盡的基因組DNA的干擾,熒光定量引物按照跨兩個外顯子區進行設計,以小麥Actin基因(GenBank登錄號:AB181991.1)作為內參基因,引物信息見表1。在ABI 7300 Plus Real Time PCR System(ABI,美國)進行qRT-PCR,體系與程序按照SYBR○RPremix Ex TaqTMII(Tli RNaseH Plus)(TaKaRa,日本)說明書進行,其中循環數為40,退火溫度為60 ℃,退火時間為30 s。每個樣品設置3次生物學重復及3次技術重復,利用 2-ΔΔCT法[14]計算 TaTFL1基因的相對表達量。
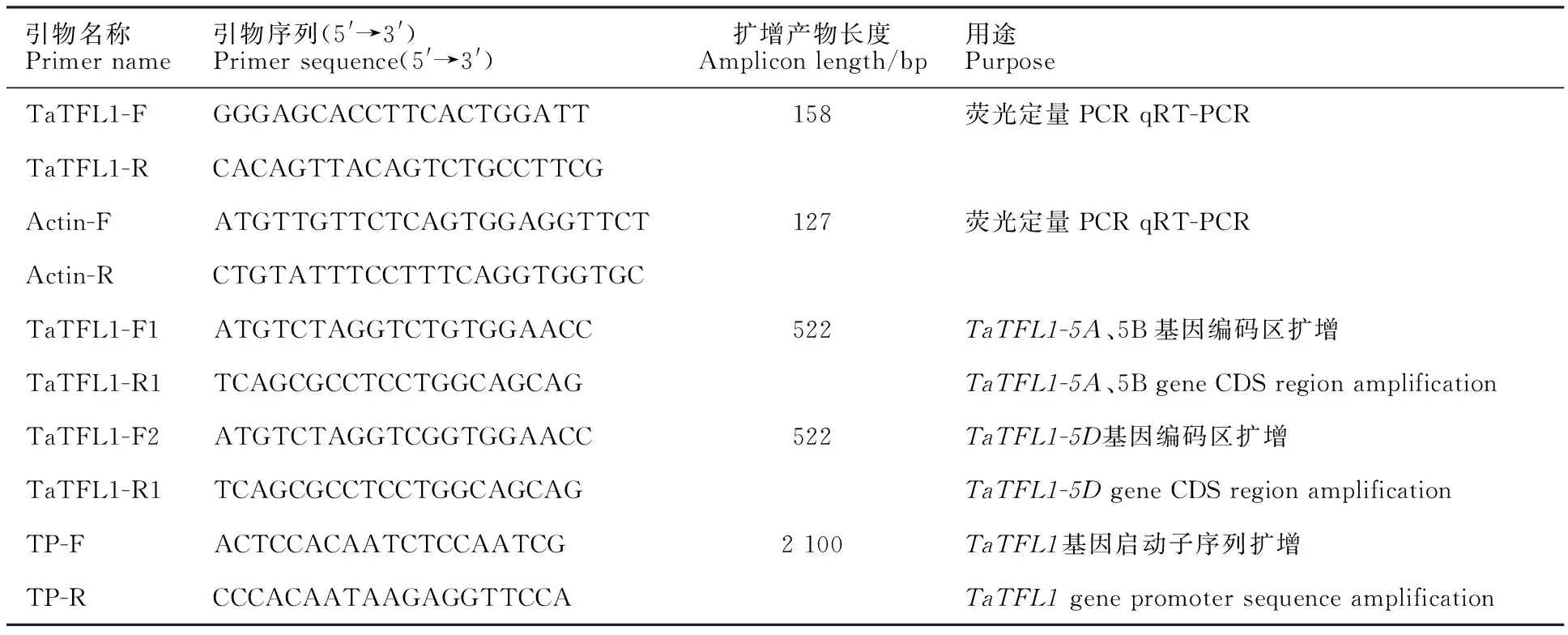
表1 本研究所用的引物信息Table 1 Primers used in this study
2 結果與分析
2.1 中國春 TaTFL1基因的獲得及序列特征的初步分析
通過在NCBI中搜索 TFL1基因,獲得了擬南芥 TFL1基因的mRNA,將此序列在Ensembl plants中與小麥基因組序列進行比對,獲得5AL、5BL和5DL上的 TaTFL1基因。以中國春的gDNA和cDNA為模板,同樣以 TaTFL1-F1/ TaTFL1-R1和 TaTFL1-F2/ TaTFL1-R2為引物進行擴增,分別從gDNA和cDNA中擴增得到1 200 bp和520 bp左右的目的條帶(圖1A)。

M:Trans 2K DNA marker;1: TaTFL1-5A和 TaTFL1-5B cDNA擴增產物; 2: TaTFL1-5D cDNA擴增產物; 3: TaTFL1-5A和 TaTFL1-5B gDNA擴增產物; 4: TaTFL1-5D gDNA擴增產物; 5: TaTFL1啟動子擴增產物M:Trans 2K DNA marker; 1:The amplicon of TaTFL1-5A and TaTFL1-5B from cDNA; 2:The amplicon of TaTFL1-5D from cDNA; 3:The amplicon of TaTFL1-5A and TaTFL1-5B from gDNA; 4:The amplicon of TaTFL1-5D from gDNA; 5:The amplicon of TaTFL1 promoter.
將本研究中所獲得的3條序列分別命名為 TaTFL1-5A、 TaTFL1-5B和 TaTFL1-5D,并提交至NCBI數據庫,得到的序列登錄號分別為MF805802.1、MF805803.1和MF805804.1。GSDS預測結果表明, TaTFL1-5A、 TaTFL1-5B和 TaTFL1-5D與其他物種的 TFL1同源基因都具有4個外顯子和3個內含子,三者之間只在第一外顯子和第二外顯子處存在少量的堿基數量差異。將 TaTFL1-5A、 TaTFL1-5B和 TaTFL1-5D的CDS序列及其預測的蛋白質進行相互比對發現彼此之間只存在個別堿基的差異,且大部分堿基差異并未引起氨基酸的改變,除了第190位的堿基差異使與之對應的第64位氨基酸殘基在TaTFL1-5D蛋白中表現為M(甲硫氨酸)而TaTFL1-5A與TaTFL1-5B為L(亮氨酸)(圖2B)。
2.2 TaTFL1基因編碼蛋白的生物信息學分析
利用NCBI-ORF Finder對 TaTFL1基因的ORF進行預測,發現 TaTFL1-5A、 TaTFL1-5B和 TaTFL1-5D均含有一個522 bp的ORF,編碼173個氨基酸。使用NCBI-CDD對 TaTFL1基因編碼蛋白的保守結構域進行分析,發現TaTFL1-5A、TaTFL1-5B和TaTFL1-5D都具有典型的BEBP家族結構域(圖3)。由ExPASy-ProtParam預測結果可知, TaTFL1基因編碼蛋白為不穩定蛋白。ExPASy-ProtScale分析結果表明, TaTFL1基因編碼蛋白屬于兼性蛋白。通過CBS-SignalP對TaTFL1蛋白的信號肽進行預測,結果顯示,TaTFL1蛋白不存在信號肽,為非分泌蛋白。Cell-PLoc 2.0的預測結果表明,TaTFL1蛋白定位于細胞質中。通過CBS-Protfun2.2對編碼蛋白進行功能預測,結果顯示,TaTFL1蛋白在轉錄、轉錄調控、免疫應答及生長因子方面的幾率均超過0.5,且行使轉錄調控功能的可能性最大, TaTFL1-5A、TaTFL1-5B和TaTFL1-5D蛋白的幾率分別為0.613、0.613和0.705;三者屬于酶的可能性均達到了0.46~0.47,幾率均大于1.6,表明TaTFL1蛋白可能屬于酶。
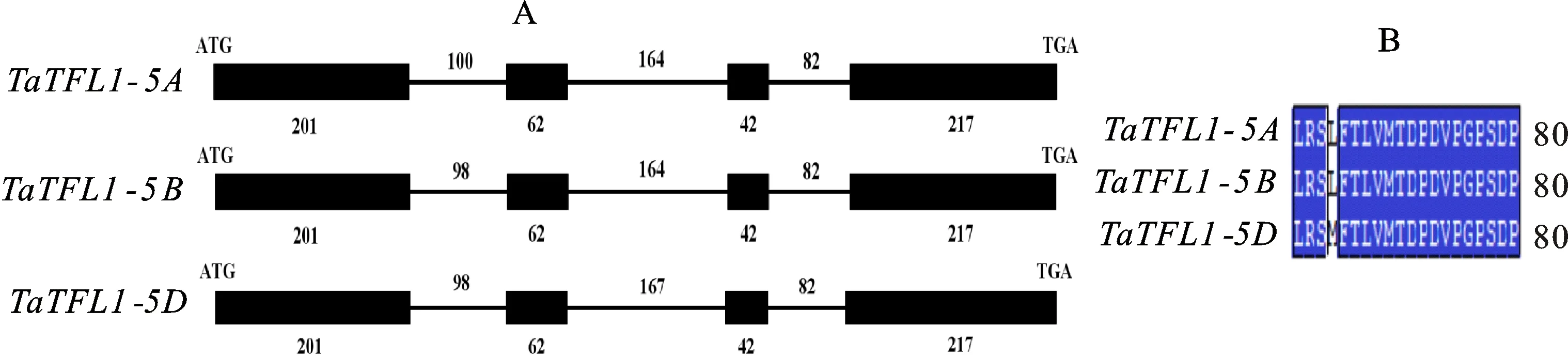
A:ATG 和 TGA分別代表起始密碼子和終止密碼子,黑色方框和直線分別代表外顯子和內含子,數字表示外顯子和內含子的長度(bp)。A:ATG and TGA represent initiation codon and termination codon,respectively. Black box and lines represent exonic and intronic regions,respectively. Numbers indicate the length of exons and introns(bp).
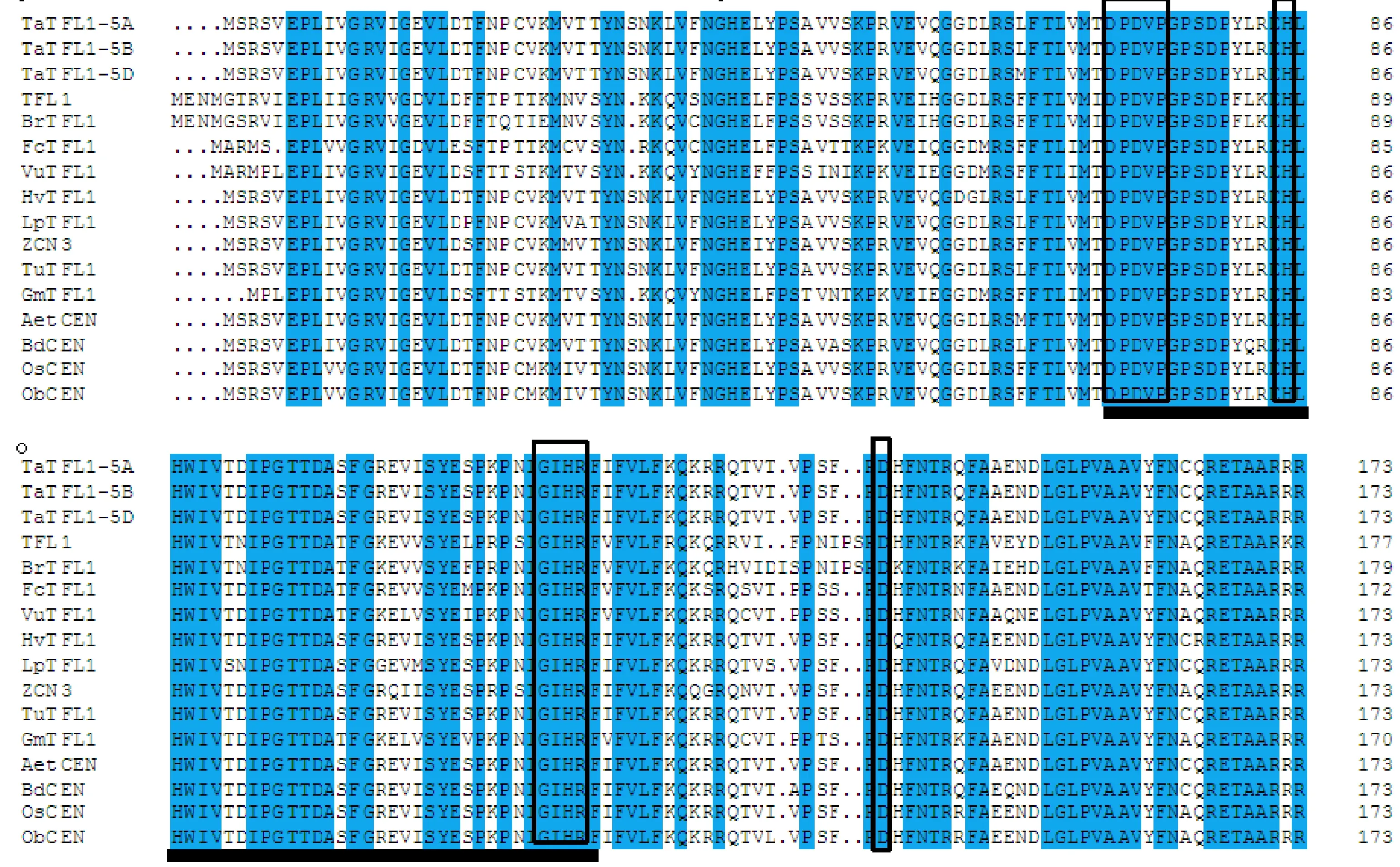
黑色方框代表PEBP家族典型的氨基酸結構和TFL1獨特的氨基酸殘基;黑色粗線條部分為TFL1同源蛋白底物結合保守域;Ta:小麥;Br:蕪菁;Fc:無花果;Vu:豇豆;Hv:大麥;Lp:黑麥草;Tu:烏拉爾圖小麥;Gm:大豆;Aet:山羊草;Bd:二穗短柄草;Os:水稻;Ob:短花藥野生稻;TFL1和ZCN3分別來自擬南芥和玉米。Black box region represents a typical amino acid structure of PEBP gene family and unique amino acid residues of TFL1; the thick black line represents substrate binding conservative domain of TFL1 homologous protein; Ta:Triticum aeativum L.; Br:Brassica rapa; Fc:Ficus carica; Vu:Vigna unguiculate; Hv:Hordeum vulgare subsp; Lp:Lolium prernne; Tu:Triticum urartu; Gm:Glycine max; Aet:Aegilops tauschii; Bd:Brachypodium distachyon; Os:Oryza sativa; Ob:Oryza brachuantha; TFL1 and ZCN3 are derived from Arabidopsis thaliana and Zea mays,respectively.
2.3 TaTFL1蛋白多重比對及進化分析
用DNAMAN 5.0軟件將烏拉爾圖小麥(EMS48180.1)、黑麥草(AAG31808.1)、青稞(ABF85670.1)、玉米(ABX11005.1)、山羊草(XP_020199337.1)、二穗短柄草(XP_003578901.1)、水稻(XP_015617887.1 )、短花藥野生稻(XP_006662737.1)等植物的TFL1同源蛋白與TaTFL1-5A(ATI23645.1)、 TaTFL1-5B(ATI23646.1)、 TaTFL1-5D(ATI23647.1)蛋白進行多重比對(圖3)。從圖3中可以看出,TaTFL1蛋白與其他物種的TFL1同源蛋白均具有PEBP家族典型的氨基酸結構:如70~74殘基間的D-P-D-V-P模塊及116~119之間的G-I-H-R模塊,而且還具有TFL1亞家族獨特的His88和Asp144殘基,此結果進一步證實所獲得的 TaTFL1基因序列的正確性。TaTFL1蛋白與其他單子葉植物的TFL1同源蛋白進行比對,其相似度為91.9%~100%,其中TaTFL1-5A和TaTFL1-5B蛋白與烏拉爾圖小麥的同源蛋白一致, TaTFL1-5D蛋白與山羊草的一致,該結果表明,TFL1蛋白在單子葉植物中具有高度的保守性。而與雙子葉植物比對的相似度也達到了69.27%~79.19%,可知TFL1蛋白在單子葉和雙子葉中存在較大的差異。
利用MEGA 6.0軟件,采用NJ法構建進化樹,對TFL1蛋白在各物種中的進化關系進行了分析,結果(圖4)表明,單子葉與雙子葉植物的TFL1同源蛋白分別聚為兩類,本研究得到的TaTFL1蛋白與烏拉爾圖小麥和山羊草的親緣關系最近,而與大豆和豇豆的親緣關系最遠。
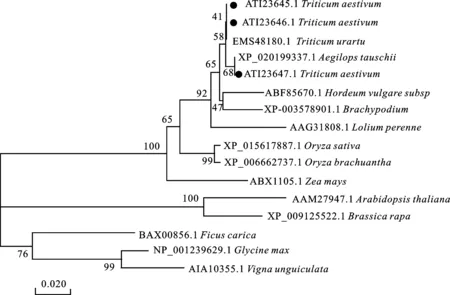
●代表本研究中 TaTFL1基因的編碼蛋白。● indicates the deduced proteins of three TaTFL1 genes obtained in this study.
2.4 啟動子的克隆及預測分析
以CS的gDNA為模板,以TP-F/TP-R為引物克隆得到 TaTFL1基因的上游序列,電泳結果如圖1B所示。測序結果表明,共獲得三類序列,進一步與Ensembl plants數據庫比對,確認其分別為 TaTFL1-5A、 TaTFL1-5B和 TaTFL1-5D的上游序列。對啟動子區進行預測,發現起始密碼子上游1 200 bp的序列為啟動子區。利用PlantCARE分析其中的順式作用元件,結果發現這三個部分同源基因啟動子的順式作用元件組成完全一致,均含有多種參與光響應的元件,如AE-box、AT1-motif、Box 4、G-Box、G-box、Gap-box和sp1等元件,同時還含有與分生組織表達相關的順式調控元件(CAT-box)、MYB轉錄因子結合位點(MBS)、赤霉素響應元件(P-box)、及與節律調控有關的順式調控元件(circadian)(圖5)。

圖5 TaTFL1-5A、 TaTFL1-5B和 TaTFL1-5D啟動子序列比對及其預測的元件分析
2.5 TaTFL1基因在中國春不同組織及不同時期的表達分析
不同組織中 TaTFL1的表達分析表明, TaTFL1在不同組織不同時期均有表達,但表達量存在差異。相對于其他組織,穗下莖中的表達量最高,且隨著植株的逐漸發育,其表達量呈下降趨勢(圖6A)。在葉片中, TaTFL1有較低水平的表達,在剛萌發的芽中就開始表達,在幼苗期和花前時期葉片中的表達量明顯高于花后灌漿期的表達量(圖6B)。而在幼穗中,其表達量僅次于穗下莖中的表達量,隨著幼穗的逐漸生長,其表達量逐漸降低(圖6C)。穎殼中 TaTFL1的表達量無論在花期還是在花后都始終維持在很低的水平(圖6D)。籽粒中的表達量總體較低,且隨著籽粒的逐漸成熟而有明顯的下降趨勢(圖6D),在幼根中也有低水平的表達(數據未列出)。由此可知, TaTFL1在小麥中的表達具有明顯的組織特異性,且主要在開花前期的幼穗與穗下莖中表達。
3 討 論
本試驗對TaTFL1蛋白的功能進行預測,結果表明該蛋白行使轉錄調控功能的可能性最大,而前人的研究結果也表明了該基因具有轉錄調控功能。擬南芥和其他植物中的 TFL1基因過表達導致了營養生長延長,次級花序的增加,以及轉基因擬南芥的開花延遲[15-19]。如在水稻中,過表達水稻的 TFL1同源基因導致水稻穗分枝增加,開花數是野生型的3倍,小穗排列更緊密,同時也引起了植株營養生長期延長,說明水稻中也存在著對 TFL1功能的響應途徑[4];將黑麥草 LpTFL1轉入擬南芥中過表達,植株開花明顯延遲,側分枝大量增加[9];將玉米的 ZCN1到 ZCN6過表達,發現同源性越高則表型表現得越強烈,能導致玉米晚花,花序的分枝大量增加[20];然而,將大麥 HvTFL1轉入水稻中,其轉化植株并未在開花時間和穗部結構發生改變,推測是大麥與水稻可能有著不同的開花途徑[21]。由此可知, TFL1及其同源基因的功能在許多植物中是保守的,因此我們推測小麥中 TaTFL1可能也在維持花序分生組織狀態和抑制開花的功能上存在相似性。
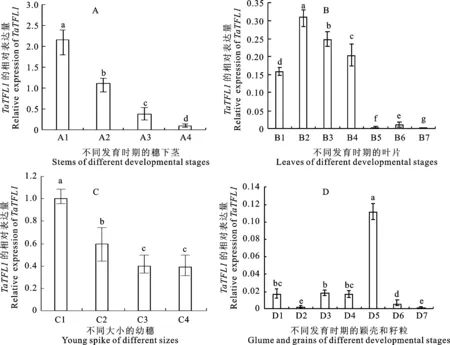
圖柱上不同字母表示差異顯著(P<0.05)。Different lower-case letters above bars indicate significant difference at 0.05 level.A1:花前;A2:花后5天;A3:花后10天;A4:花后15天;B1:芽;B2:萌發5天的葉;B3:萌發10天的葉;B4:花前的旗葉;B5:花后5天的旗葉;B6:花后10天的旗葉;B7:花后15天的旗葉;C1:1~2 cm幼穗;C2:2~4 cm幼穗;C3:4~5 cm幼穗;C4:5~6 cm幼穗。D1:花前的穎殼;D2:花后5天的穎殼;D3:花后10天的穎殼;D4:花后15天的穎殼;D5:花后5天的籽粒;D6:花后10天的籽粒;D7:花后15天的籽粒。A1:Pre-anthesis; A2:5 days after flowering;A3:10 days after flowering;A4:15 days after flowering; B1:Bud; B2:Leaf at 5 days after germination;B3:Leaf at 10 days after germination; B4:Flag leaf pre-anthesis; B5:Flag leaf at 5 days after flowering; B6:Flag leaf at 10 days after flowering;B7:Flag leaf at 15 days after flowering;C1:1-2 cm young spike; C2:2-4 cm young spike; C3:4-5 cm young spike;C4:5-6 cm young spike;D1:Glume pre-anthesis; D2:Glume at 5 days after flowering; D3:Glume at 10 days after flowering; D4:Glume at 15 days after flowering; D5:Grain at 5 days after flowering; D6:Grain at 10 days after flowering; D7:Grain at 15 days after flowering.
本研究克隆得到小麥第五同源群上的 TaTFL1部分同源基因,并測定 TaTFL1在不同組織不同時期的表達水平。結果發現小麥 TaTFL1-5A、 TaTFL1-5B和 TaTFL1-5D部分同源基因與擬南芥中 TFL1基因結構相同,同樣由4個外顯子和3個內含子組成[22]。本研究獲得的3個 TaTFL1部分同源基因的CDS序列只存在較少的堿基差異,其預測的蛋白質表現為 TaTFL1-5A與TaTFL1-5B蛋白完全一致,而TaTFL1-5D與前者只在第64位氨基酸殘基存在差異。本研究獲得的3條 TaTFL1基因所編碼蛋白的第88位氨基酸殘基皆為His,且還具有TFL1家族典型的氨基酸結構,有研究表明TFL1蛋白的His88對其結構與活性具有至關重要的作用[19,23]。
TFL1基因雖然與FT基因的同源性較高,但兩者的表達模式具有明顯的差異。FT基因在葉片中的轉錄水平最高,其翻譯的蛋白質作為成花素,從葉片中由韌皮部轉運到莖頂端分生組織處,活化花分生組織特性基因的表達,從而促進開花;而 TFL1基因在頂端分生組織中的表達量最高[24]。在本試驗中,小麥 TaTFL1在葉片中的表達量極低,結果與黑麥草[9]等相同,而與甘蔗[25]在頂端周圍葉片中大量表達不同。Ratcliffe等[26]的研究結果表明,過表達 TFL1基因的擬南芥植株能產生更好的種子,也有人認為擬南芥中 TFL1能引起胚乳細胞化從而控制籽粒的大小。而在本試驗中, TaTFL1在籽粒中的表達量較低,且隨著籽粒的逐漸成熟而呈現出下降趨勢,說明小麥 TaTFL1與擬南芥中 TFL1在籽粒發育中發揮的作用可能存在差異。為了明晰 TaTFL1是否參與了小麥幼穗的發育,本研究分析了 TaTFL1基因在不同大小幼穗中的表達情況,分析結果表明該基因在幼穗中的表達量較高,且隨著幼穗的逐漸長大而表現出下降的趨勢,推測小麥 TaTFL1基因主要在小麥幼穗發育初期起作用,該結果與擬南芥[27]、黑麥草[9]等植物中的研究結果相同,而且 TaTFL1啟動子元件分析結果也表明其啟動子中存在著分生組織表達相關的順式調控元件(CAT-box)。本試驗還發現 TaTFL1在穗下莖中大量表達,這與玉米中 ZCN1、ZCN2和 ZCN3在維管束中大量存在可能類似,具體原因還有待進一步的研究[20]。

