大豆GmWRKY148的克隆與功能分析
王莎莎,崔曉霞,黃顏眾,軒慧冬,郭娜,邢邯
?
大豆的克隆與功能分析
王莎莎,崔曉霞,黃顏眾,軒慧冬,郭娜,邢邯
(南京農業大學農學院/國家大豆改良中心/農業部大豆生物學與遺傳育種重點實驗室/作物遺傳與種質創新國家重點實驗室,南京 210095)
【目的】WRKY轉錄因子與植物的生物和非生物脅迫應答密切相關。通過對大豆WRKY轉錄因子基因的克隆及在大豆發狀根中過表達后對疫霉根腐病抗性的分析,探究大豆與大豆疫霉菌互作的作用機理。【方法】以擬南芥的序列為探針,利用同源克隆的方法在大豆Williams 82的根部組織中得到其同源基因,命名為。對GmWRKY148蛋白進行系統進化樹分析;利用qRT-PCR方法分析該基因在大豆的根、莖、葉、子葉和接種大豆疫霉菌不同時間點的轉錄水平;利用雙酶切的方法將完整的CDS序列連接到植物過表達載體pBinGFP2中,利用基因槍法將重組質粒轉化到洋蔥表皮細胞中,進行亞細胞定位分析。利用發根農桿菌K599介導的遺傳轉化體系,經過GFP熒光篩選和qRT-PCR檢測,獲得大豆過表達的陽性發狀根(OE-)和轉入pBinGFP2空載體(EV)的陰性對照發狀根。對過表達發狀根和陰性對照發狀根接種大豆疫霉菌,統計病斑長度、疫霉積累量和卵孢子萌發情況。【結果】的CDS序列全長為999 bp,編碼332個氨基酸,等電點為7.61。系統進化分析發現,GmWRKY148與菜豆()、蒺藜苜蓿()的WRKY轉錄因子親緣關系十分相近,且與菜豆的親緣關系最近。亞細胞定位結果顯示,GmWRKY148定位在細胞核中。組織表達分析顯示,在根中的表達量最高,在莖和葉中次之,在子葉中最低。熒光定量PCR結果表明,接種大豆疫霉菌P6497后,在感病品種Williams和抗病品種Williams 82(含有)中,受誘導逐漸上調表達,在侵染24 h后表達水平均達到最高,但在Williams 82中的上調倍數更高。對過表達和轉空載體的大豆陽性發狀根分別接種大豆疫霉菌P6497的菌絲塊,比較接種24 h后的病斑長度和疫霉積累量,結果顯示,與對照EV相比,過表達大豆陽性發狀根的病斑長度顯著變短,疫霉積累量顯著降低。對過表達和EV的大豆陽性發狀根分別接種疫霉菌P6497的游動孢子,并在接種后24、36和48 h用顯微鏡觀察菌絲的侵染及卵孢子萌發數量,統計結果顯示,過表達的大豆陽性發狀根與對照EV相比,菌絲的侵染率及卵孢子萌發率均顯著降低。【結論】參與調控大豆與大豆疫霉的互作,能夠增強大豆對大豆疫霉菌的抗性。
大豆;;大豆疫霉根腐病;抗性
0 引言
【研究意義】大豆疫霉菌()引起的大豆疫霉根腐病(,PRR)是一種毀滅性的土傳病害,在全球范圍內均有發生,造成巨大的產量和經濟損失[1]。WRKY轉錄因子在植物生長發育和逆境脅迫方面有著十分重要的作用[2]。因此,研究在大豆疫霉根腐病抗性方面的功能,對于大豆抗病分子育種有重大意義。【前人研究進展】WRKY蛋白能夠與抗病相關基因啟動子的W-box結合,激活下游抗病基因的表達,從而開啟植物的抗病防衛系統[3-6]。WRKY轉錄因子的下游靶標基因和上游調節基因之間的相互作用構成了復雜的WRKY轉錄因子調控網絡[7]。Han等[8]研究發現,在擬南芥中,AtWRKY44蛋白可以與TOE1(的一個靶標蛋白)進行互作,--可能通過糖信號通路來調節擬南芥的干旱脅迫。絲裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信號級聯存在于所有真核生物中,并在ABA參與的防御反應的下游信號傳導中起作用[9-10]。Li等[11]研究發現擬南芥和是MAPK介導的對病原體抗性通路的重要組成部分。的同源基因在擬南芥葉片中的瞬時表達,可以增強其對細菌和真菌病原體的抗性。Danquah等[12]研究表明水稻通過MAPK磷酸化級聯反應能夠增強水稻的抗旱性。WRKY轉錄因子也參與植物激素信號轉導。Jiang等[13]研究表明SA可誘導楊樹過表達,從而加速PR蛋白的表達,提高對楊樹黑斑病的抗性。Zhang等[14]發現在冷應激處理后,過表達黃瓜的轉基因擬南芥在冷脅迫處理時具有較高的幼苗存活率,且種子萌發期間對ABA具有較高的敏感性。各種非生物脅迫,包括熱脅迫、氧化應激、干旱和營養缺乏會對植物的生理和生化過程產生不利影響[15-16]。在擬南芥中,過表達棉花可上調與衰老相關的基因、和的表達,有助于轉基因擬南芥植株延遲葉子的衰老[17]。Wu等[18]通過對過表達水稻的轉基因株系進行熱處理,轉基因株系表現出顯著的高溫耐受性,如葉子萎蔫的更慢、受損部位更小。He等[19]研究發現小麥轉基因株系的耐熱性與野生型相比明顯增強。Jia等[20]發現過表達棉花植株在干旱和鹽脅迫條件下,對氧化應激的耐受性降低,這與活性氧(reactive oxygen species,ROS)的積累、酶活性的降低、MDA含量的升高以及ROS相關基因表達的改變相關。在抵御生物脅迫方面,WRKY轉錄因子的大多數功能已經明確,但調控機理的研究還不夠充分。在大麥()中白粉病病原菌()的無毒基因所編碼的效應因子能夠激活大麥的CC-NBS-LRR類抗病蛋白HvMLA10。HvMLA10與HvWRKY1互作,解除HvWRKY1對HvMYB6的抑制,從而啟動防衛反應[21]。擬南芥轉錄因子又稱為RRS1,除WRKY結構域外,還包含TIR(toll and interleukin-1 receptor)、NBS和LRR結構域,介導擬南芥對病原菌青枯病菌()的抗病性[22]。Cheng等[23]研究證明是水稻抗稻瘟病正調控因子。Wang等[24]研究證明在小麥高溫苗木(HTSP)抗條銹菌()的過程中可能激活了SA和ET信號通路。【本研究切入點】關于大豆WRKY基因家族己有一些報道,但WRKY基因對大豆疫霉根腐病抗性的研究鮮有報道。【擬解決的關鍵問題】本研究擬從大豆中克隆出的CDS全長序列,對其進行組織表達分析和大豆疫霉菌誘導表達分析,利用發根農桿菌介導的遺傳轉化體系獲得大豆發狀根,對過表達的大豆陽性發狀根的抗病性進行鑒定,為進一步探究大豆與大豆疫霉菌互作過程的作用機理提供理論依據。
1 材料與方法
試驗于2017年3月至2018年3月在南京農業大學農學院完成。
1.1 試驗材料
大豆栽培品種Williams和Williams 82由南京農業大學國家大豆改良中心提供。大豆疫霉菌P6497和P6497R(攜帶有RFP),由南京農業大學植物保護學院王源超教授提供。植物表達載體pBinGFP2由植物保護學院竇道龍教授提供。發根農桿菌菌株K599由南京農業大學農學院邢邯教授實驗室保存。
1.2 誘導處理
采用根部接種的方法進行疫霉菌誘導處理。將大豆Williams和Williams 82的種子播種于恒溫25℃、16 h/8 h光周期的光照培養箱中。待其生長至兩片真葉完全展開時,在根莖交界處劃一個約1 cm的傷口。用培養4—5 d的大豆疫霉菌P6497對傷口進行接種。分別在接種后0、6、12和24 h取傷口上下2 cm長的根部組織,液氮速凍并于-80℃保存。
1.3 實時熒光定量PCR分析
利用植物總RNA提取試劑盒(DP419,TIANGEN)提取大豆各組織的總RNA,并反轉錄獲得cDNA。根據基因序列設計qPCR引物,作為內參基因。使用SYBR Green Master Mix(Q111-02,Vazyme)試劑進行實時熒光定量PCR,利用2-ΔΔCT方法計算相對表達量,并用GraphPad prism 5軟件作圖。
1.4 基因克隆及過表達載體構建
提取大豆Williams 82根部組織的RNA,反轉錄得到cDNA。以此為模板進行PCR擴增,獲得目的基因,與pEASY-Blunt載體連接、鑒定,用于構建pBinGFP2過表達載體。
1.5 亞細胞定位
提取質粒,濃縮使其濃度≥1 000 ng·μL-1。洋蔥內表皮擺放于MS培養基上,暗培養4 h。通過基因槍技術將包裹了重組質粒的球狀金粉轉入洋蔥表皮細胞,之后暗培養16—20 h,用激光共聚焦顯微鏡進行觀察。
1.6 大豆發狀根的獲得
1.6.1 電擊轉化農桿菌K599感受態細胞 100 μl K599感受態加1.5 μl質粒裝入冰浴的電擊杯中,電擊轉化。加入1 ml YEP培養基,菌液擴培4—6 h。4 500 r/min,2 min離心,棄上清,吸取50 μl涂在YEP加抗生素(YEP+RIF+Kan)的固體培養基上,2 d后挑單克隆,并進行PCR驗證。
1.6.2 發根農桿菌介導的遺傳轉化 將20 μl-加入4 ml(YEP+RIF+Kan)液體培養基中,28℃振蕩培養,12—16 h后涂板。挑選顆粒飽滿無破損的大豆Willams用氯氣消毒。把滅菌的大豆種臍向下種于GM固體培養基中(一皿25—35個),過夜,使大豆充分吸脹。
將農桿菌加入CCM液體培養基中,充分混勻,測OD值(0.6—1.0)。將吸脹的大豆(沿培根對半剖開)浸入菌液中,90 r/min振蕩30 min。然后暗培養4—5 d,放入white培養基中繼續生長,獲得大豆發狀根。
1.7 大豆轉基因發狀根抗性的鑒定
將培養約3周齡的大豆轉基因發狀根在熒光體視顯微鏡下進行熒光篩選,對有綠色熒光的大豆轉基因發狀根進行標記,并擴培。大豆疫霉2號生理小種P6497,在V8固體培養基上培養4 d后進行接種(電子附圖1)。切取約3 mm×3 mm的大豆疫霉菌絲塊,接種于陽性大豆根毛伸長區,侵染24 h后,利用游標卡尺測量病斑長度。
游動孢子接種(電子附圖2):選擇新鮮的大豆疫霉菌P6497,于25℃黑暗條件下過夜(約10 h)培養,誘導產生游動孢子。帶有熒光的大豆轉基因發狀根放入10 ml離心管中,加入游動孢子過濾液,25℃黑暗培養,接種后24、36和48 h取樣。
大豆轉基因發狀根的侵染及侵染水平分析:將經過GFP熒光篩選后得到的陽性大豆轉基因發狀根(電子附圖3)接種大豆疫霉菌P6497,于24、36和48 h后取樣,利用熒光體視顯微鏡(OLYMPUS MVX10,JAPAN)觀察游動孢子對陽性大豆發狀根的侵染以及卵孢子的萌發情況,并計數。利用qRT-PCR方法檢測疫霉的相對積累量(引物序列見電子附表1),以疫霉內參基因與大豆內參基因相對表達量的比值來衡量。
1.8 GmWRKY148蛋白進化樹分析
用GmWRKY148的氨基酸序列在NCBI進行BLAST比對,下載同源性高的蛋白質序列,保存為fasta格式。先用Clustal X軟件進行多重序列比對,再利用MEGA 7.0軟件進行進化樹作圖。
2 結果
2.1 GmWRKY148蛋白進化樹分析
利用MEGA 7.0軟件對GmWRKY148與其他植物的WRKY氨基酸序列構建系統進化樹(圖1)。結果表明,GmWRKY148蛋白屬于大豆WRKY轉錄因子家族基因,與苜蓿()、菜豆()等植物親緣關系十分相近。
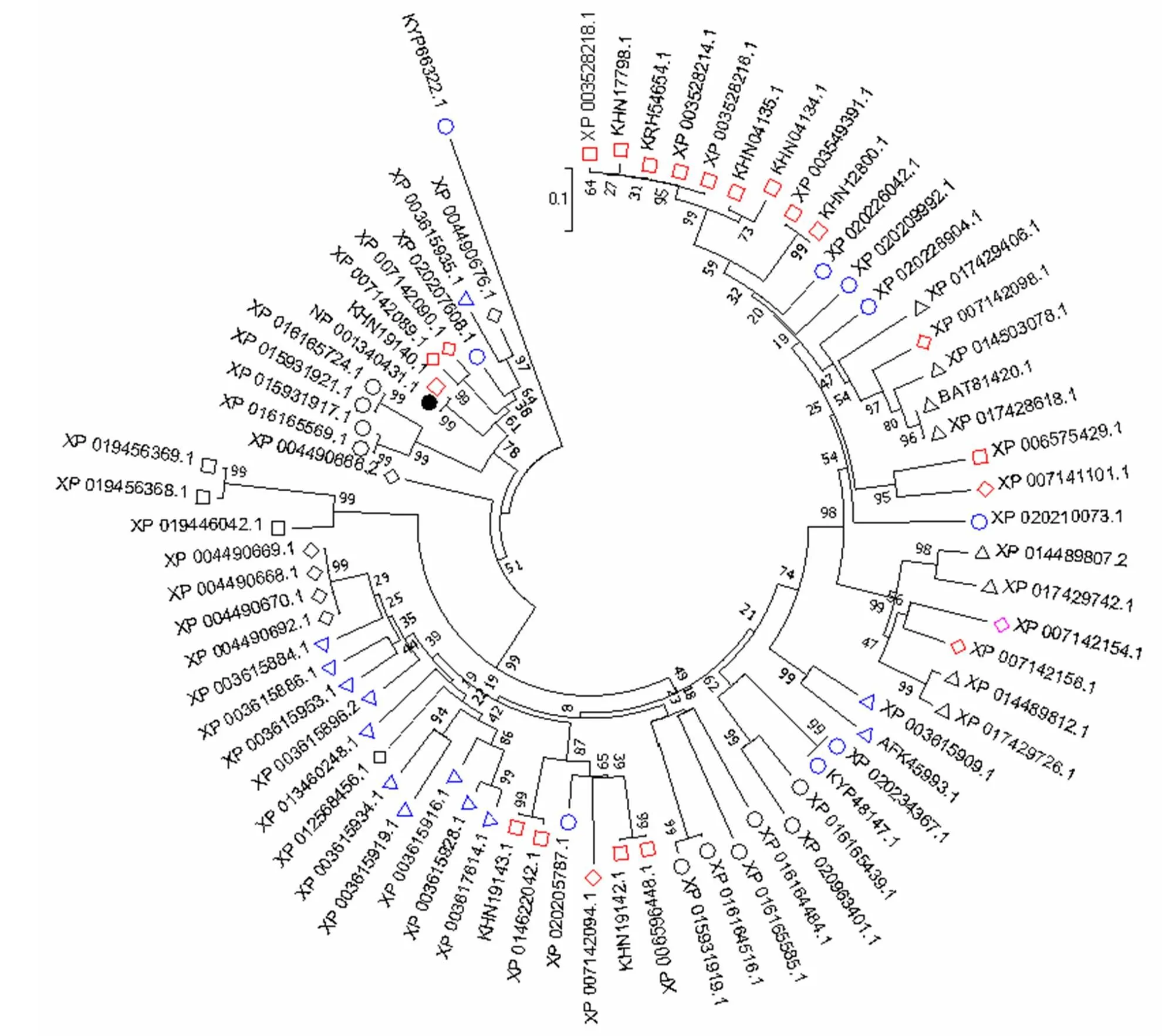
:大豆Glycine max;:苜蓿Medicago truncatula;:菜豆Phaseolus vulgaris;:木豆Cajanus cajan;:鷹嘴豆Cicer arietinum;:羽扇豆Lupinus angustifolius;:GmWRKY148;:花生Arachis ipaensis;:赤豆Vigna angularis
2.2 GmWRKY148的表達分析
2.2.1的組織表達分析 從Williams 82的根中克隆得到,利用熒光定量PCR方法,分析大豆在根、莖、葉和子葉中的表達量(圖2)。結果表明,在大豆的根中的表達量最高,在莖和葉中次之,在子葉中的表達量最低。
2.2.2的誘導表達分析 利用熒光定量PCR分析大豆Williams和Williams 82(含有)根部接種疫霉菌后的轉錄水平。在感病品種Williams中,的表達量在接種后12 h開始上調,在24 h達到最大值,大約是接種前的10倍(圖3-A)。在抗病品種Williams 82中,的表達在接種后6 h顯著上調,12 h下調表達,之后在接種后24 h再次上調,達到最大值(圖3-B)。從圖中可以看出,在抗病品種Williams 82中的相對表達量顯著高于感病品種Williams,推測可能參與大豆對疫霉菌的響應。
2.3 GmWRKY148蛋白的亞細胞定位
利用基因槍法將-重組質粒轉化到洋蔥表皮細胞中,暗培養16—20 h,用激光共聚焦熒光顯微鏡觀察綠色熒光蛋白的分布。結果顯示,在轉化空載體的洋蔥表皮細胞中,細胞膜、細胞質以及細胞核中均有綠色熒光分布,而在轉化重組質粒的洋蔥表皮細胞中,綠色熒光主要分布于細胞核部位(圖4)。表明GmWRKY148是一個核定位蛋白。
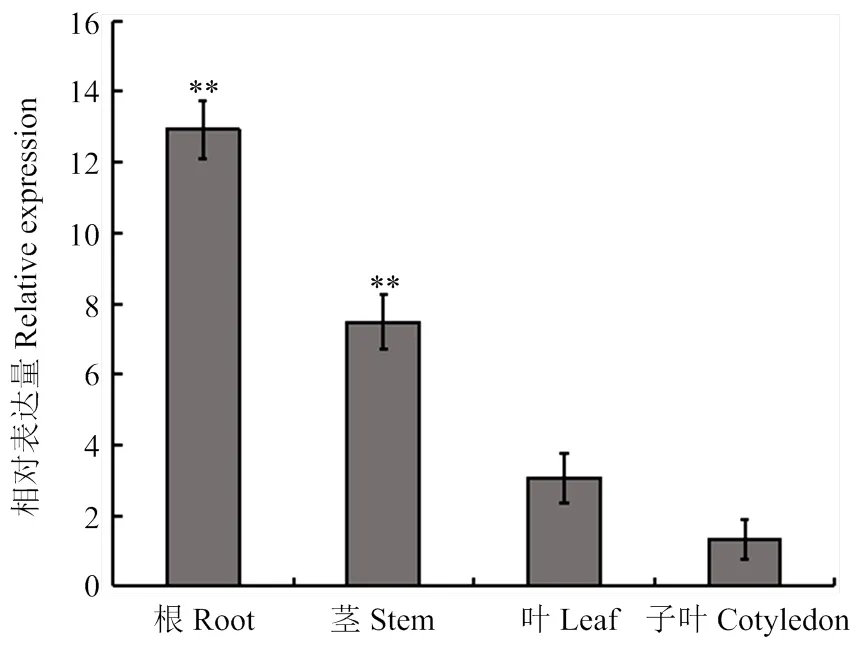
**表示在P < 0.01水平差異極顯著。下同
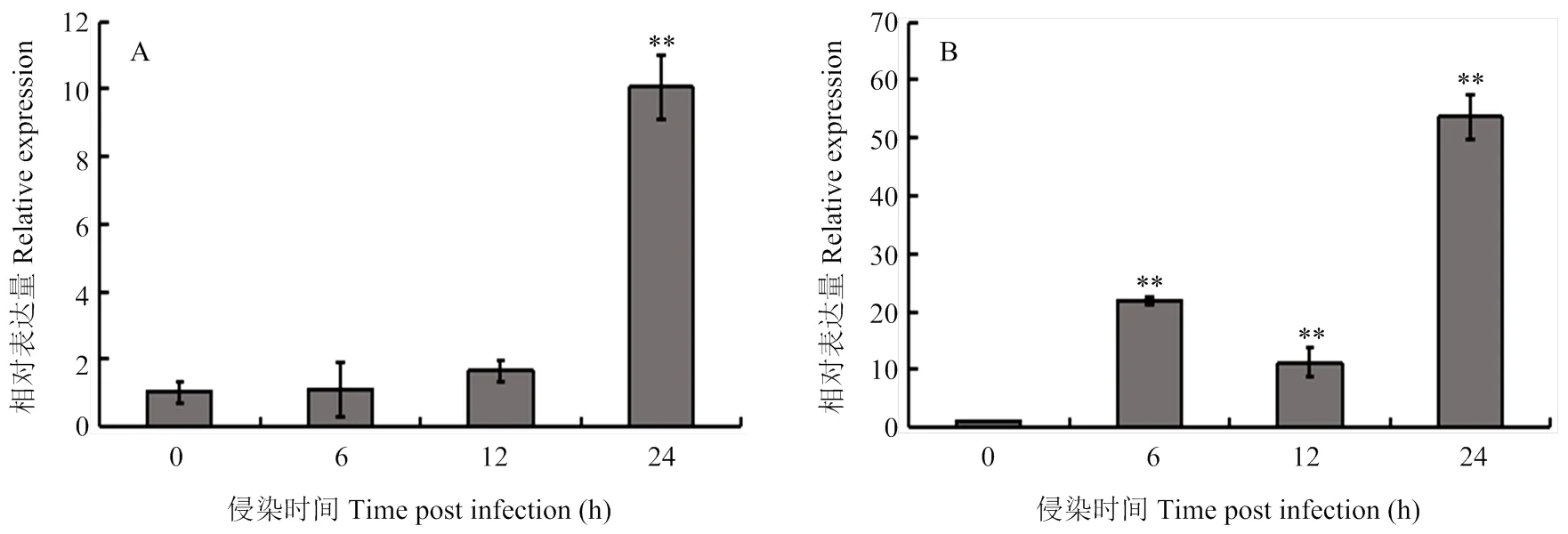
A:疫霉誘導下大豆栽培品種Williams中GmWRKY148的表達模式。B:疫霉誘導下大豆栽培品種Williams 82中GmWRKY148的表達模式
2.4 OE-GmWRKY148大豆發狀根的獲得
為了探究在大豆對大豆疫霉菌抗性中的功能,將在大豆發狀根中進行過表達分析,并利用熒光體視顯微鏡進行初步篩選(圖5),將陽性大豆發狀根在White培養基上擴大培養。為了進一步檢測的上調表達倍數,將分別擴培的過表達(OE-)和轉pBinGFP2空載體(EV)的大豆發狀根提取RNA,檢測的表達情況(圖6),與空載體對照相比,其上調表達倍數達到4—6倍,可用于后續的功能研究。
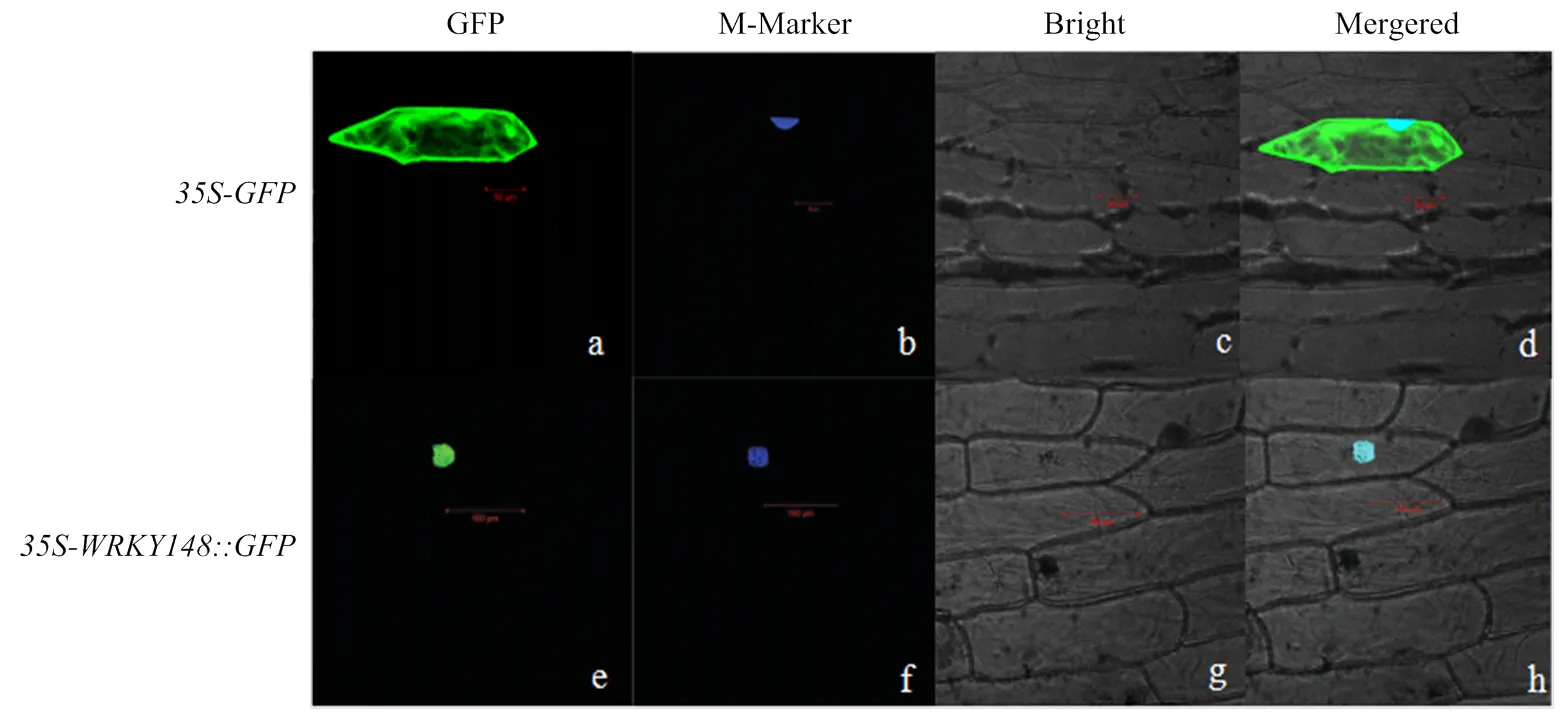
a、b、c、d:35S-GFP定位;e、f、g、h:35S-WRKY148::GFP融合蛋白定位
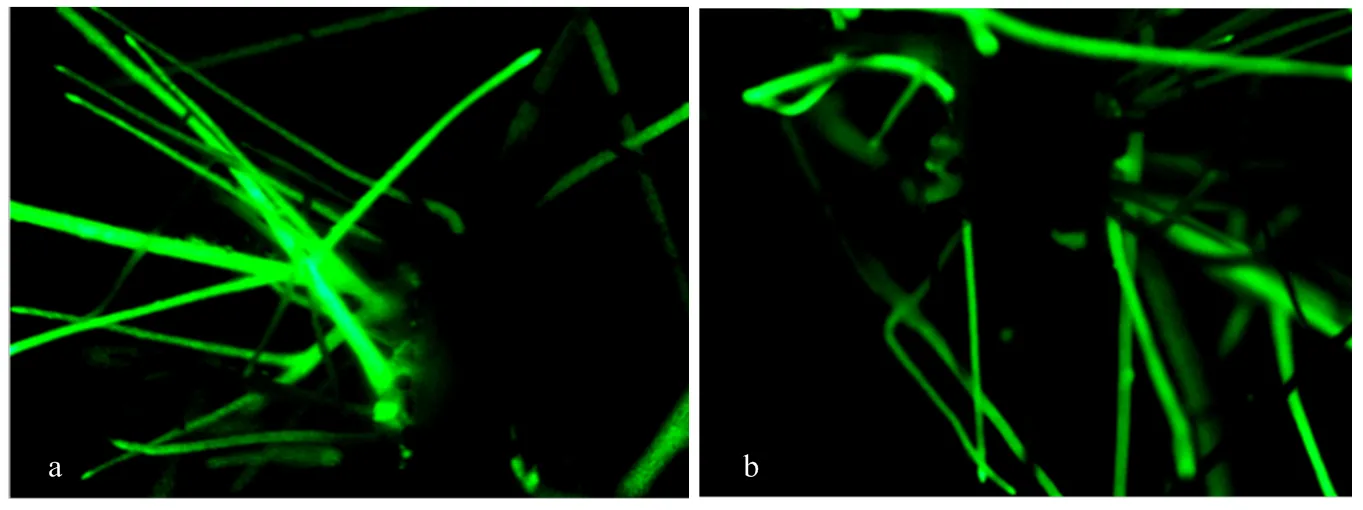
a:GFP轉化大豆Williams的發狀根。b:過表達GmWRKY148的大豆Williams發狀根
2.5 GmWRKY148可提高大豆對大豆疫霉菌的抗性
在大豆Williams中過表達,獲得OE-大豆發狀根。同時將空載體pBinGFP2轉入大豆Williams作為對照。通過GFP熒光篩選得到陽性大豆發狀根,在陽性大豆發狀根上接種新鮮的大豆疫霉P6497菌絲塊,24 h后觀察接種部位病斑擴展情況。病斑長度統計結果顯示,過表達的大豆轉基因發狀根(W-OE-W148)接種大豆疫霉菌P6497后的病斑長度明顯比Williams空載體對照(W-EV)短(圖7-A、圖7-B、圖7-C)。
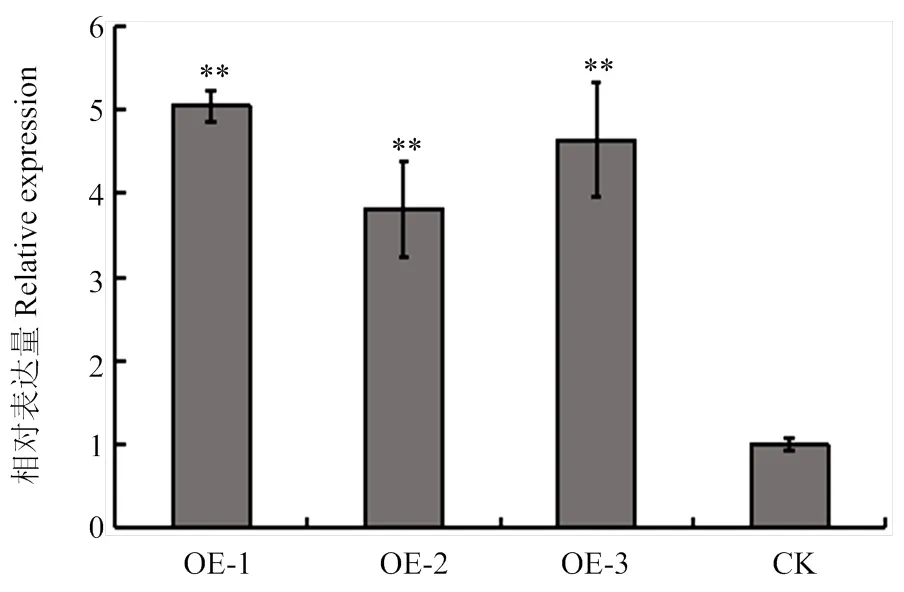
圖6 Williams陽性發狀根的上調表達倍數檢測
將過表達的大豆Williams陽性發狀根與對照在white培養基上擴大培養,選取根尖長勢一致的大豆轉基因發狀根接種大豆疫霉游動孢子,結果顯示,過表達的大豆發狀根中的疫霉累積量明顯低于空載體對照(圖7-D)。綜上所述,過表達使Williams對大豆疫霉菌P6497的抗性增強。
2.6 OE-GmWRKY148的大豆發狀根和對照中菌絲的侵染及卵孢子的萌發情況
利用熒光體視顯微鏡觀察大豆轉基因發狀根中菌絲的侵染及卵孢子的萌發情況(圖8)。接種后24 h,對照EV大豆轉基因發狀根有35%被侵染,15%產生了卵孢子;而OE-的大豆發狀根只有15%被侵染,且沒有萌發的卵孢子。接種后36 h,對照EV大豆發狀根,有65%被侵染,30%的大豆轉基因發狀根能觀察到萌發的卵孢子;而對于OE-的大豆發狀根,僅有25%被侵染,10%的陽性大豆發狀根能夠觀察到萌發的卵孢子。接種后48 h,對照EV大豆發狀根80% 被侵染,60%能觀察到萌發的卵孢子;而OE-的大豆發狀根僅有45%被侵染,20%的陽性大豆發狀根能夠觀察到萌發的卵孢子(電子附表2)。接種大豆疫霉菌P6497的游動孢子24、 36和48 h后,OE-的大豆Williams發狀根與對照EV相比,侵染率以及卵孢子萌發率都較低。綜上所述,過表達能夠顯著提高大豆對大豆疫霉菌的抗性。

A:轉pBinGFP2空載體的Williams病斑表型。B:過表達GmWRKY148的Williams病斑表型。C:疫霉菌P6497侵染大豆發狀根24 h后,大豆Williams中空載對照和OE-GmWRKY148發狀根病斑長度統計。D:P6497游動孢子接種后24和36 h,過表達GmWRKY148的大豆Williams發狀根和對照中疫霉相對生物積累量的分析
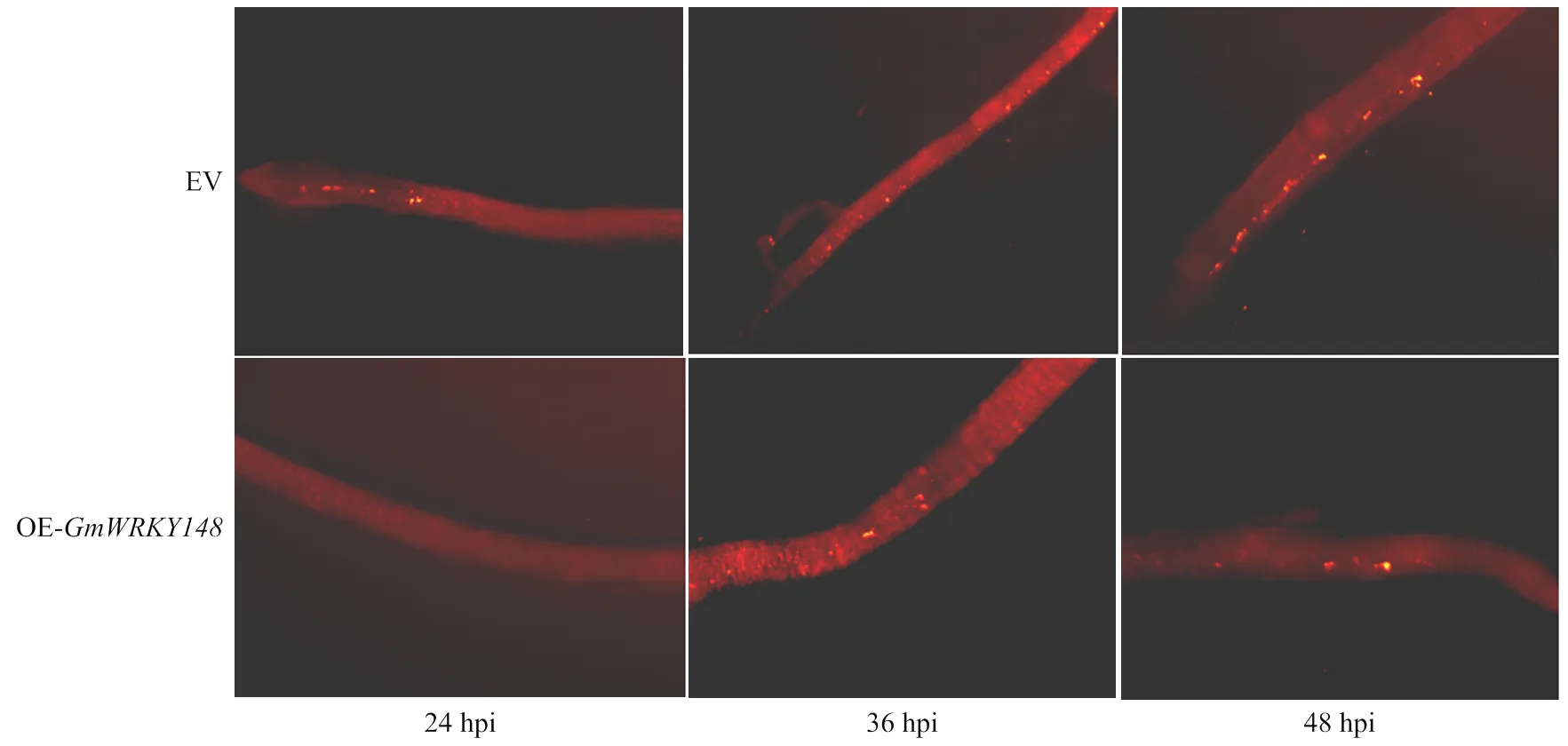
圖8 大豆Williams發狀根中疫霉侵染的顯微觀察
3 討論
大豆疫霉菌(Kaufmann & Gerdemann)可在條件適宜時侵染大豆,有多個生理小種,難以防治[25]。YANG等[26]研究表明采用多種防治措施相結合的綜合防治技術是根本有效的防治途徑,其中應用抗病品種防治大豆疫霉根腐病最為有效。本研究使用大豆疫霉菌P6497以及感病品種Williams和攜帶-的抗病品種Williams 82作為試驗材料。陶愷[27]研究發現大豆疫霉菌侵入后擴展階段,絕大多數休止孢在接種后6 h已經成功入侵寄主。在抗病品種Williams 82和感病品種Williams中的表達情況存在差異(圖3),接種后6 h在Williams 82 中該基因上調表達倍數更高,說明受到大豆疫霉菌P6497的誘導,很有可能與大豆抵御大豆疫霉的侵染過程有關。為了進一步研究在大豆抗疫霉菌侵染中的功能,將其在大豆Williams進行過表達。Moy等[28]研究表明大豆疫霉菌在侵染初期以菌絲體形式擴展定殖,在12-24 h形成病斑,因此選擇在侵染后24 h測量病斑長度。轉OE-的大豆Williams發狀根與對照EV的大豆Williams發狀根相比病斑長度明顯變短(圖7-A、圖7-B、圖7-C)。
大豆疫霉是典型的土傳卵菌,卵孢子能夠在土壤中存活數年,成為次年病害發生的初侵染源[29-30]。Sinclair[31]發現卵孢子萌發后,產生孢子囊繼而釋放出游動孢子是病害能夠發生的必要條件。Hardham等[32-33]研究證明游動孢子感知寄主信號,聚集形成休止孢,同時分泌粘性物質讓休止孢粘在寄主根的表面,進而萌發芽管,芽管直接通過細胞間隙和根的垂周壁直接侵入寄主或形成附著孢侵入寄主。張鑫[34]研究發現大部分致病疫霉等的孢子囊可以脫落并直接作為侵染源,而另外一些則不能脫落,以游動孢子為侵染源,如大豆疫霉。綜上所述,卵孢子的萌發情況與游動孢子的數量是大豆疫霉根腐病發生的重要指標。
為了研究在大豆疫霉根腐病中的功能將OE-的陽性大豆發狀根浸入大豆疫霉游動孢子液中,24、36和48 h取樣進行觀察。大豆疫霉游動孢子接種大豆發狀根后,轉OE-的大豆Williams發狀根與對照EV相比,疫霉的積累量在接種后24和36 h,都顯著低于對照EV(圖7-D)。游動孢子侵染發狀根24、36和48 h后,轉OE-的大豆Williams發狀根與對照相比,侵染率以及卵孢子萌發率都較低(圖8、電子附表2)。以上結果表明,轉OE-的大豆發狀根對大豆疫霉的抗性明顯增強,過表達能夠提高Williams對大豆疫霉菌的抗性。但是的調控機制還有待于更進一步研究。
4 結論
克隆獲得,其CDS為999 bp。在Williams和Williams 82中受疫霉誘導產生表達差異,過表達可以提高大豆品種Williams對大豆疫霉菌P6497的抗性。
[1] 張寶強. 大豆對大豆疫霉根腐病的抗源篩選及抗性遺傳分析[D]. 南京: 南京農業大學, 2010.
Zhang B Q. Studies on screening for resistance source and genetic analysis toin soybean [D]. Nanjing: Nanjing agricultural university, 2010. (in Chinese)
[2] Li D, Liu P, Yu J, DOSSA K, ZHANG Y, ZHOU R, WEI X, ZHANG X. Genome-wide analysis of WRKY gene family in the sesame genome and identification of the WRKY genes involved in responses to abiotic stresses., 2017, 17(1): 152.
[3] Rushton P J, Torres J T, Parniske M, WERNERT P, HAHIBROCK K, SOMSSICH I E. Interaction of elicitor-induced DNA-binding proteins with elicitor response elements in the promoters of parsley PR1 genes., 1996, 15(20): 5690-5700.
[4] Rocher A, Dumas C, Cock J M. A W-box is required for full expression of the SA-responsive geneSFR2., 2005, 344(1): 181-192.
[5] Kim C Y, Zhang S. Activation of a mitogen-activated protein kinase cascade induces WRKY family of transcription factors and defense genes in tobacco., 2004, 38(1): 142-151.
[6] Pandey S P, Somssich I E. The role of WRKY transcription factors in plant immunity., 2009, 150(4): 1648-1655.
[7] Banerjee A, Roychoudhury A. WRKY proteins: signaling and regulation of expression during abiotic stress responses., 2015, 2015(807560): 807560.
[8] Han Y, Zhang X, Wang Y, MING F. Correction: The suppression of WRKY44 by GIGANTEA- miR172 pathway is involved in drought response of., 2015, 10(4): e0124854.
[9] Zelicourt A D, Colcombet J, Hirt H. The role of MAPK modules and ABA during abiotic stress signaling., 2016, 21(8): 677-685.
[10] Asai T, Tena G, Plotnikova J, WILLMANN M R, CHIU W L, LOURDES G G, BOLLER T, AUSUBEL F M, SHEEN J. MAP kinase signalling cascade ininnate immunity., 2002, 415(6875): 977-983.
[11] Li Y, Williams B, Dickman M.B-cell lymphoma 2 (Bcl-2)-associated athano gene 7(BAG7)-mediated heat tolerance requires translocation, sumoylation and binding to WRKY29., 2016, 214(2): 695-705.
[12] Danquah A, De A Z, Colcombet J, HIRT H. The role of ABA and MAPK signaling pathways in plant abiotic stress responses., 2014, 32(1): 40.
[13] Jiang Y, Liang G, Yang S, YU D.WRKY57 functions as a node of convergence for jasmonic-acid and auxin- mediated signaling in jasmonic acid-induced leaf senescence., 2014, 26(1): 230-245.
[14] Zhang Y, Yu H, Yang X, LI Q, LING J, WANG H, GU X, HUANG S, JIANG W. CsWRKY46, a WRKY transcription factor from cucumber, confers cold resistance in transgenic-plant by regulating a set of cold-stress responsive genes in an ABA-dependent manner., 2016, 108: 478.
[15] Joshi R, Wani S H, Singh B, BOHRA A, DAR Z A, LONE A A, PAREE K A, SINGLA-PAREEK S L. Transcription factors and plants response to drought stress: Current understanding and future directions., 2016, 7(e102529): 1029.
[16] Ohama N, Sato H, Shinozaki K, YAMAGUCHI-SHINOZAKI K. Transcriptional regulatory network of plant heat stress response., 2017, 22(1): 53-65.
[17] Gu L, Li L, Wei H, WANG H, SU J, GUO Y, YU S. Identification of the group IIa WRKY subfamily and the functional analysis of GhWRKY17 in upland cotton (L.)., 2018, 13(1): e0191681.
[18] Wu X, Shiroto Y, Kishitani S, ITO Y, TORIYAMA K. Enhanced heat and drought tolerance in transgenic rice seedlings overexpressing OsWRKY11 under the control of HSP101 promoter., 2009, 28(1): 21-30.
[19] He G H, Xu J Y, Wang Y X, LIU J M, LI P S, CHEN M, MA Y Z, XU Z S. Drought-responsive WRKY transcription factor genes TaWRKY1, and TaWRKY33, from wheat confer drought and/or heat resistance in., 2016, 16(1): 116.
[20] Jia H, Wang C, Wang F, LIU S, LI G, GUO X. GhWRKY68 reduces resistance to salt and drought in transgenic., 2015, 10(3): e0120646.
[21] Chang C, Yu D, Jiao J, JING S, SCHULZE-LEFERT P, SHEN Q H. Barley MLA immune receptors directly interfere with antagonistically acting transcription factors to initiate disease resistance signaling., 2013, 25(3): 1158-1173.
[22] Deslandes L, Olivier J, Theulieres F, HIRSCH J, FENG D X, BITTNER-EDDY P, BEYON J, MARCO Y. Resistance toinis conferred by the recessive RRS1-R gene, a member of a novel family of resistance genes., 2002, 99(4): 2404-2409.
[23] 成洪濤, 王石平. 水稻-病原互作中的重要角色: WRKY類轉錄因子. 中國科學: 生命科學, 2014(8): 784-793.
Cheng H T, Wang S P. WRKY- type transcription factors: a significant factor in rice- pathogen interactions., 2014, 44(8): 784-793.(in Chinese)
[24] Wang J, Tao F, An F, ZOU Y P, TIAN W, CHEN X M, XU X M, HU X P. Wheat transcription factor TaWRKY70 is positively involved in high-temperature seedling-plant resistance tof. sp.., 2017, 18(5): 649-661.
[25] Sugimoto T, Watanabe K, Yoshida S, BIGGS A R. Field application of calcium to reduce Phytophthora stem rot of soybean, and calcium distribution in plants., 2010, 94(7): 812-819.
[26] 楊曉賀, 張瑜, 顧鑫, 趙海紅, 姚亮亮, 劉偉, 申宏波, 丁俊杰. 大豆疫霉根腐病的綜合防治. 大豆科學, 2014, 33(4): 554-558.
Yang X H, Zhang Y, GU X, ZHAO H H, YAO L L, LIU W, SHEN H B, DING J J. Integrated control of soybean phytophthora root rot., 2014, 33(4): 554-558. (in Chinese)
[27] 陶愷. 大豆疫霉侵染過程的分子細胞學研究[D]. 南京: 南京農業大學, 2012.
Tao K. Molecular and cellular biology of interactions betweenand host soybean[D]. Nanjing: Nanjing agricultural university, 2012. (in Chinese)
[28] Moy P, Qutob D, Chapman B P, ATKINSON I, GIJZEN M. Patterns of gene expression upon infection of soybean plants by., 2004, 17(10): 1051-1062.
[29] Duniway J M.Water relations of water molds., 1979, 17(17): 431-460.
[30] Niklaus J G, Wilbert G F. The biology of phytophthora infestans at its center of origin., 2005, 43(43): 171.
[31] Sinclair J B.Compendium of soybean diseases.Urbana- Champaign:, 1982.
[32] Hardham A, Gubler F. Polarity of attachment of zoospores of a root pathogen and pre- alignment of the emerging germ tube., 1990, 14(11): 947- 956.
[33] Hardham A R. The cell biology behind Phytophthora pathogenicity., 2001, 30(2): 91-98.
[34] 張鑫. 大豆疫霉G蛋白α亞基調控游動孢子趨化性的機制研究[D]. 南京: 南京農業大學, 2015.
Zhang X. Molecular mechanisms ofPsGPA1 in regulation of zoospore chemotaxis to soybean [D]. Nanjing: Nanjing agricultural university, 2015. (in Chinese)
(責任編輯 李莉)
附表1 試驗所用引物序列
Table S1 Primers used in this study

基因Gene引物序列Sequence of primer (5'-3')引物用途Function of primer GmWRKY148F:GCAGCTTCTAACTCTGGCGAGmWRKY148克隆Cloning of GmWRKY148 R:TTTATTATAAGTGATAAGATCTACAAGCAA GmWRKY148-MQF:CGGGGTACCATGCCTTTCCGAAATTCCAATATGA R:CGCGGATCCTCATATTTCATTTGGATATTGAGGA GmWRKY148-2F:ATGCACACAACCCACTTGCTGmWRKY148實時熒光定量PCRqRT-PCR of GmWRKY148 R:CAGATGAAGAGTTTCTCTTC GmEF1βF:GTTGAAAAGCCAGGGGACA疫霉積累量實時熒光定量內參Reference gene in qRT-PCR R:TCTTACCCCTTGAGCGTGG GmActinF:GGTGGTTCTATCTTGGCATC實時熒光定量PCR內參Reference gene in qRT-PCR R:CTTTCGCTTCAATAACCCTA pBinGFP2F:AAGACCCCAACGAGAAGCpBinGFP2載體引物Primer of vector R:GAACCCTAATTCCCTTATCTG
附表2 受疫霉菌絲侵染及產生卵孢子的大豆轉基因發狀根數目統計
Table S2 Summary of the numbers of roots that were successfully infected byor oospores development
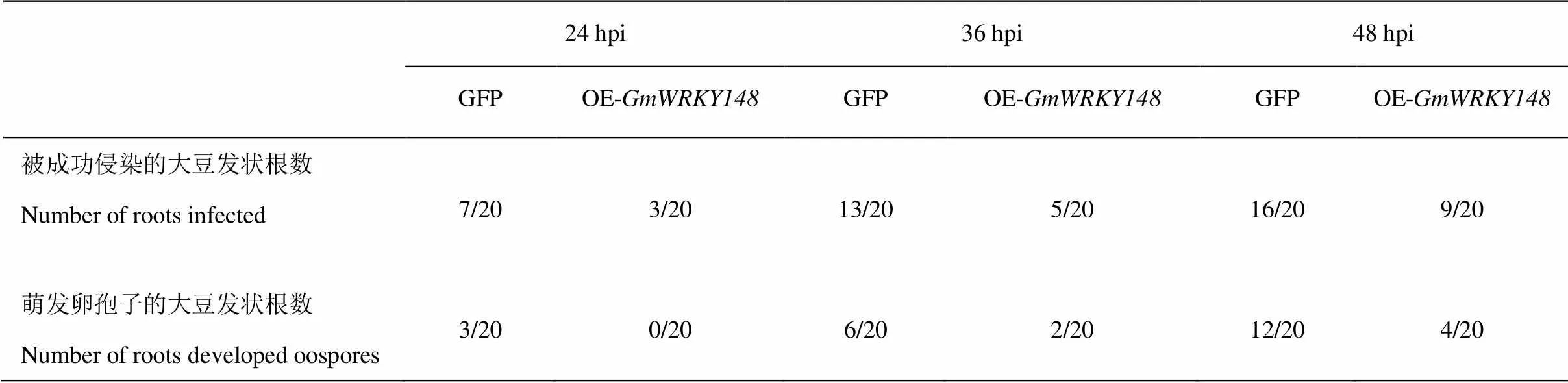
24 hpi36 hpi48 hpi GFPOE-GmWRKY148GFPOE-GmWRKY148GFPOE-GmWRKY148 被成功侵染的大豆發狀根數Number of roots infected7/203/2013/205/2016/209/20 萌發卵孢子的大豆發狀根數Number of roots developed oospores3/200/206/202/2012/204/20
a:新鮮的菌絲邊緣,切成小塊貼于固體V8培養基,進行擴繁。b—f:培養2—6 d時,大豆疫霉菌P6497的生長情況
a: Choose fresh mycelium edges, then cut them into small pieces, to carry on the propagation. b-f:Growth situation of P6497, after 2 to 6 days
圖S1 大豆疫霉菌P6497的培養
Fig. S1 Formation of mycelium of P6497
a:擴繁后4 d,大豆疫霉菌P6497的生長情況。b:取培養4d的大豆疫霉菌邊緣部分,切成碎塊放入液體V8培養基中進行培養。c:滅菌清水充分清洗,誘導產生游動孢子。d:繼續培養10 h后,P6497的生長情況。e:過濾,得到透明的游動孢子液。f:大豆陽性發狀根浸入游動孢子液
a: After 4 days of propagation, the growth situation of P6497. b: Choose fresh mycelium edges, cut them into tiny pieces, then put them into liquid V8 medium. c: Thoroughly clean the debris with sterile water. d: Growth situation of zoospores of P6497, 10h later. e: Strain the liquid through a piece of gauze, in order to get transparent zoospores fluid. f: Put positive soybean hairy roots in to zoospores fluid
圖S2 大豆疫霉菌P6497游動孢子的培養
Fig. S2 Formation of zoospores of P6497
a、b、c:GFP轉化大豆Williams的發狀根。
a, b, c: GFP Williams hairy roots.
d、e、f:過表達GmWRKY148的大豆Williams發狀根
d, e, f : OE-GmWRKY148 Williams hairy roots
圖S3 擴繁的陽性發狀根GFP熒光檢測圖片
Fig. S3 GFP fluorescence in enlarged positive transgenic soybean hairy roots
Cloning and Functional Analysis of the
WANG ShaSha, CUI XiaoXia, HUANG YanZhong, XUAN HuiDong, GUO Na, XING Han
(College of Agriculture, Nanjing Agricultural University/National Center for Soybean Improvement/Key Laboratory for Biology and Genetic Improvement of Soybean (General), Ministry of Agriculture/National Key Laboratory of Crop Genetics and Germplasm Enhancement, Nanjing 210095)
【Objective】WRKY transcription factor is closely related to the biological and abiotic stress responses of plants. In order to study the function of,was cloned and its expression was analyzed, then the gene was over-expressed in soybean hairy roots for analyzing resistance to.【Method】Based on the sequence of, the homologous genewas obtained from the root tissue of soybean Williams 82 by method of homologous cloning, named. Phylogenetic analysis was performed. The transcriptional level ofunder four tissues andinfection was analyzed by qRT-PCR. For subcellular localization analysis, the recombinant plasmid pBinGFP2-was constructed, and transformed into onion epidermal cells by gene gun method. Transgenic soybean hairy roots were obtained by using-mediated method. The transgenic over-expressing hairy roots and empty-vector hairy roots were obtained by GFP fluorescence screening and qRT-PCR. To confirm whetheris involved in the interaction between soybean and, the positive soybean hairy roots were inoculated by P6497, and measured the lesions length, accumulation ofand the germination of oospores.【Result】The CDS ofis 999 bp, encoding 332 amino acids, and the isoelectric point is 7.61. Phylogenetic analysis indicated that the WRKYs fromandwere highly similar to GmWRKY148. Subcellular localization results showed that GmWRKY148 was located in the nucleus. Tissues expression analysis showed thathad the highest expression in roots, followed in stems and leaves, and lowest in cotyledons. qRT-PCR analysis showed that the expression level ofwas up-regulated upon infection byboth in resistant variety Williams 82 (containing the) and susceptible variety Williams, which has the highest expression at 24 h post infection. The transcript ofis higher in Williams 82 than that in Williams. Transgenic over-expressing hairy roots (OE-) and empty-vector hairy roots (EV) were inoculated withP6497 mycelium blocks, the lesions length and the accumulation ofwere compared after 24 h inoculation. The lesion length in OE-soybean hairy roots was significantly shorter than that in the EV, and the accumulation ofwas significantly reduced. The rate of mycelial infection and zoospores germination was observed by microscopy at 24, 36 and 48 h after inoculated withzoosporesCompared to the control EV, the rate of mycelia infection and zoospores germination of over-expressingsoybean hairy roots was significantly decreased.【Conclusion】is a positive regulator in the interaction between soybean and.
;;; resistance
10.3864/j.issn.0578-1752.2018.18.002
2018-04-11;
2018-06-19
國家重點研發計劃(2017YFD0101500)、轉基因生物新品種培育重大專項(2016ZX08004002-005)、大豆現代產業技術體系(CARS-004-PS10)、長江學者和創新團隊發展計劃資助(PCSIRT_17R55)、江蘇省現代作物生產協同創新中心資助
王莎莎,E-mail:2015101138@njau.edu.cn。通信作者邢邯,E-mail:hanx@njau.edu.cn

