嬰兒腸道菌群中乳酸菌的 分離鑒定及其多樣性分析
周彥宏,李虹甫,陳思涵,林官根,劉昕宇,滿朝新,徐紅華,姜毓君
(東北農業大學食品學院,黑龍江哈爾濱 150030)
早期腸道菌群的定植很大程度上影響人體成年后的腸道菌群結構,而嬰兒時期為腸道菌群定植的關鍵時期[1-2]。乳酸菌作為早期腸道菌群的主要組成部分,其多樣性及豐度與嬰兒腸道健康狀況密切相關[3]。除生產及喂養方式外,早期抗生素干預一定程度上也會影響早期嬰兒腸道菌群結構[4-6]。抗生素在攻擊有害菌群時,包括乳酸菌在內的一些有益菌群也會遭受影響,且會促使某些細菌抗性基因的表達[7]。
傳統培養方法可對腸道中獲得的單一細菌菌株進行培養,有助于全面、完整地研究該種細菌的功能和不同生長條件下的生理活性[8]。應用傳統培養方法分離腸道菌群,不僅有助于揭示腸道細菌對營養成分的利用情況和細菌之間的相互作用,且分離得到的乳酸菌菌株,可作為今后人源益生菌菌株篩選的潛在資源。但傳統培養方法也仍存在很多的局限性與不足之處。除絕大多數腸道菌群不可培養外,體外培養體系也很難完全模擬微生物在腸道中自然生長繁殖的條件。隨著以16S rDNA為基礎的分子生物學發展,一些不依賴于培養的技術被應用于腸道菌群的研究,如Real time-PCR、DGGE、FISH和以Illumina高通量測序技術為首的第二代測序技術[9-12]。盡管這些方法可一定程度上提供更豐富的腸道菌群結構信息,但其費用高且耗時,有些研究手段只能檢測出一定豐度上或處于低等分類學水平的菌群。基于PacBio Sequel平臺的單分子實時測序技術,能夠彌補上述核酸檢測技術的缺陷,可對16S rDNA全長進行測序,更準確探究腸道菌群多樣性和實現種水平上的深度分類[13]。然而,僅基于核苷酸序列的三代測序技術準確率稍低,不能分辨糞便樣品中的死活菌,且無法獲得單一菌株進行后續生理生化及功能特性分析。因此,將傳統培養方法與三代測序技術相結合,不僅可獲得單一純化的乳酸菌,也可更準確地獲悉腸道糞便樣品中的微生物多樣性。
本文采用傳統培養與單分子實時三代測序技術結合的方法,對中國嬰兒腸道菌群中的乳酸菌進行分離鑒定及多樣性分析,且探究了抗生素對乳酸菌多樣性的影響。通過對嬰兒腸道菌群中乳酸菌的分離及多樣性的探究,為后續人源益生菌發酵產品的開發提供菌種資源,并為嬰兒健康發展提供有效技術支持。
1 材料與方法
1.1 材料與儀器
8份嬰兒腸道糞便樣品 通過問卷調查方式,選取符合實驗要求的8份嬰兒腸道糞便樣品。根據是否在采樣前后4周內接受抗生素治療及抗生素種類分為阿莫西林組(A組,共2份)、美羅培南組(B組,共2份)和健康組(H組,共4份),嬰兒選取標準:母親無慢性基礎疾病(包括糖尿病,類風濕性關節炎或慢性傳染病及心肺疾病)及家族遺傳病,除是否接受抗生素治療外,胎兒胎齡、出生體重、生產及喂養方式等均無明顯差異;MRS固體培養基、MRS肉湯培養基、磷酸鹽緩沖液 天津市瑞金特化學品有限公司;2×Taq PCR MasterMix 北京天根生物技術有限公司;細菌基因組DNA提取試劑盒 北京天根生化科技有限公司;QIAamp DNA Stool Mini Kit 德國QIAGEN公司。
RL-58GSP型低溫采樣箱 北京優冷科技有限公司;YQX-II型厭氧培養箱 上海龍躍儀器設備有限公司;厭氧產氣袋 日本三菱化學有限公司;BXM-30R型高壓蒸汽滅菌鍋 上海博訊實業有限公司醫療設備廠;Bcn1360型生物超凈工作臺 北京東聯哈爾儀器制造;3K-15型高速冷凍離心機 德國Sigma公司;7000 PCR擴增儀 美國Applied Biosystems公司;DYY-10C型電泳儀 北京市六一儀器廠;UVP凝膠成像系統 美國UVP公司;NanoDrop 2000超微量分光光度計 美國Thermo分光光度計公司;XW-80A型渦旋混勻器 上海醫科大學儀器制造廠。
1.2 實驗方法
1.2.1 嬰兒腸道糞便樣品的采集 在嬰兒自然排便后,使用無菌采樣管進行樣品采集,采集過程中均為無菌操作。采集后立即放入低溫采樣箱中速凍,在2 h內送至實驗室,其中一部分立即進行菌株分離,另一部分置于-80 ℃保存,用于糞便樣品總DNA提取。
1.2.2 乳酸菌的分離鑒定 使用預還原的磷酸鹽緩沖液(PBS,pH=7)對糞便樣品進行梯度稀釋。選取10-3~10-6的稀釋倍數,吸取100 μL涂布于MRS平板。將MRS置于厭氧培養箱中,37 ℃培養48~72 h,觀察結果并記錄。依據菌落形態、伯杰氏細菌鑒定手冊和乳酸菌細菌分類鑒定及試驗方法,采用生理生化實驗初步對菌株進行分類學鑒定,包括過氧化氫酶試驗、糖類發酵產酸試驗等[14-15]。隨后,采用細菌組DNA提取試劑盒,按照說明書提取單一純化菌株的總基因組DNA。使用通用引物27F(5′-AGATTTGATCCTGGCTCAG-3′)及1492R(5′-TACGGCTACCTTGTTACGACTT-3′)針對16S rDNA進行PCR擴增,擴增條件如下:94 ℃預變性5 min;94 ℃變性30 s,58 ℃退火30 s,72 ℃延伸1.5 min,30個循環;72 ℃末端延伸7 min。將擴增后的PCR產物送至北京諾賽生物科技有限公司,進行純化及雙向測序,測序后,結果使用Contig Express軟件進行序列拼接。拼接后的序列在NCBI上的BLAST數據庫中進行比對,結合生理生化實驗結果,選取相似度最高的菌種完成菌株鑒定。同時應用MEGA 7.0對乳酸菌16S rDNA序列構建系統發育樹。
1.2.3 糞便總基因組DNA的提取及PCR擴增 采用QIAamp DNA Stool Mini Kit試劑盒提取嬰兒腸道糞便樣品總DNA,具體步驟按照說明書進行操作。使用1.2.2中提到的通用引物進行16S rDNA全長擴增,擴增使用兩步法,第一步擴增條件為:98 ℃預變性2 min;98 ℃變性30 s,50 ℃退火30 s,72 ℃延伸1.5 min,25個循環;72 ℃末端延伸5 min。第二步擴增條件為:98 ℃預變性2 min;98 ℃變性30 s,62 ℃退火30 s,72 ℃延伸1.5 min,25個循環;72 ℃末端延伸5 min。擴增后使用2%的瓊脂糖凝膠電泳檢測擴增產物片段大小,并采用NanoDrop檢測其濃度和純度。
1.2.4 數據分析 在QIIME中調用UCLUST序列比對工具,將測序序列生成相應OTU。根據OTU注釋結果明確嬰兒糞便樣品中乳酸菌多樣性分布。通過分析不同樣品中OTU數據,計算樣品的Alpha多樣性,包括Shannon、Chao1、Simpson、ACE指數等。其中Chao1與ACE指數主要體現群落的豐富度,而Shannon與Simpson指數主要側重群落的均勻度。
2 結果與分析
2.1 乳酸菌的分離及鑒定
2.1.1 乳酸菌的分離及初步鑒定 將收集到的8份不同來源的嬰兒腸道糞便樣品,經由MRS培養基培養后,挑取形態不同的單一菌落進行分離純化。根據生理生化試驗結果和菌落形態,初步確定從糞便樣品中共分離出32株乳酸菌,其中阿莫西林組2株,健康組30株,美羅培南組沒有分離到乳酸菌。
2.1.2 細菌總基因組DNA的提取及擴增 采用細菌基因組DNA提取試劑盒,對分離得到的32株初步鑒定為乳酸菌的菌株進行DNA提取,使用1%的瓊脂糖凝膠電泳進行檢測,DNA提取電泳結果條帶均正常且均一,因此挑選部分分離菌株的結果如圖1所示。分離菌株的DNA條帶在2000 bp以上且無雜帶,說明DNA的提取結果符合后續PCR擴增要求。應用PCR對16S rDNA進行擴增,PCR擴增電泳結果條帶正常且均一,因此挑選部分分離菌株的結果如圖2所示。通過與標準條帶比較,可觀察到條帶均在1500 bp左右,清晰單一且無引物二聚體,表明此PCR產物可用于后續基因測序。
圖1 部分分離菌株DNA提取電泳結果Fig.1 The electrophoresis results of DNA extracted from part of isolated strains注:M為Marker DL2000;1~9為分離菌株基因組DNA。
圖2 部分分離菌株的PCR產物電泳結果Fig.2 The electrophoresis results of PCR products form part of isolated strains注:M為Marker DL2000;1~10為分離菌株PCR產物。
2.1.3 乳酸菌分子生物學鑒定 將提取的乳酸菌菌株DNA經PCR擴增后,送至測序公司測序,采用NCBI上的BLAST數據庫對測序得到的拼接結果進行序列同源性比對,獲取菌株鑒定結果(見表1)。經統計,通過傳統培養方法共分離得到32株乳酸菌,其中L.rhamnosus12株(b1~b12)、E.faecalis6株(a1,a2,b13~b16)、L.gasseri4株(b17~b20)、L.plantarum3株(b21~b23)、L.casei3株(b24~b26)、P.pentosaceus3株(b27~b29)、B.longum1株(b30)。使用MEGA 7.0對分離得到的32株菌株進行系統發育分析,揭示菌株的親緣關系(見圖3)。由系統發育樹可知,所有菌株均聚集在相應參考菌株的分支上,證明鑒定結果正確,且不同樣品分離出的菌株具有一定的同源性。

表1 培養分離的乳酸菌16S rDNA序列BLAST比對結果Table 1 The BLAST comparison results of 16S rDNA sequences of isolated lactic acid bacteria
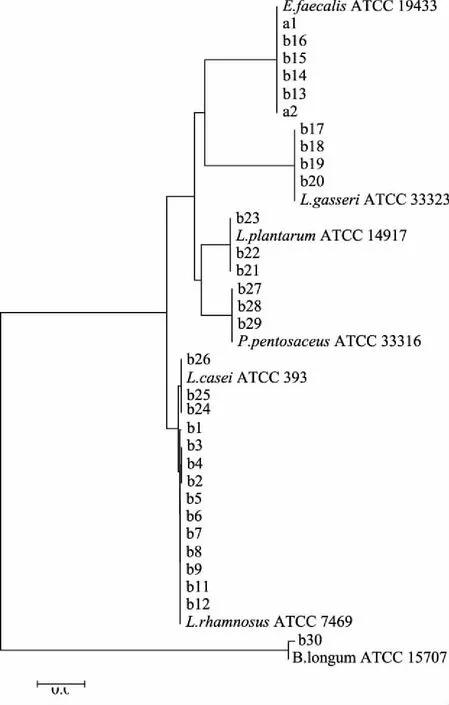
圖3 乳酸菌系統發育樹Fig.3 The phylogenetic tree of lactic acid bacteria
2.2 單分子實時測序
2.2.1 糞便樣品物種豐度及多樣性 利用QIIME軟件,調用USEARCH檢查并剔除嵌合體序列,剔除疑問序列后,對每個糞便樣品的測序量進行統計,得到平均測序量為7863。隨后,使用QIIME調用UCLUST序列比對工具,基于97%的相似水平確定樣品中OTU數量(見圖4)。其中,每個橢圓代表一組糞便樣品,橢圓間的重疊區域表明組間的共有OTU,每個區塊的數字表明該區塊所包含的不同組別的共有或獨有OTU數量。基于不同分類等級的平均OTU數量,整體抗生素組中微生物豐度顯著小于健康組。Alpha多樣性指數包括Chao1、Simpson、Shannon以及ACE指數,其中Chao1與ACE指數側重于體現群落豐富度,而Shannon和Simpson指數側重于體現群落均勻度。Alpha多樣性各項分析指數也表明,除A1外,整體抗生素組的多樣性指數低于健康組(見表2)。采用Mothur軟件,調用Metastats分析對各個分類單元進行差異檢驗,兩組微生物多樣性在屬及種水平上均存在顯著性差異。對所有糞便樣品整體分組所得到的OTU進行物種注釋,結果表明,屬、種水平為最佳分類水平,注釋過程中,將豐度≤1%的屬或種定義為Others(見圖5、圖6)。在屬水平上,健康組中主要以Streptococcus(19%)、Veillonella(18%)為優勢屬;阿莫西林組以Enterococcus(65%)為優勢屬;而美羅培南組主要以Escherichia(92%)為主導且菌屬單一。在種水平上,S.salivarius(18%)、V.parvula(15%)為健康組優勢種;E.faecium(60%)為阿莫西林組優勢種;E.fergusonii(91%)為美羅培南組優勢種。以上物種分布情況說明,抗生素對腸道菌群穩態具有一定程度的破壞性,且不同種類的抗生素影響具有差異性。

圖4 OTU劃分和分類地位鑒定結果Venn圖Fig.4 The OTU division and classification of status Venn diagram
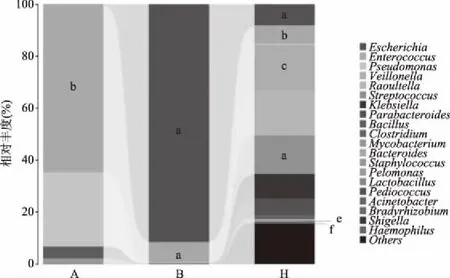
圖5 屬水平微生物群落分布Fig.5 Distribution of gut microbiome at genus level注:乳酸菌及優勢屬均以字母標注:a:Escherichia, b:Enterococcus,c:Veillonella,d:Streptococcus, e:Lactobacillus,f:Pediococcus。

圖6 種水平微生物群落分布Fig.6 Distribution of gut microbiome at species level注:乳酸菌及優勢種均以字母標注:a-E:fergusonii,b-E:faecium, c-V:parvula DSM 2008,d-S:salivarius,e-L:rhamnosus GG,f-P:pentosaceus。
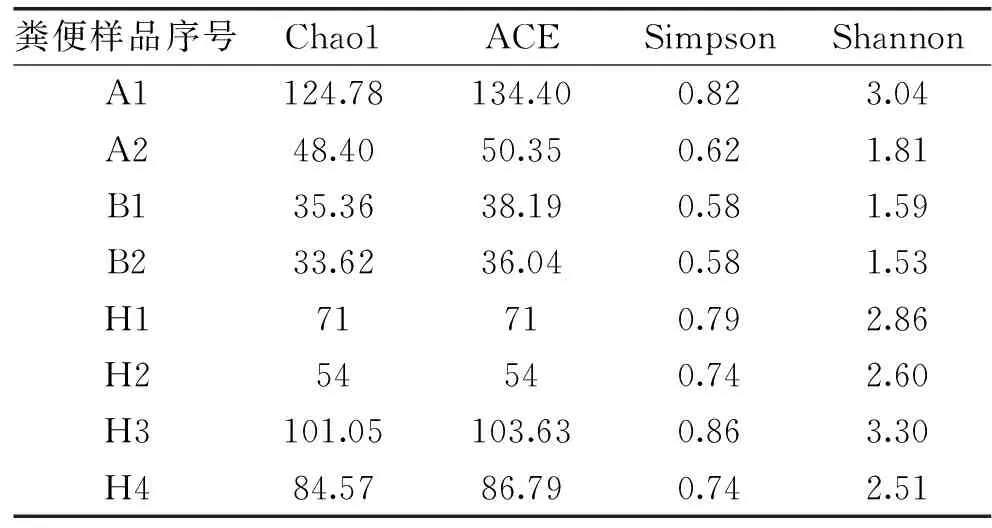
表2 Alpha多樣性指數Table 2 The index of Alpha diversity
2.2.2 乳酸菌種類及分布 根據三代測序結果所示(見表3),阿莫西林組中乳酸菌豐度極小且種類單一,主要為E.faecalis。美羅培南組沒有檢測到乳酸菌。健康組中乳酸菌多樣性較高,但普遍豐度較低(≤1%)且存在個體差異,其中L.rhamnosus為優勢乳酸菌種,L.gasseri普遍存在于健康組腸道菌群中。該結果說明,抗生素的使用會減少嬰兒腸道菌群中乳酸菌的種類,且不同種類抗生素的影響存在差異性。
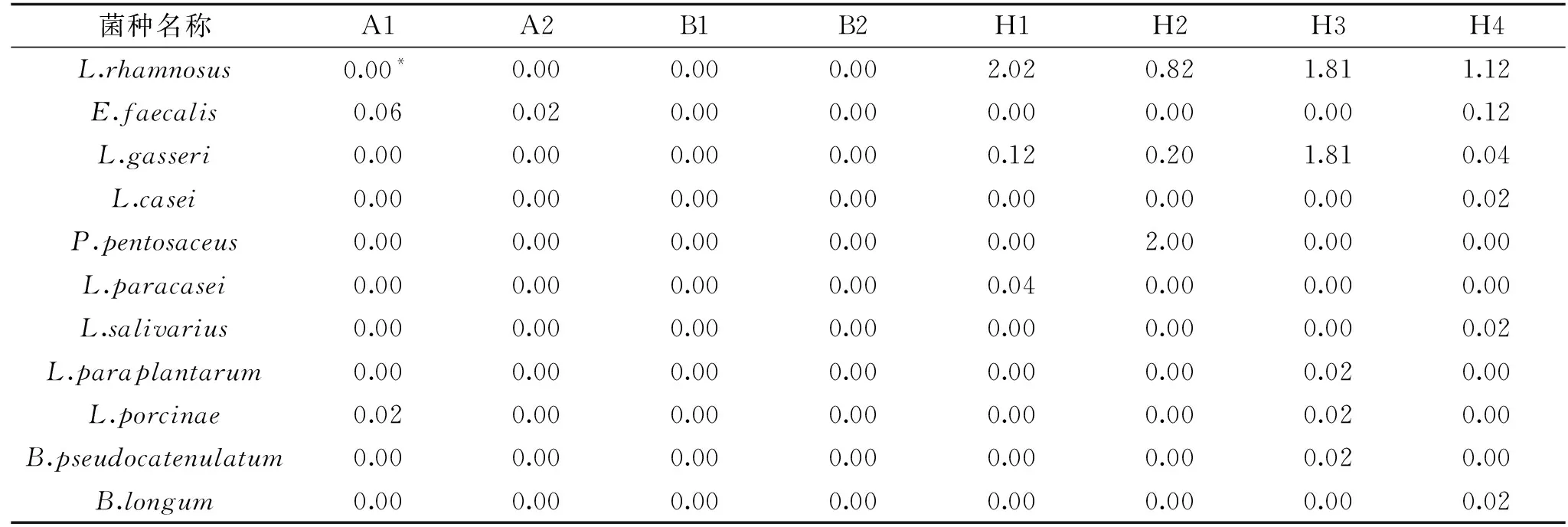
表3 基于高通量測序的糞便樣品中乳酸菌多樣性(以豐度計,%)Table 3 Diversity of lactic acid bacteria in various fecal samples based on high-throughput sequencing(calculated by abundance,%)
3 結論
本文采用傳統培養方法與基于PacBio Sequel平臺的SMRT測序技術相結合的方式,分離鑒定嬰兒腸道菌群中的乳酸菌菌株,并分析嬰兒腸道菌群乳酸菌多樣性及結構,同時探究抗生素使用對乳酸菌多樣性的影響。首先,通過傳統培養方法共分離得到32株乳酸菌,
經鑒定分別為:L.rhamnosus、E.faecalis、L.gasseri、L.plantarum、L.casei、P.pentosaceus與B.longum;同時,SMRT測序技術共獲得11種乳酸菌,分別為L.rhamnosus、E.faecalis、L.gasseri、L.casei、P.pentosaceus、L.paracasei、L.salivarius、L.paraplantarum、L.porcinae、B.pseudocatenulatum、B.longum。通過兩種分析方法結合的方式來看,相較于大多數西方國家的嬰兒腸道菌群,中國嬰兒腸道菌群含有較高豐度的乳酸菌,但乳酸菌多樣性呈現出較低的態勢,此結果與他人研究結果相吻合[16]。不同嬰兒腸道菌群中乳酸菌多樣性具有一定差異,但整體趨勢上抗生素使用會影響嬰兒腸道菌群乳酸菌多樣性,且不同種類抗生素影響程度不同。相較于健康組,抗生素組僅分離檢測到2種乳酸菌,分別為:E.faecalis以及L.porcinae。阿莫西林對嬰兒腸道乳酸菌影響程度小于美羅培南,但這兩種抗生素對嬰兒腸道乳酸菌均具有破壞性的影響。其次,傳統培養方法可培養出三代測序技術中豐度較低或未檢測到的純化乳酸菌菌株,如L.plantarum、B.longum,但三代測序技術獲悉的乳酸菌多樣性更高。通過兩種方法結合,可更準確地揭示嬰兒腸道菌群中乳酸菌的多樣性及分布。
總體而言,本文采用傳統培養與三代測序結合的分析手段,研究嬰兒腸道菌群中乳酸菌多樣性,不僅提出了一個分析腸道菌群的新思路,而且證明抗生素確實可顯著降低嬰兒腸道菌群中乳酸菌的多樣性,為今后嬰兒腸道菌群研究提供了新的理論與技術支持。且通過分離得到的乳酸菌純化菌株,可為今后開發發酵乳酸菌制品提供新的菌種資源。

