嗜熱α-淀粉酶熱穩(wěn)定性的決定因素及提高策略
李才明 陳雙娣 顧正彪 洪 雁 程 力 李兆豐
(1. 江南大學食品科學與技術國家重點實驗室,江蘇 無錫 214122;2. 江南大學食品學院,江蘇 無錫 214122; 3. 江南大學食品安全與質量控制協(xié)同創(chuàng)新中心,江蘇 無錫 214122)
酶是一種具有生物催化活性的蛋白質。通常,在溫度高于50~60 ℃時,酶蛋白會發(fā)生變性而失去相應的活性,這種在高溫下的不穩(wěn)定性嚴重影響其應用[1]。然而,嗜熱酶作為生物催化劑有著許多獨到的優(yōu)勢,包括:① 穩(wěn)定性提高,貯存、運輸成本降低;② 反應效率提高;③ 對反應的冷卻系統(tǒng)要求低,利于能耗及成本的降低;④ 在高的反應溫度下,能減少雜菌污染;⑤ 在高溫下,反應體系黏度降低,有利于傳質。因此,嗜熱酶的開發(fā)已成為當今的研究熱點。
嗜熱α-淀粉酶(α-1,4-葡聚糖-4-葡聚糖水解酶,EC 3.2.1.1)是目前工業(yè)上最重要的酶制劑之一,在食品、紡織、醫(yī)藥、造紙等工業(yè)中有著十分廣泛的應用。作為一種淀粉內切酶,其作用方式是隨機切斷淀粉或糖原分子內部的α-1,4-糖苷鍵,使淀粉黏度迅速下降,生成葡萄糖、麥芽糖、低聚糖和可溶性糊精[2-3]。因此,在淀粉的酶轉化工業(yè)應用中具有潛在的應用價值。一般地,所有淀粉的酶轉化都包括糊化、液化和糖化過程。首先,通過加熱淀粉水溶液可達到糊化的作用,為了淀粉糊化后能夠立即進行液化、糖化反應而避免過長的冷卻時間,就需要在較高溫度下穩(wěn)定性較好的淀粉酶。因此,具有特殊耐熱性的嗜熱α-淀粉酶被廣泛地用來滿足更高的溫度要求,進而促進整個淀粉加工業(yè)的發(fā)展。另外,嗜熱α-淀粉酶作為嗜熱酶的典型代表,在嗜熱酶的研究、開發(fā)及應用中扮演著重要的角色,并有助于探索蛋白質達到極端熱穩(wěn)定性的相關機理。本文主要對嗜熱α-淀粉酶熱穩(wěn)定性的決定因素及其熱穩(wěn)定性提高策略進行全面的綜述。
1 嗜熱α-淀粉酶的來源
嗜熱α-淀粉酶有多種來源,包括植物、動物和微生物,并在這些來源的碳水化合物代謝中扮演重要角色。盡管α-淀粉酶分布廣泛,但微生物來源的,尤其是真菌的和細菌的α-淀粉酶因其成本、效率、一致性、對產品更少的時間/空間上的要求以及方便確定和優(yōu)化工藝條件而應用于工業(yè)生產中[4]。
在細菌中,芽孢桿菌被廣泛應用于嗜熱α-淀粉酶的生產以滿足工業(yè)的需求。枯草芽孢桿菌(Bacillussubtilis)、嗜熱脂肪芽孢桿菌(Bacillusstearothermophilus)、地衣芽孢桿菌(Bacilluslicheniformis)和解淀粉芽孢桿菌(Bacillusamyloliquefaciens)被認為是嗜熱α-淀粉酶的優(yōu)良生產者,也廣泛應用于生產具有不同商業(yè)用途的酶。特別是古菌α-淀粉酶與芽孢桿菌α-淀粉酶相比具有極好的嗜熱特性,表1列出了部分微生物來源的嗜熱α-淀粉酶。
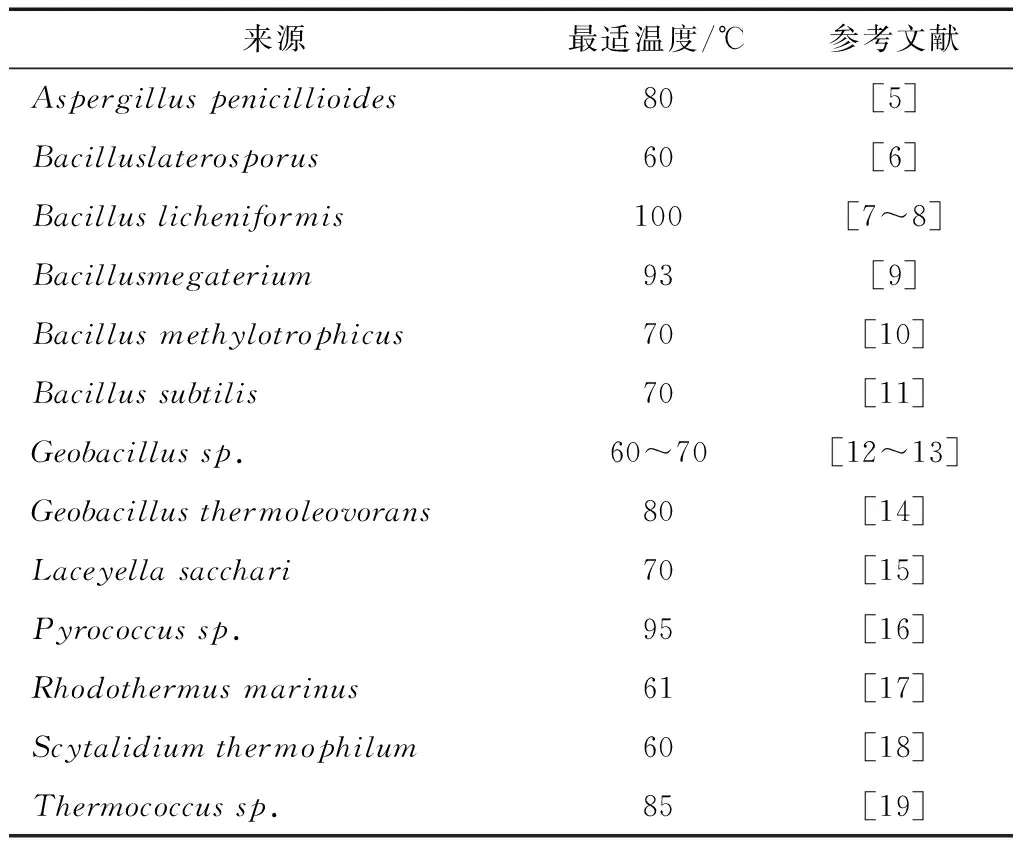
表1 嗜熱α-淀粉酶的微生物來源及性質Table 1 Microbial origins and properties of thermophilic α-Amylase
2 嗜熱α-淀粉酶熱穩(wěn)定性的決定因素
酶的熱穩(wěn)定性涉及到在高溫條件下多肽鏈的化學特性和空間立體結構的變化,嗜熱α-淀粉酶可作為分析熱穩(wěn)定性的模型。有關嗜熱α-淀粉酶穩(wěn)定性的研究不僅有助于對蛋白質穩(wěn)定性機制的理解,還可以幫助開發(fā)適于工業(yè)生產中的對熱更穩(wěn)定的酶。
通過同源序列比對,結合定點突變技術分析結構和穩(wěn)定性方面的關系,揭示了一些導致嗜熱α-淀粉酶熱穩(wěn)定性高的重要因素,但并未得到單一的、普遍的機制,而是眾多因素綜合作用的結果。同時,熱穩(wěn)定性的分子機制隨酶的不同也存在差異。然而,一些共有的特征都被認為是嗜熱α-淀粉酶熱穩(wěn)定的影響因素,主要包括:① 氨基酸的組成與分布,如嗜熱α-淀粉酶中的疏水性氨基酸通常高于中溫蛋白酶,這些疏水性氨基酸能增加蛋白質的剛性和疏水性,從而提高嗜熱α-淀粉酶的耐熱性[20]。② 帶電荷氨基酸與不帶電荷氨基酸的比率,如相對于Ala、Val、Ser、Thr、Asn,嗜熱α-淀粉酶中的Tyr、Asp、Glu、Lys、Arg含量偏高。③ 嚴格和緊湊的空間結構。空間結構緊湊,堆積密度增加,導致在一定溫度下,嗜熱α-淀粉酶較同源嗜溫蛋白酶有更低的熱運動水平和更小的彈性。④α-螺旋的穩(wěn)定性[21]15-19。嗜熱α-淀粉酶的α-螺旋中一般缺少β-分枝殘基(Val、Ile、Thr),避免了α-螺旋中的蛋白質伸展到更廣的區(qū)域,可能使嗜熱蛋白質具有更強的剛性,從而較其嗜溫同源體有更好的抗熱能力[20]。⑤ 氫鍵數(shù)目[22-23]。較多的氫鍵數(shù)目,有利于氫鍵網(wǎng)絡的加強,因而嗜熱α-淀粉酶表現(xiàn)出更好的耐熱性。⑥ 更多的作用力,如離子相互作用、疏水相互作用、二硫鍵的數(shù)量、芳香基團的相互作用[21]20-41。⑦ 金屬離子結合位點的存在[24]。來源于B.stearothermophilus的Ca2+-Na+-Ca2+結合位點對其熱穩(wěn)定性有著重要作用[25]。⑧ 去折疊熵值等。影響α-淀粉酶熱穩(wěn)定性的主要因素還包括一些金屬離子的存在與否、底物和其他穩(wěn)定劑的情況等[26]。
來源于B.licheniformis的嗜熱α-淀粉酶(BLA),是一個分子量約58 kDa的單體,存在一中心部位——α/β桶。作為其嗜溫同源體,來源于B.amyloliquefaciens的α-淀粉酶(BAA),有著與BLA近似的分子量。Khajeh等[27]對BLA和BAA進行了序列比對,發(fā)現(xiàn)二者存在很高的同源性,達88%。SWISS-MODEL結構模擬結果進一步表明,BAA的3D結構與BLA極為類似,這2種α-淀粉酶的二級結構組成成分也非常相似。通過GETAREA程序計算可獲得表面和水解作用,比較結果發(fā)現(xiàn),嗜熱BLA的結構較嗜溫BAA更靈活。特別地,結構域B的許多突變在一定程度上能夠影響B(tài)LA的熱穩(wěn)定性,從而使其適應不同溫度下的反應。
3 α-淀粉酶熱穩(wěn)定性的提高策略
α-淀粉酶熱穩(wěn)定性包括熱力學穩(wěn)定性和動力學穩(wěn)定性。熱力學穩(wěn)定性是由酶的穩(wěn)定態(tài)自由能(ΔGstab)和變性溫度(Tm,50%蛋白質去折疊時的溫度)決定的。動力學穩(wěn)定性通過在特定溫度下酶的半衰期(t1/2)來描述[28]。
嗜熱α-淀粉酶與普通嗜溫酶相比,它們的堿基序列、酶的三級結構及催化機制相似度很高,但上述因素的微小差異導致了嗜熱α-淀粉酶較普通淀粉酶有更好熱穩(wěn)定性。這種差異的存在,為α-淀粉酶熱穩(wěn)定性的提高奠定了基礎。目前,α-淀粉酶的熱穩(wěn)定化技術按照原理可分為3種:物理法、化學法和生物法。
3.1 物理法
α-淀粉酶可以通過添加穩(wěn)定劑來達到增強熱穩(wěn)定性的效果。酶體系中添加穩(wěn)定劑后,其體系黏度會有所增加,體積排阻效應得到了提高,靜電相互作用也會增強,這有利于改善酶所處的微環(huán)境,穩(wěn)定酶的空間結構構象,最終酶的熱穩(wěn)定性往往也因此而提高。常用的穩(wěn)定劑主要包括糖與多羥基化合物和鹽2類。
糖與多羥基化合物,常用的有以下幾種:淀粉、聚乙二醇(PEG)、聚乙烯醇、纖維素、曲拉通等。在酶體系中加入此類物質,酶分子會因其周邊滲透質的排斥而優(yōu)先被水化,從而酶分子的穩(wěn)定性得到增強。不同的穩(wěn)定劑往往對酶有著不同的穩(wěn)定效果。作者[29]通過將15% PEG1000添加到來源于B.circulans的α-淀粉酶中,發(fā)現(xiàn)能將60 ℃的半衰期延長6.5 倍。Yoon等[30]系統(tǒng)性地研究了不同多羥基化合物(如曲拉通X-100、聚乙二醇和聚乙烯醇)對豬胰腺α-淀粉酶(PPA)、人類唾液α-淀粉酶淀粉酶(HAS)、米曲霉α-淀粉酶淀粉酶(AOA)、解淀粉芽孢桿菌α-淀粉酶(BAA)、地衣芽孢桿菌α-淀粉酶(BLA)這幾種α-淀粉酶熱穩(wěn)定性的影響,結果發(fā)現(xiàn)添加物及其添加量不同時,對不同酶的熱穩(wěn)定性影響結果也存在一定的差異。
鹽類物質不同于糖或多羥基化合物,其對α-淀粉酶的穩(wěn)定原理是:鹽的添加引起鹽與酶分子非特異性結合現(xiàn)象的發(fā)生,減緩酶的變性,從而利于酶熱穩(wěn)定性的提高。其中有些鹽類物質可作為酶的輔助因子在維持α-淀粉酶的構象以及保持α-淀粉酶的活性方面扮演著重要角色,例如有些金屬離子結合位點(比如Ca2+、Na+等)。因此,對于那些結構中存在金屬離子結合位點的α-淀粉酶,往酶體系中加入相應的鹽(比如CaCl2、NaCl等),能對酶起到激活作用或增強其熱穩(wěn)定性。Yadav等[28]通過添加10 mmol/L Ca2+能將變性溫度Tm從48 ℃提高至71 ℃,大大增加了α-淀粉酶的熱穩(wěn)定性。Maalej等[31]發(fā)現(xiàn)來源于Pseudomonasstutzeri的α-淀粉酶在50 ℃保溫1 h后的殘余活力只有約20%,而加入2 mmol/L Ca2+時,殘余活力能保留80%,說明Ca2+對酶的穩(wěn)定性有很大的改善效果。
3.2 化學法
化學法主要利用的是化學試劑對酶的修飾作用。α-淀粉酶可以通過加入一定的試劑對酶的特定基團修飾改造來改變α-淀粉酶分子內的作用力,進而改變其結構、功能。化學修飾是α-淀粉酶穩(wěn)定的一個重要策略,在藥物蛋白的修飾中扮演著重要角色,可以有效降低蛋白免疫特性,提高其抗蛋白酶的水解能力,增強熱穩(wěn)定性,從而可以達到延長半衰期的目的。Ismaya等[32]發(fā)現(xiàn)利用非極性的酸酐修飾α-淀粉酶能將其穩(wěn)定性提高18倍。化學修飾對酶熱穩(wěn)定性的影響往往有兩方面,沒有普遍的適用標準,需根據(jù)酶的特點來選擇合適的試劑和修飾方法。另外,化學修飾會伴隨酶損失,不同批次容易存在差異性[33]。除此之外,化學修飾中所用試劑的安全性問題是在酶的改性方面所面臨的最大考驗之一。
另外,酶的固定化也是一種提高α-淀粉酶熱穩(wěn)定性的有效策略,就是利用物理或/和化學方法將酶束縛或限制在某一區(qū)域,仍能保留酶特有的催化特征,并且能回收重復利用的一種技術[34]。王華等[35]以殼聚糖為載體,戊二醛交聯(lián)共價固定α-淀粉酶后,其酸堿穩(wěn)定性和熱穩(wěn)定性均優(yōu)于游離酶。Defaei等[36]通過離子相互作用將α-淀粉酶固定在磁性納米粒子上,最適溫度從45 ℃升至55 ℃,穩(wěn)定性得到很大提高,能重復使用10次以上。但由于其工藝技術比較復雜,成本偏高而難以得到廣泛應用。
3.3 生物法
蛋白質工程是常見的一種生物手段,α-淀粉酶可以通過該方法來改變其氨基酸序列,從而改變結構或者構象,達到穩(wěn)定性提高的效果。最初,蛋白質工程主要應用于α-淀粉酶基因在菌株中的克隆表達[12],最常規(guī)的做法是在合適的宿主細胞中克隆和表達出具有良好熱穩(wěn)定性的α-淀粉酶基因。如魏濤等[37]通過將來源于SolfolobustokodaiiStrain 7的高溫α-淀粉酶基因ST0817在大腸桿菌中克隆表達,獲得具有較強熱穩(wěn)定性和pH穩(wěn)定性的α-淀粉酶。除了克隆表達外,α-淀粉酶還采用分子生物學手段進行熱穩(wěn)定性的研究。α-淀粉酶除了存在易篩選、負突變株的可用性等優(yōu)點外,對α-淀粉酶基因也有了深刻透徹的了解,加上其在微生物像枯草芽孢桿菌(B.subtilis)中發(fā)酵的成熟性,成為蛋白質中第一個采用分子生物學手段的研究對象。隨著生物技術的不斷發(fā)展,蛋白質工程已經(jīng)成為研究的熱點之一,一方面被用來研究以增強蛋白質如商品酶制劑的熱穩(wěn)定性,另外一方面也用于研究蛋白結構和功能之間的構效關系。蛋白質工程的技術策略主要有理性化設計和定向進化2種。
理性化設計作為α-淀粉酶分子改造最常用的一種方法,有著良好的前景,對于任何形式的蛋白質工程都具有潛在的研究價值[20]。一般通過以下2種方式進行:① 引入突變;② 通過非共價連接或形成二硫鍵將蛋白質表面的環(huán)進行固定。可以在蛋白質表面局部增加離子來連接非相鄰部位,并且不會導致像包埋殘基那樣產生排斥的范德華力或者造成α-淀粉酶構象不穩(wěn)定而具有巨大的應用潛力。該技術需以相關α-淀粉酶蛋白分子三維結構為前提,探索α-淀粉酶蛋白結構與功能之間存在的關聯(lián)性,接著進一步得到α-淀粉酶蛋白分子中與功能相關的氨基酸,最后采用分子生物學手段(如定點或盒式突變)以實現(xiàn)定向改造酶蛋白的理化特性。曾靜等[38]通過分析來源于極端嗜熱古生菌ThermococcuskodakarensisKOD1的α-淀粉酶ApkA的氨基酸序列,構建單突變體ApkAdsA180K,與D212間形成離子鍵,于90 ℃下的半衰期較ApkAds延長了2 h。Li等[39]通過多重序列比對將來源于B.licheniformisα-淀粉酶的位于B域長環(huán)內187、188位點及附近的269位點進行突變,構建了突變體A269K/S187D/N188T,將其在95 ℃的半衰期提高了9倍,催化效率也提高了1.84倍。但理性化設計需以酶蛋白分子的三維結構為基礎,這要求直接測定其晶體結構或者采用生物分析軟件進行結構模擬,一定程度上會增加該技術的難度,使過程也變得更加復雜和繁瑣化。
定向進化又稱非理性化設計,該技術的出現(xiàn)推動了蛋白質工程進入新的階段。定向進化是指將自然演變的過程在試管中呈現(xiàn),通過突變、重組使蛋白質的性質往最佳狀態(tài)進化,以得到具有目標性質的變種體。相比于理性化設計,定向進化的區(qū)別在于通過人為模擬自然進化機制進行突變,最大特點在于該過程不需事先了解酶的空間結構和催化機制,可采用隨機突變技術,并與快速高通量篩選方法相結合實現(xiàn)酶基因的體外改造。因此,定向進化是一種比定點突變更強大、更有潛力的工程方法。目前,2種定向進化的方法已被開發(fā):① 隨機突變方法又稱為DNA重組,是將含DNA的酶基因片段通過PCR技術導入到原基因中進行重新組裝以得到完整的基因;② 易錯PCR技術和DNA重組技術的結合,是在每一次易錯PCR循環(huán)中篩選出所需要的特性基因,然后通過DNA重組技術獲得最好的變體特征。Mabrouk等[23]通過易錯PCR得到熱穩(wěn)定性更好的突變體MA-A27,將50 ℃的半衰期從30 min提升至70 min,55 ℃的半衰期從13 min提升至25 min。除了提高酶的熱穩(wěn)定性外,該方法也被廣泛用于酶的其他特性改造,如改善酶的底物特異性、提高酶在溶劑中的活性或者提高嗜熱酶在酸性條件下的溫度等[40-41]。但是定向進化技術還存在以下問題:隨機性強,工作量大,費時,成功率低等。
不同行業(yè)對不同生理生化特性的α-淀粉酶的需求促進了該酶的研究與發(fā)展。酶/蛋白質工程包括將所需的特性整合在適當?shù)幕蛏希菍崿F(xiàn)這一目標的很有前途的技術手段。
4 展望
嗜熱α-淀粉酶不僅在蛋白質熱力學穩(wěn)定性的基本原理方面,而且在穩(wěn)定性和催化效率之間的關系方面都激發(fā)著人們濃厚的研究興趣。盡管α-淀粉酶熱穩(wěn)定性的提高已有多種策略,但不可逆變性的過程尚且未知,細菌α-淀粉酶穩(wěn)定性方面也還存在許多問題。隨著高穩(wěn)定性芽孢桿菌α-淀粉酶的開發(fā),未來α-淀粉酶工程很有可能由穩(wěn)定性向pH活性以及底物特異性方向轉變。由于對α-淀粉酶領域持續(xù)不斷的深入研究,這些理論和方法也將得到迅速發(fā)展,同時更好地應用于構建有著獨特性質的α-淀粉酶,如通過修飾酶的遺傳特性或定點突變技術來獲得更多能滿足需要的嗜熱α-淀粉酶,同時將不同的酶熱穩(wěn)定性的提高策略進行有機的整合也將體現(xiàn)出其特有的優(yōu)勢,能夠達到更理想的穩(wěn)定效果,也有助于對機理的深入研究。

