2014—2017年鹽城地區甲型 H1N1流感病毒HA、NA基因變異分析
陳國清 李春香 王瑤 李峰 徐士林 李長城 邵榮標
224001鹽城市疾病預防控制中心(陳國清、王瑤、李峰、徐士林、李長城、邵榮標);
224002鹽城市婦幼保健院(李春香)
甲型流感病毒對人類威脅最大,其表面兩個包膜糖蛋白抗原血凝素(hemagglutinin,HA)和神經氨酸酶(neuraminidase,NA)有多種亞型的組合,能形成致病力、傳播力不一的新型病毒。2009年春,來源于北美的新的三源重配病毒甲型H1N1引起了21世紀首次流感大流行,國內自四川首次發現病例后,也引起了全國范圍內的流行[1-2]。據國家流感中心2009—2015年的流感監測顯示,乙型、甲型H1N1和季節性H3N2三種亞型流感病毒交替或者同時流行,其中,甲型H1N1的流行已呈一定的季節性[3]。流感病毒HA和NA基因核苷酸位點的變異是其重要的分子變異基礎,兩者經常處于抗原漂移變化的積累當中,兩者編碼的關鍵氨基酸位點的變異對病毒的抗原位點、受體結合位點、糖基化位點以及耐藥位點等起決定性作用[4-6]。鹽城地區2009—2013年與江蘇省甲型H1N1流感監測結果的流行趨勢一致[7],為了解2014—2017年鹽城地區甲型H1N1流行特征、變異程度以及與推薦疫苗株的匹配程度,對甲型H1N1流感病毒HA和NA基因進行分子流行病學研究,從分子水平上揭示流感病毒的基因變異與流行的關系,為鹽城地區防控甲型H1N1的流行、病毒演化趨勢分析以及疫苗株的篩選提供參考依據。
1 材料與方法
1.1 標本來源 根據《全國流感監測方案》2010、2017版要求,按照流感樣病例定義,從鹽城市第一人民醫院、鹽城市第三人民醫院國家級哨點監測醫院采集2014—2017年流感樣病例以及各地流感暴發疫情流感樣病例的鼻咽拭子,在4℃冷藏條件下于24 h內送至鹽城市疾病預防控制中心流感網絡實驗室進行病毒核酸檢測以及病毒分離。
1.2 方法
1.2.1 流感樣病例標本實時熒光RT-PCR核酸檢測:用MagMAXTM-96Viral RNA Isolation Kit提取試劑在自動核酸提取儀上提取病毒RNA,采用甲乙型流感、禽流感H7N9病毒雙通道以及甲型H1N1、H3亞型(江蘇碩世生物)單通道流感病毒核酸熒光PCR試劑進行流感樣病例標本核酸檢測,實驗操作流程以及最終的結果判斷參照試劑盒說明書進行。1.2.2 病毒分離培養與鑒定:將甲型H1N1病毒核酸陽性標本采用狗腎傳代細胞(MDCK)進行病毒分離,出現細胞病變的樣本及時收獲,收獲之前凍融細胞1~2次,于-70℃凍存。采用國家流感中心下發的標準血清進行微量血凝實驗(HA)和血凝抑制試驗(HI),對培養物的滴度以及從血清學的角度對甲型H1N1病毒進行確認,方法參照《全國流感監測方案》2010、2017 版。
1.2.3 甲型H1N1流感毒株HA1和NA基因擴增:提取分離的甲型 H1N1流感毒株的 RNA,采用TaKaRa(貨號:RR057A)One Step RT-PCR Kit進行HA1和NA基因的擴增。通過Premier5.0軟件在保守區設計HA1、NA基因引物。HA1基因上游引物:5′-ATGAAGGCAATACTAGTAG-3′; 下 游 引 物:5′-CGGCAATGGCCCCRAATAG-3′。擴增片段長度為1 054 bp。 NA 基 因 上 游 引 物:5′-CAAAAGCAG GAGTTTAA AATG-3′;下游引物:5′-GAACAAATTAC TTGTCAATGG-3′。擴增片段長度為1 435 bp。反應體系配置以及擴增條件參照試劑盒說明書,PCR擴增產物1.5%瓊脂糖凝膠電泳確認。
1.2.4 甲型H1N1流感病毒HA1和NA基因PCR產物序列測定與分析:HA1和NA基因PCR擴增產物送上海生工公司雙向測序,拼接的序列經NCBI中的GenBank數據庫Blast比對確認為甲型H1N1流感病毒 HA1、NA基因序列。自 GenBank和GISAID數據庫中選取近年國內部分省市甲型H1N1(包括國內首發株 A/Sichuan/1/2009)代表株和2014—2017年北半球疫苗株A/California/07/2009(H1N1)、2017—2018年北半球疫苗株A/Michigan/45/2015(H1N1)作為參比序列,截取HA1區序列以及全長編碼區NA基因序列進行分析,運用生物信息學軟件DNAStar中MegAlign軟件進行核苷酸和氨基酸序列同源性分析,核苷酸序列比對采用mafft方法,以PhyML3.0軟件最大似然法構建遺傳進化樹。
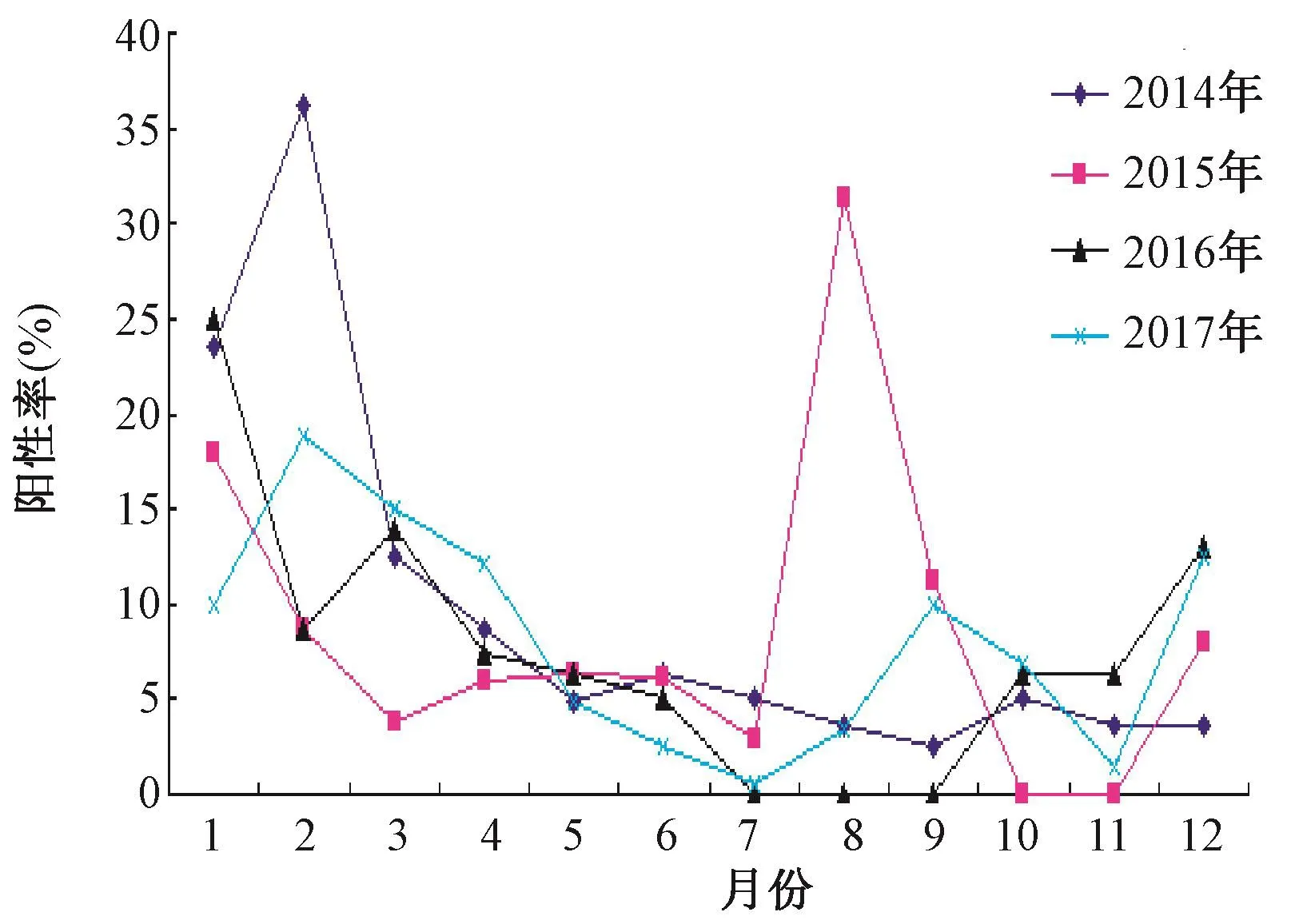
圖1 2014—2017年鹽城地區流感病毒核酸陽性率趨勢圖Fig.1 Tendency chart of the positive rates of the nucleic acid of influenza viruses in 2014-2017
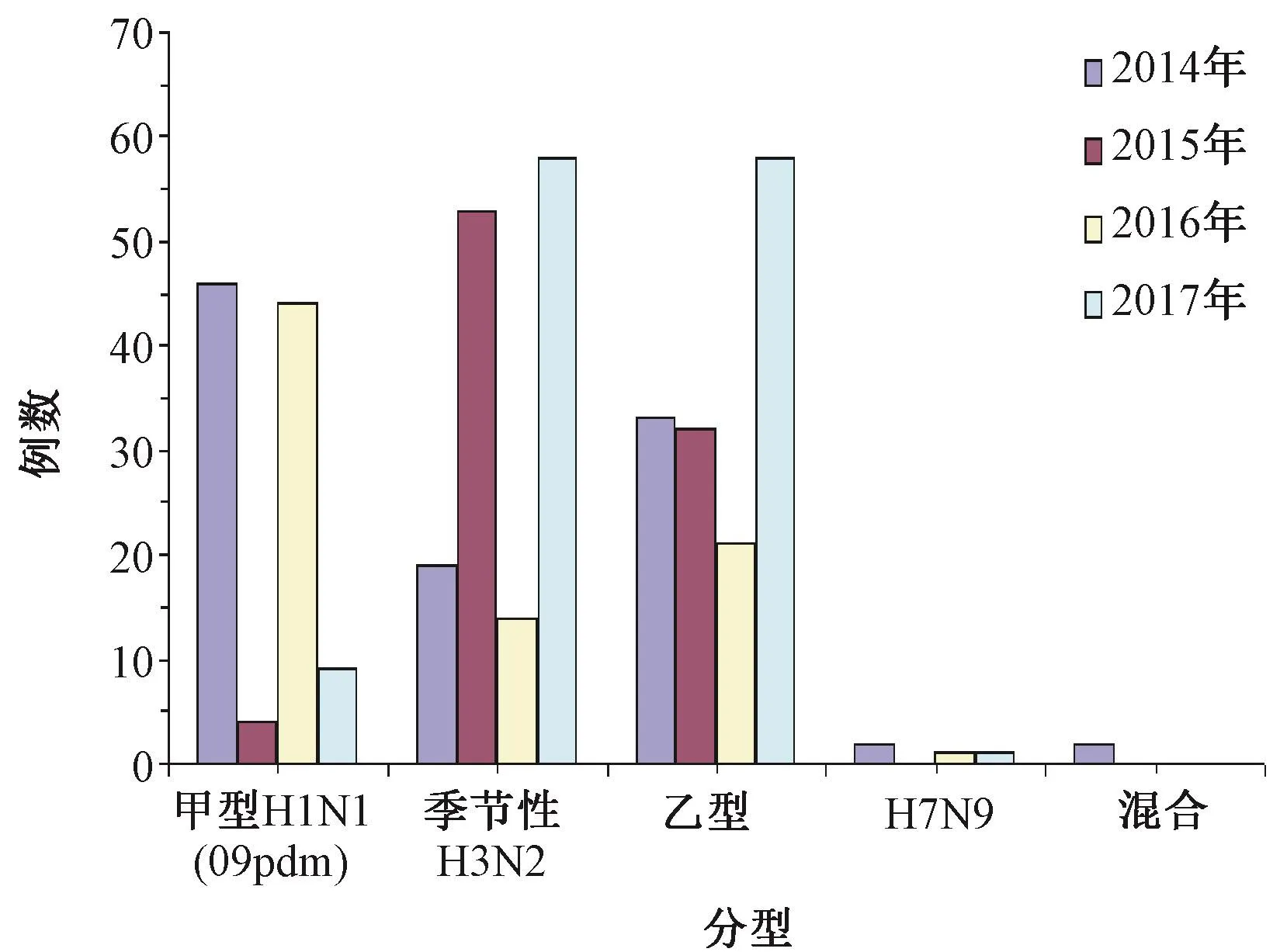
圖2 2014—2017年鹽城地區不同亞型流感病毒分布情況Fig.2 Distribution of different subtypes of influenza viruses in 2014-2017
2 結果
2.1 2014—2017年鹽城地區流感病毒核酸檢測及流行情況 2014—2017年,鹽城地區共檢測流感樣病例4 942例,核酸檢測陽性數397例,陽性率8.03%(397/4 942)。甲型H1N1核酸陽性數103例,陽性率2.08%(103/4 942),占比25.94%(103/397)。其中2014—2017年甲型H1N1核酸陽性數分別為46例、4例、44例、9例,當年陽性占比分別為 45.10%(46/102)、4.49%(4/89)、55%(44/80)、7.14%(9/126)。 2014—2017年甲型 H1N1流感病毒每年都有檢出,已成為重要的季節性流感病毒,其中,2014、2016年為當年流行的優勢毒株,其他亞型的流感病毒成散在性分布。2014—2017年冬春季為流感病毒傳統流行的高峰期,除2015、2017年外夏季流感峰不明顯。見圖1、2。
2.2 甲型H1N1流感病毒HA1和NA基因核苷酸和氨基酸序列同源性比較 按流行月選取的2014—2017年鹽城地區分離的甲型 H1N1病毒(2014年6株、2015年未分離到毒株、2016年7株、2017年4株)HA1基因核苷酸和氨基酸序列同源性分別為97.2% ~100%,96.6% ~100%;NA基因核苷酸和氨基酸序列同源性分別為98.3%~100%,97.8% ~100%。2014、2016和2017年鹽城地區甲型H1N1病毒HA1基因核苷酸同源性分別為99.7% ~99.9%,99.2% ~99.9%,97.3% ~100%;HA1基因氨基酸同源性分別為99.4% ~100%,98.5% ~100%,96.9% ~100%。2014、2016和2017年鹽城地區甲型H1N1病毒NA基因核苷酸同源性分別為 99.6% ~99.9%,99.6% ~100%,98.5%~100%;NA基因氨基酸同源性分別為99.3% ~100%,99.3% ~100%,98.4% ~100%。2014—2017年分離的 17株甲型 H1N1病毒與2014—2017年北半球疫苗株A/California/07/2009(H1N1)HA1基因核苷酸、氨基酸序列同源性分別為96.9% ~98.3%,95.7% ~97.6%;NA基因核苷酸、氨基酸序列同源性分別為97.7% ~98.9%,96.4% ~98.0%。與2017—2018年北半球疫苗株A/Michigan/45/2015(H1N1)HA1基因核苷酸、氨基酸序列同源性分別為97.3% ~99.3%,97.2% ~99.1%;NA基因核苷酸、氨基酸序列同源性分別為98.5% ~99.6%,98.4% ~99.6%。
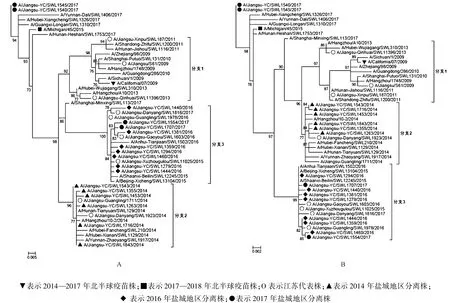
圖3 鹽城地區2014—2017年甲型H1N1流感病毒HA1基因(A)、NA基因(B)遺傳進化樹▼vaccine strain A/California/07/2009(H1N1pdm);■vaccine strain A/Michigan/45/2015(H1N1pdm);O strains isolated in Jiangsu province;▲strains isolated in Yancheng area in 2014;◆strains isolated in Yancheng area in 2016;●strains isolated in Yancheng area in 2017Fig.3 Phylogenetic trees of the HA1 and HA genes sequences of influenza A/H1N1(09pdm)viruses in Yancheng area in 2014-2017
2.3 甲型H1N1流感病毒HA1和NA基因核苷酸序列遺傳進化樹分析 鹽城地區2014—2017年分離的17株毒株HA1和NA基因在進化樹的位置基本對應,按分離年代的對應關系種系發生樹分為4個進化分支,分支1由2009—2013年的毒株構成,分支2由2014年的毒株構成,分支3主要由2016年毒株構成,2017年的毒株單獨聚集成簇。鹽城地區甲型H1N1毒株同一年份的毒株親緣關系相近,基本聚集成簇位于同一進化分支,除A/Jiangsu-YC/SWL1554/2017和A/Jiangsu-YC/SWL1707/2017分布于分支3,隨著時間的推移,與2014—2017年北半球疫苗株A/California/07/2009(H1N1)遺傳距離越來遠,分化成幾個分支,其中,2017年代表株A/Jiangsu-YC/SWL1540/2017和A/Jiangsu-YC/SWL 1545/2017與其他省份代表株聚集成簇,與2017—2018年北半球疫苗株A/Michigan/45/2015(H1N1)親緣關系相近,在同一進化分支中。見圖3。
2.4 甲型H1N1流感病毒HA1基因分子特征 鹽城地區2014—2017年分離的17株甲型H1N1病毒與兩疫苗株相比,HA1區未發生核苷酸的丟失和插入,長度 981 bp。與疫苗株 A/California/07/2009(H1N1)相比,17株分離株HA1區涉及23個氨基酸的位點的變異,變異率 7.03%(23/327),在P83S、D97N、K163Q、S185T、S203T、A256T、K283E、I321V共8個位點均發生了變異;與疫苗株 A/Michigan/45/2015(H1N1)相比,HA1區涉及15個氨基酸的位點的變異,變異率4.59%(15/327)。其中,2016年7株分離株、2017年2株分離株(A/Jiangsu-YC/SWL1554/2017和A/Jiangsu-YC/SWL 1707/2017)與疫苗株相比在3個位點均發生了V152T、V173I、A261S的變異,其他變異位點成散在性分布。
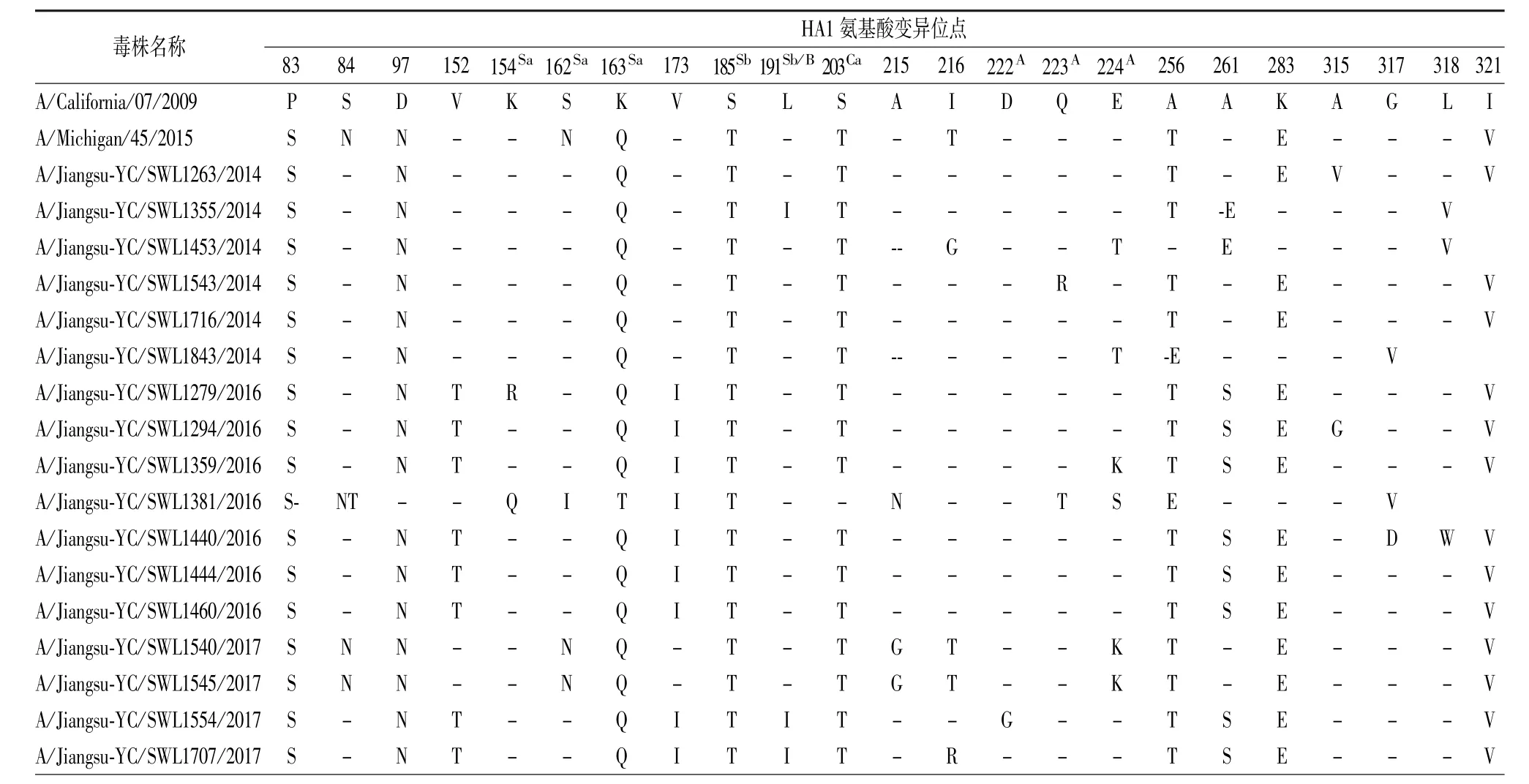
表1 2014—2017年鹽城地區分離的甲型H1N1流感病毒HA1區氨基酸變異位點分析Tab.1 Analysis of variation sites in the amino acid sequences of HA1 genes of influenza A/H1N1(09pdm)viruses isolated in Yancheng area in 2014-2017
甲型H1N1流感病毒HA1基因編碼的蛋白抗原決定簇涉及44個氨基酸,分布在Ca、Cb、Sa和Sb抗原表位[8-9]。與疫苗株 A/California/07/2009(H1N1)相比,17株分離株共涉及3個抗原表位和6個抗原位點(Ca 1個、Sa 3個、Sb 2個),變異位點為K154R、S162Ng、K163Q、S185T、L191I、S203T。 與A/Michigan/45/2015(H1N1)相比,其共涉及2個抗原表位和3個抗原位點(Sa 2個、Sb 1個),變異位點為K154R、N162S、L191I。甲型H1N1病毒受體結合位點由220環(218~225位)、130環(132~135位)、190螺旋(187~195位)構成[10]。與疫苗株相比,17株分離株中220環中有3個位點(D222G/N、G223R和E224K)發生變異,190螺旋中涉及1個位點(L191I)的變異。
利用Net NGlyc1.0在線糖基化位點預測,鹽城地區2014—2017年分離的17株甲型H1N1病毒HA1基因編碼的蛋白具有6個固定糖基化位點(10NNST、 11NST、 23NVT、 87NGT、 276NTT、287NTS)。其中,2017年兩株毒株(A/Jiangsu-YC/SWL1540/2017、A/Jiangsu-YC/SWL1545/2017)與疫苗株 A/Michigan/45/2015(H1N1)均增加了1個162NQS糖基化位點。見表1。
2.5 甲型H1N1流感病毒NA基因分子特征 鹽城地區2014—2017年分離的17株甲型H1N1流感病毒與疫苗株相比,NA基因編碼區片段未發生核苷酸的丟失和插入,長度1 410 bp。NA基因編碼蛋白包括8個酶活性催化位點(R118、D151、R152、R225、E277、R293、R368、Y402)、11 個輔助氨基酸位點(E119、R156、W179、S180、D/N199、I223、E228、H275、E278、N295、E425)以及 5 個耐藥位點(E119、R152、H275、N295 和 S247)[11-13],鹽城地區 17 株分離株中均未發生上述氨基酸位點的變異。
疫苗株A/California/07/2009(H1N1)NA基因編碼蛋白有8個潛在糖基化位點,分布在50、58、63、68、88、146、235 和386 位點中。 鹽城地區2 株分離株(A/Jiangsu-YC/SWL1540/2017和A/Jiangsu-YC/SWL1545/2017)增加了1個糖基化位點42NRS,其他15株分離株與疫苗株A/Michigan/45/2015(H1N1)均增加了42NQS位點,所有分離株均減少了386NFS糖基化位點,其中 A/Jiangsu-YC/SWL1440/2016丟失了146NGT糖基化位點。
3 討論
鹽城地區2014—2017年甲型H1N1流感病毒每年都有檢出,其中,2014、2016年成為當年流行的優勢毒株,與季節性流感H3N2、乙型流感共同流行。2014—2017年冬春季為流感病毒傳統流行的高峰期,優勢毒株流行的強度決定了流感病毒流行的高峰期。鹽城地區分離的17株甲型H1N1流感病毒HA1、NA基因序列與疫苗株A/Michigan/45/2015(H1N1)的同源性要高于疫苗株A/California/07/2009(H1N1),同年內甲型 H1N1毒株 HA1、NA基因的序列同源性相對較高,說明流行的甲型H1N1毒株在逐年進化變異。
與疫苗株A/California/07/2009(H1N1)相比,疫苗株A/Michigan/45/2015(H1N1)和鹽城地區17株分離株HA1基因早期3個適應性突變位點P83S、S203T、I321V 依然存在[14],隨著病毒的選擇進化又增加了5個變異位點(D97N、K163Q、S185T、A256T、K283E)。17株分離株抗原決定簇位點涉及6個氨基酸位點分布在3個抗原表位(Ca 1個、Sa 3個、Sb 2個),不斷的處于抗原漂移的選擇壓力中。與疫苗株相比,2016年7株分離株與2017年兩株分離株(A/Jiangsu-YC/SWL1554/2017和A/Jiangsu-YC/SWL1707/2017)3個位點均發生了 V152T、V173I、A261S變異,其生物學意義值得關注。鹽城地區分離的17株毒株中關于組織侵嗜性變化的受體結合位點共涉及220環、190螺旋兩個區域,其中A/Jiangsu-YC/SWL1453/2014、 A/Jiangsu-YC/SWL1381/2016和A/Jiangsu-YC/SWL1554/2017涉及D222G/N變異,能夠在臨床引起重癥[15-16],其他受體結合位點的變異導致的臨床意義需待進一步研究。17株分離株NA基因編碼序列涉及的酶活性位點、輔助酶活性位點以及耐藥位點均未發生變異,說明NA基因編碼的關鍵氨基酸序列位點很保守。鹽城地區2014—2017年分離的17株毒株HA1和NA基因構建的遺傳進化樹的位置基本一致,分為4個進化分支,同一年份的毒株親緣關系相近,基本聚集成簇位于同一進化分支,進化上相對一致又保守,與江蘇省2009—2017年代表株聚類關系基本一致,說明江蘇省內流行的毒株差異不大,同進化同循環,可能有著共同的起源。2014—2017年鹽城代表株與疫苗株A/California/07/2009(H1N1)遺傳距離越來越遠,說明2014—2017年鹽城地區分離的毒株與A/California/07/2009(H1N1)疫苗株不匹配程度越來越高,差異隨時間的變化加大,增加了人群免疫空白的積累,2017年分離的毒株(A/Jiangsu-YC/SWL1540/2017、A/Jiangsu-YC/SWL1545/2017)與疫苗株A/Michigan/45/2015(H1N1)聚類成簇,匹配度較好,能對人體產生有效保護抗體。
流感病毒HA基因和NA基因編碼蛋白糖基化位點的增加、減少以及非糖基化都可能會影響到蛋白空間結構的變化,進而影響到病毒的抗原性、致病力等其他生物學功能性。與疫苗株A/California/07/2009(H1N1)相比,2017年分離的2株毒株(A/Jiangsu-YC/SWL1540/2017、A/Jiangsu-YC/SWL1545/2017)和疫苗株A/Michigan/45/2015(H1N1)HA1基因編碼序列增加了1個162NQS糖基化位點。NA基因編碼序列中,鹽城地區2株分離株(A/Jiangsu-YC/SWL1540/2017和A/Jiangsu-YC/SWL1545/2017)增加了1個糖基化位點42NRS,其他15株分離株和疫苗株A/Michigan/45/2015(H1N1)增加了42NQS位點,所有分離株均減少了386NFS糖基化位點,其中 A/Jiangsu-YC/SWL 1440/2016丟失了146NGT糖基化位點。新積累的糖基化位點可能會掩蓋之前的抗原位點,能夠逃避人體的免疫壓力。
綜上所述,2014—2017年鹽城地區流行的甲型H1N1毒株的HA1基因編碼的氨基酸位點正逐漸發生變異,氨基酸變異位點的積累可能會引起流感病毒抗原決定簇位點、受體結合位點、糖基化位點的遺傳多樣性增加。基因分析顯示2014—2017年鹽城地區分離的毒株與A/California/07/2009(H1N1)疫苗株匹配效果不理想,2017年分離的毒株與疫苗株A/Michigan/45/2015(H1N1)匹配度較好。本研究未發現與NA基因編碼氨基酸有關酶活性位點以及耐藥位點的變化。接下來必須加強對鹽城地區甲型H1N1流感病毒動態監測,及時發現有流行病學意義的變異株,為流感防控以及疫苗研制工作打下基礎。
利益沖突 無

