18F-FDG及18F-FP-DTBZ雙示蹤PET/CT顯像診斷帕金森病
尚 琨,喬洪文,盧 潔,2,3*,崔碧霄,蘇玉盛,李 則,梁志剛
(1.首都醫科大學宣武醫院核醫學科,2.放射科,北京 100053;3.磁共振成像腦信息學北京市重點實驗室,北京 100053)
帕金森病(Parkinson disease, PD)主要病理學改變為中腦黑質致密部多巴胺能神經元變性脫失,導致紋狀體內多巴胺含量顯著減少。臨床診斷PD主要依據癥狀、體征等指標進行綜合評估,但早期診斷十分困難。PET可反映體內與PD發生發展過程密切相關的生物學標志物的變化情況。18F-FDG作為最常用的PET示蹤劑,可用于顯示PD患者的腦代謝改變情況,為早期診斷和鑒別診斷提供可靠的生物學指標[1]。18F-FP-DTBZ是一種以Ⅱ型囊泡單胺轉運體(vesicular monoamine transporter type 2, VMAT2)為靶向的PET顯像劑。VMAT2存在于多巴胺能神經元內,而紋狀體區域多巴胺能神經元分布較多,故該區域VMAT2濃度可用于評估黑質—紋狀體通路多巴胺能神經元突觸前膜情況[2]。本研究分析PD患者18F-FDG和18F-FP-DTBZ PET/CT顯像特點,探討雙示蹤劑顯像診斷PD的價值。
1 資料與方法
1.1 一般資料 收集2017年6月—2018年1月經我院神經內科確診的28例PD患者(PD組),男12例,女16例,年齡54~69歲,平均(59.4±7.9)歲,病程1~6年,平均(3.12±1.87)年,均符合英國倫敦腦庫PD診斷標準[3]。在患者未服用藥物的狀態下(停用抗PD藥物至少12 h),對其采用PD統一評分量表(unified Parkinson disease rating scale, UPDRS)中第Ⅲ部分(UPDRS Ⅲ)和Hoehn-Yahr(H-Y)分期,對所有PD患者進行臨床評分;根據H-Y分期將PD組分為早期PD亞組(H-Y分期為Ⅰ~Ⅱ期,n=20)和中晚期PD亞組(H-Y分期Ⅱ期以上,n=8);根據肢體癥狀不同分為雙側肢體癥狀亞組(n=14)和單側肢體癥狀亞組(n=14)。
選取同期年齡和性別與PD組相匹配的健康志愿者10名為對照組,男5名,女5名,年齡52~70歲,平均(55.0±8.3)歲。本研究經首都醫科大學宣武醫院倫理委員會批準,所有受試者均簽署知情同意書。
1.2 儀器與方法 采用聯影uMI510 PET/CT儀行3D腦靜態掃描。18F-FDG及18F-FP-DTBZ均由本科室自行制備,采用Siemens RDS111加速器生成18F,自動化合成模塊分別制備18F-FDG和18F-FP-DTBZ,放化純度均>98%。18F-FDG腦PET顯像和18F-FP-DTBZ腦PET顯像分別在1周內完成,2次檢查間隔24 h以上。檢查前受試者禁食6 h以上,空腹血糖<7 mmol/L。
18F-FDG顯像:注射18F-FDG(3.7~7.4 MBq/kg體質量)后囑受試者在昏暗房間內閉目休息,40~60 min后進行顯像。18F-FP-DTBZ顯像:經靜脈注射370 MBq18F-FP-DTBZ,受試者閉目休息60 min后接受圖像采集。CT掃描參數:頭部螺旋掃描,管電壓120 kV,管電流180 mAs,層厚3 mm;PET掃描參數:矩陣128×128,層厚2.44 mm,采集時間15 min,以有序子集最大期望值法(ordered subsets expectation maximization, OSEM)+TOF+高清圖像技術重建。
1.3 圖像分析 由2名具有10年及以上工作經驗的核醫學科醫師共同以盲法閱片,對PET圖像進行視覺評估,判斷各腦區放射性分布情況,如2名醫師意見不同,咨詢第3名具有10年以上工作經驗的核醫學醫師以達成共識。在18F-FDG PET圖像上,若某一腦區在至少連續2個層面出現葡萄糖代謝異常,則判斷為陽性。在18F-FP-DTBZ PET圖像上分析基底核區18F-FP-DTBZ攝取。在CT圖像上選擇3層顯示基底核區清晰的軸位圖像,于枕葉、雙側尾狀核、殼核前部和殼核后部勾畫ROI,在與之匹配的PET圖像上測量相應部位的標準攝取值(standard uptake value, SUV),以枕葉為參考腦區,以尾狀核、殼核前部及殼核后部SUV與枕葉SUV的比值為每一部位的18F-FP-DTBZ SUV。
1.4 統計學分析 采用SPSS 21.0統計分析軟件。
2 結果
2.118F-FDG PET顯像 對照組雙側大腦皮層各葉、基底核區及丘腦放射性分布均勻對稱,未見放射性分布稀疏或缺損區,見圖1A。28例PD中,5例大腦皮層代謝正常,23例(23/28,82.14%)大腦皮層代謝呈不同程度減低,其中位于額葉17例、顳葉13例、頂葉11例、枕葉1例;20例(20/28,71.43%)雙側基底核代謝正常,5例(5/28,17.86%)單側基底核代謝減低,3例(3/28,10.71%)雙側基底核代謝減低。見圖2A、2B、3A、3B。

圖1 男,55歲,健康志愿者 A.18F-FDG PET示大腦皮層及基底核、丘腦放射性分布對稱; B.18F-FP-DTBZ PET示雙側尾狀核及殼核放射性分布對稱
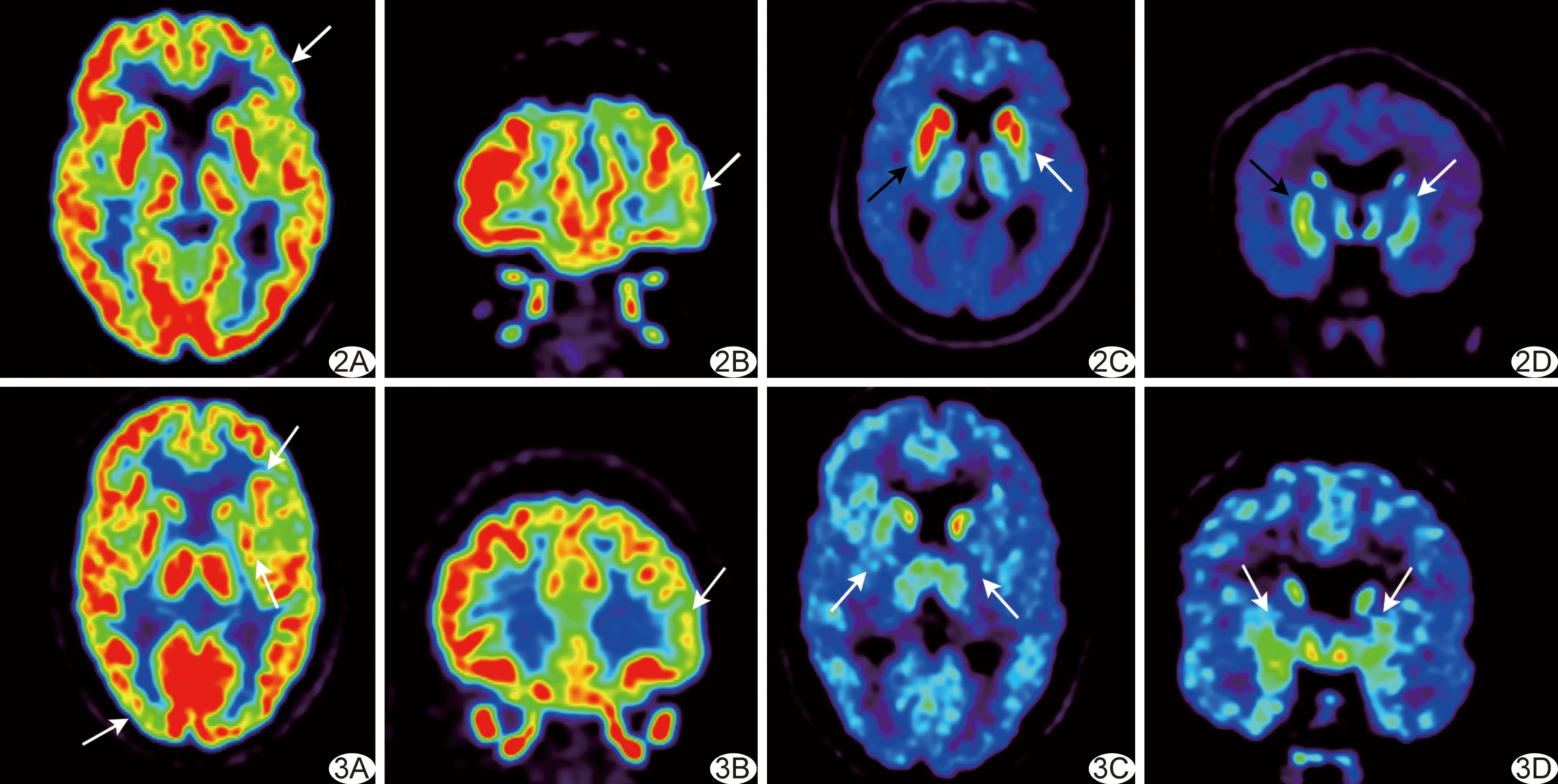
圖2 患者男,61歲,早期PD A、B.18F-FDG PET軸位及冠狀位示左側額葉皮層代謝減低(箭); C、D.18F-FP-DTBZ PET軸位及冠狀位示雙側殼核放射性分布不對稱,左側殼核(白箭)及右側殼核后部(黑箭)放射性攝取明顯減低,左側明顯 圖3 患者女,65歲,中晚期PD A.18F-FDG PET軸位示左側額葉、右側顳枕葉皮層及左側基底核代謝減低(箭); B. 18F-FDG PET冠狀位示左側額葉代謝減低(箭); C、D.18F-FP-DTBZ PET軸位及冠狀位示雙側尾狀核及殼核(箭)放射性分布減低
表1 PD組與對照組尾狀核、殼核前部及殼核后部18F-FP-DTBZ SUV比較(±s)

表1 PD組與對照組尾狀核、殼核前部及殼核后部18F-FP-DTBZ SUV比較(±s)
組別尾狀核殼核前部殼核后部PD組(n=28)2.94±0.831.98±0.561.61±0.43對照組(n=10)3.16±0.343.37±0.343.28±0.36t值1.8436.86411.518P值0.118<0.001<0.001
表2 早期PD亞組、中晚期PD亞組與對照組間尾狀核、殼核前部及殼核后部18F-FP-DTBZ SUV比較(±s)

表2 早期PD亞組、中晚期PD亞組與對照組間尾狀核、殼核前部及殼核后部18F-FP-DTBZ SUV比較(±s)
組別尾狀核殼核前部殼核后部早期PD亞組(n=20)3.06±0.882.15±0.561.73±0.41中晚期PD亞組(n=8)2.69±0.711.66±0.401.41±0.42對照組(n=10)3.16±0.343.37±0.343.28±0.36F值3.36754.54386.991P值0.041<0.001<0.001
表3 雙側肢體癥狀亞組左右側尾狀核、殼核前部及殼核后部18F-FP-DTBZ SUV比較(±s,n=14)

表3 雙側肢體癥狀亞組左右側尾狀核、殼核前部及殼核后部18F-FP-DTBZ SUV比較(±s,n=14)
側別尾狀核殼核前部殼核后部左側2.54±0.671.59±0.381.46±0.39右側2.49±0.741.63±0.381.45±0.39t值-0.8310.673-0.244P值0.4270.5180.812
表4 單側肢體癥狀亞組肢體癥狀側與癥狀對側尾狀核、殼核前部及殼核后部18F-FP-DTBZ SUV比較(±s,n=14)

表4 單側肢體癥狀亞組肢體癥狀側與癥狀對側尾狀核、殼核前部及殼核后部18F-FP-DTBZ SUV比較(±s,n=14)
側別尾狀核殼核前部殼核后部肢體癥狀側3.13±0.852.41±0.671.89±0.55癥狀對側3.13±0.722.15±0.361.62±0.29t值-1.907-2.277-2.972P值0.0830.0040.007
2.218F-FP-DTBZ PET顯像 對照組雙側尾狀核及殼核18F-FP-DTBZ攝取呈對稱性均勻分布,未見放射性異常分布稀疏或缺損區,見圖1B。早期PD亞組雙側尾狀核18F-FP-DTBZ攝取呈對稱性均勻分布,中晚期PD亞組雙側尾狀核放射性分布較對照組稀疏。PD組殼核18F-FP-DTBZ攝取較對照組稀疏。見圖2C、2D、3C、3D。
PD組尾狀核18F-FP-DTBZ SUV與對照組差異無統計學意義(P=0.118),殼核前部及后部SUV均低于對照組(P均<0.001),見表1。早期PD亞組、中晚期PD亞組與對照組間尾狀核、殼核前部及后部18F-FP-DTBZ SUV比較總體差異均有統計學意義(P均<0.05),見表2;早期PD亞組尾狀核18F-FP-DTBZ SUV與對照組比較差異無統計學意義(P>0.05),殼核前部及后部18F-FP-DTBZ SUV分別較對照組減少36.20%和47.26%,差異有統計學意義(P均<0.01);中晚期PD亞組尾狀核、殼核前部及后部18F-FP-DTBZ SUV較對照組分別減少14.87%、50.74%及57.01%,差異均有統計學意義(P均<0.05)。
PD組患者尾狀核18F-FP-DTBZ SUV與UPDRS Ⅲ運動評分、H-Y分期均無明顯相關性(P均>0.05);殼核前部18F-FP-DTBZ SUV與UPDRS Ⅲ運動評分、H-Y分期均呈負相關(r=-0.463、-0.564,P=0.002、0.001);殼核后部18F-FP-DTBZ SUV與UPDRS Ⅲ運動評分、H-Y分期均呈負相關(r=-0.412、-0.585,P=0.005、0.001)。
2.318F-FP-DTBZ PET聯合18F-FDG PET顯像 14例雙側肢體癥狀亞組患者中,左側與右側尾狀核、殼核前部及后部18F-FP-DTBZ SUV差異均無統計學意義(P均>0.05),見表3;其中雙側大腦皮層18F-FDG代謝減低8例,單側皮層代謝減低4例,雙側皮層無代謝減低2例。14例單側肢體癥狀亞組患者中,雙側殼核18F-FP-DTBZ攝取呈不對稱性,肢體癥狀對側殼核前部及后部SUV較癥狀側減低(P均<0.05),尾狀核SUV差異無統計學意義(P=0.083),見表4;其中癥狀對側大腦皮層18F-FDG代謝減低9例,雙側皮層代謝減低3例,雙側皮層無代謝減低2例。
3 討論
目前診斷PD和評估PD病情主要依靠癥狀及體征,缺乏客觀的生物學指標,尤其是疾病早期,臨床誤診率高達25%[4]。大腦額葉與控制軀體運動相關,頂葉與軀體感覺相關,顳葉與語言、記憶等相關,枕葉與視覺的整合相關;PD患者出現靜止性震顫、運動遲緩、肌強直等軀體癥狀可能與上述部位受損有關[5]。
PD患者存在廣泛的大腦皮層代謝減低[6],且隨著患者認知功能下降,其腦部葡萄糖代謝減低的范圍和程度逐漸增加[7-8]。本研究結果顯示82.14%(23/28)PD患者額葉、頂葉、顳葉及枕葉代謝減低,腦代謝減低程度以首發癥狀的對側更為明顯。PD早期,基底核代謝增加;隨著疾病進展,開始表現為代謝正常,之后則表現為代謝減低[9]。Akdemir等[9]觀察7例PD患者的18F-FDG PET腦顯像,2例雙側基底核代謝減低,2例單側代謝減低,2例代謝正常和1例代謝增加。筆者前期對15例PD患者進行定性分析[10],發現3例基底核低代謝,定量分析發現10例基底核代謝減低。有學者[11]采用18F-FDG PET顯像結合統計參數圖(statistical parametric mapping, SPM),發現PD患者中央前回、丘腦、豆狀核葡萄糖代謝增加,而前額葉運動區及頂枕部代謝減低。
研究[12-13]發現健康受試者在黑質、紋狀體、杏仁核、海馬等區域存在18F-FP-DTBZ高攝取,而在皮層和小腦攝取很低,只有紋狀體的約1%。在PD患者中,隨病情進展,黑質紋狀體神經元中結合18F-FP-DTBZ逐漸減少,首先影響殼核后部,隨后是殼核前部、尾狀核以及黑質[14]。Okamura等[15]利用VMAT2顯像研究17例PD患者和6名健康志愿者,發現VMAT2水平在殼核后部減低81%、殼核前部減低70%、尾狀核減低48%。Hsiao等[14]對PD患者進行VMAT2顯像,發現輕度PD患者尾狀核及殼核的VMAT2水平分別減少21.50%和58.20%,中度PD患者分別減少60.75%和79.49%,而重度PD患者分別減少63.94%和83.20%。本研究結果顯示,早期和中晚期PD患者殼核的18F-FP-DTBZ SUV與對照組比較均明顯減低,而早期PD患者尾狀核SUV與對照組比較差異無統計學意義,提示其可能與病情嚴重程度有關。
在出現臨床癥狀之前,生物標記物對于早期診斷PD尤為重要。采用不同示蹤劑的多巴胺顯像研究[14-15]表明,紋狀體放射性攝取與臨床嚴重程度相關,包括H-Y分期、病程、UPDRS Ⅲ以及UPDRS其他部分評分等。本研究結果表明殼核18F-FP-DTBZ SUV與UPDRS Ⅲ運動評分、H-Y分期呈負相關,提示18F-FP-DTBZ PET顯像是早期發現PD多巴胺能神經元功能減退的敏感指標。
PD患者18F-FP-DTBZ PET顯像的特征性表現為癥狀對側紋狀體18F-FP-DTBZ攝取明顯減低[15]。本研究觀察不同肢體癥狀的PD患者,發現無論臨床表現為單側還是雙側肢體癥狀,殼核均被累及;一側肢體癥狀更為嚴重時,對側殼核的18F-FP-DTBZ放射性攝取減低程度更為明顯,可能與PD患者病理學上黑質受損表現不對稱有關,即起病肢體對側的黑質—紋狀體通路損害較起病側更為嚴重;而對側皮層18F-FDG葡萄糖代謝減低也更為明顯。
總之,18F-FDG及18F-FP-DTBZ雙示蹤劑聯合PET/CT顯像可反映腦葡萄糖代謝和多巴胺能神經元突觸前膜的情況,分析大腦葡萄糖代謝水平以及VMAT2水平,為診斷PD和評估病情提供全面信息,有望成為診斷PD的生物學指標。

