急性心力衰竭診斷治療進展
張潮 綜述 徐俊波,2 審校
(1.遵義醫學院,貴州遵義563003;2.成都市第三人民醫院心內科,四川成都610031)
急性心力衰竭(acute heart failure,AHF)是一種心血管內科常見危重癥[1-2],需要醫師立即關注、診斷和處理。流行病學調查顯示,AHF已成為年齡>65歲患者住院的主要原因,且預后極差[2]。一項涉及66 547例心力衰竭患者的回顧分析顯示,AHF患者男/女性中位生存期為1.47/1.39年[3],隨著人口老齡化的到來,如何盡早、盡快地識別并處理AHF是每個醫務工作者不得不面對的課題。
近年來,針對AHF的診斷和治療有了長足進展,歐洲心臟病學會、中華醫學會心血管病分會分別于2016年和2014年發布了各自的心力衰竭診療指南。現依托指南并參閱近年發表的相關文獻,對AHF的診療做一闡述。
1 評估與診斷
AHF是指心力衰竭癥狀和/或體征迅速發生或惡化,具有起病急、進展快、預后差的特點,對其盡早識別并實施干預有更多潛在獲益[4],因而是治療的重中之重。
對于疑似AHF的患者,首先應當明確患者有無心源性休克或呼吸衰竭,并通過初步檢查除外引起患者癥狀的其他疾病。在此基礎上再進一步除外急性冠脈綜合征(acute coronary syndrome,ACS)、高血壓急癥、心律失常、急性心臟機械性損害、急性肺栓塞后,診斷即可成立[1]。需注意的是,在這一過程中,醫師不可拘泥于傳統的內科診療流程,而應“邊治療、邊診斷”,對可能危及患者生命的急癥及時進行處理(圖1)。
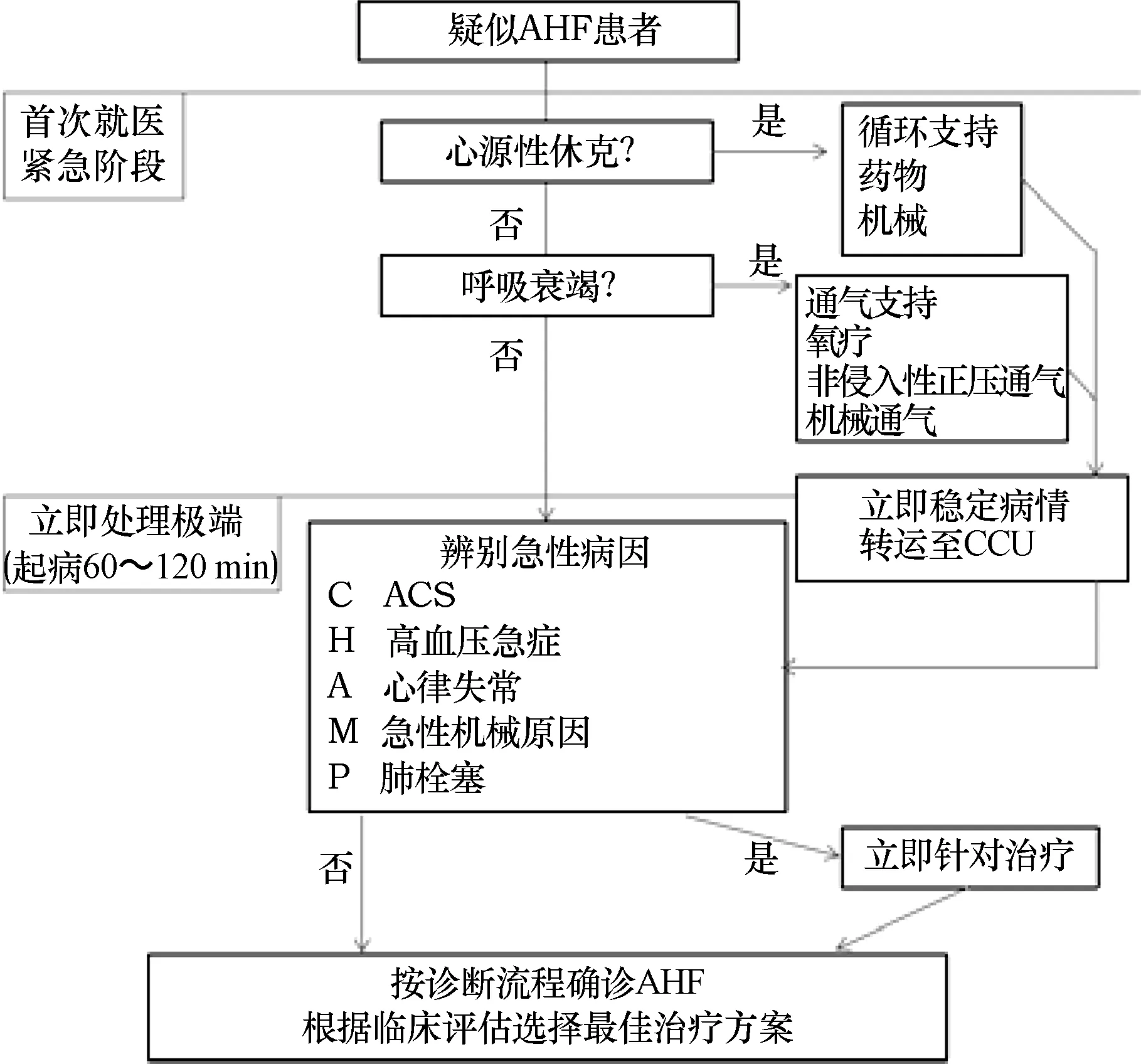
圖1 AHF患者的初始管理
在確診AHF后,應對患者進行進一步的評估,包括詳盡的體格檢查、X射線胸片、心電圖以及超聲心動圖等。在進行體格檢查時,應著重評估患者有無充血、低灌注的癥狀、體征,為下一步治療提供指導。同時指南指出,對AHF患者進行血流動力學監測對評估患者病情、指導治療、評估預后大有裨益[1-2]。
除上述檢查外,血清學檢查對于患者病情的評估以及輔助檢出AHF的病因及誘因有著重要意義,如血漿鈉尿肽水平[腦鈉肽(BNP)、氨基末端腦鈉肽前體(NT-proBNP)、心房利鈉肽前體(MR-proANP)]以及心肌肌鈣蛋白、血尿素氮、肌酐、電解質(鈉、鉀)、肝功能、促甲狀腺激素、葡萄糖、全血細胞計數、D-二聚體等[1-2]。
由于鈉尿肽的高度敏感性,在臨床工作中常用BNP/NT-proBNP作為評估AHF的首選指標。如BNP<100 pg/mL或NT-proBNP<300 pg/mL,則可排除AHF。指南指出,BNP/NT-proBNP水平與AHF患者心力衰竭癥狀的嚴重程度相關,同時也是AHF患者院內死亡的獨立預測因素。MR-proANP對AHF同樣有陰性預測意義(MR-proANP<120 pg/mL可除外AHF),近年來隨著認識的不斷加深,其對于急性心肌梗死全因死亡以及主要心血管不良事件方面的預測價值也逐步被發現[5]。
需注意的是,對于一些失代償的終末期心力衰竭及一過性的右側AHF,鈉尿肽水平可能降低。
除上述指標之外,仍有許多臨床和實驗變量是AHF住院并發癥和長期預后的獨立預測指標,但其影響尚未完全明確或應用范圍較小,不做敘述。
2 治療
2.1 一般處理
隨著認識的不斷加深,近年來專家共識指出,對于AHF應當樹立“及時治療(time-to-treatment)”的理念,即在院前就開始采取急救措施,包括無創生命體征監測、氧療、無創輔助通氣以及初步藥物治療等都將對患者轉歸有獲益,同時需盡快將患者轉運至有條件的醫療機構進一步診治[6]。
院內的進一步治療除取坐位、吸氧、管理出入量等一般治療外,為避免病情進一步惡化,需對主要的誘因及病因,如ACS、高血壓急癥、嚴重的心律失常等,采取針對性的治療,同時著重評估患者是否存在血流動力學障礙,并依照患者是否存在充血癥狀分為“干-濕”兩組,再依照外周灌注是否充足將患者進一步分為“冷-暖”兩組,并依據患者所在分組施行進一步治療[1](圖2)。
2.2 藥物治療
2.2.1 利尿劑
利尿劑是AHF治療的基石,尤其是對于負荷過重和有充血癥狀的患者,它可顯著減輕患者的容量負荷,從而使患者癥狀得到迅速改善,對于低灌注的患者,在灌注情況好轉后,亦應使用利尿劑。有證據表明,早期應用利尿劑對患者預后有改善。

圖2 AHF患者按臨床癥狀分類
靜脈注射呋塞米是最常用的AHF一線用藥,靜脈應用呋塞米在利尿作用外亦有一定的擴張血管作用。遺憾的是,目前對于給藥的最佳劑量、時機和方法并無統一定論。一般認為,應在達到充分的臨床效果前提下使用最小劑量,最初靜脈給藥的劑量應與平時的口服劑量相等。新發AHF或無腎衰竭史和既往未使用利尿劑的慢性心力衰竭患者,靜脈推注20~40 mg呋塞米可能有效,而既往用了利尿劑的患者通常需較大劑量,以既往口服劑量的2.5倍使用呋塞米可更顯著地改善呼吸困難并減輕體重,但會導致腎功能暫時惡化,可考慮靜脈推注托拉塞米10~20 mg替代。
對于利尿劑抵抗的患者,除了改善內環境、改變給藥方式外,可考慮加大利尿劑劑量,改用托拉塞米、聯用噻嗪類利尿劑或利鈉劑量的醛固酮受體拮抗劑也是行之有效的。對于因腎血流灌注不足的患者,聯用小劑量多巴胺或萘西立肽增加腎血流量是臨床較為常用的應對措施之一,超濾治療也應納入考慮范圍[1-2]。
近年來,一款精氨酸血管加壓素V2受體拮抗藥——托伐普坦在這一領域嶄露頭角,它通過抑制V2受體介導的通路,抑制無電解質的自由水重吸收而促進其排出。因其對電解質影響較小,故尤其適用于治療伴隨低鈉血癥的AHF患者,它可以在不增加嚴重藥物不良反應發生率的情況下提高低鈉血癥患者的血鈉濃度[7]。托伐普坦的另一大優勢則在于,相比傳統袢利尿劑,可在不激活腎素-血管緊張素-醛固酮系統(RAAS)的情況下維持腎血流量,不會導致腎功能惡化。有研究者在動物實驗中觀察到托伐普坦治療的大鼠的心臟和腎臟中腎素mRNA表達顯著減低,提示托伐普坦可能可抑制RAAS,改善腎循環,維持腎功能,減少心腎損傷[8]。研究顯示,AHF患者使用托伐普坦2周充血癥狀即明顯緩解,2周后癥狀、體征可進一步改善[9]。
2.2.2 血管擴張劑
血管擴張劑是AHF的另一種常用藥物,地位僅次于利尿劑,其主要作用機制為擴張周圍血管而優化前負荷和/或降低動脈張力而減輕后負荷,通過雙重獲益改善心功能。有研究顯示,在發病6 h內應用擴血管藥物可降低死亡率,延遲給藥則與高死亡率相關。由于其具有降壓作用,使用應以收縮壓水平為參考。收縮壓>110 mm Hg(1 mm Hg=0.133 3 kPa)為其安全閾值,但在使用過程中需嚴密監測患者的血壓水平并以此為依據調整維持劑量;而收縮壓<90 mm Hg的患者因可能增加病死率而禁忌使用[1-2](圖3)。
傳統的血管擴張劑為硝酸酯類及硝普鈉,鈣通道阻滯劑因其負性肌力作用可加重心力衰竭而未被推薦。雖然在AHF的治療中不乏硝酸鹽類的身影,但其獲益缺乏強勁證據,新世紀前后的幾個研究肯定了硝酸酯類藥物對AHF的療效,尤其是適用于ACS伴AHF的患者。近年有階段性研究成果顯示,在發病最初24 h之內使用血管擴張劑(萘西立肽、硝酸甘油)比同期使用正性肌力藥(米力農、多巴酚丁胺)可顯著降低住院病死率[10]。
近年來,新型血管擴張劑萘西立肽在臨床應用中大放異彩,其化學本質是重組人BNP,可同時擴張動脈、靜脈及冠狀動脈,改善前負荷、后負荷及心臟血供。同時其還有利尿、抑制RAAS和交感神經系統激活的作用。臨床試驗顯示,該藥的安全性良好,可顯著改善AHF患者的癥狀和血流動力學,降低病死率和住院率,提高存活率,且對不良事件發生率無明顯影響[11]。
2.2.3 正性肌力藥物
在傳統的多巴胺、多巴酚丁胺、強心苷類藥物之外,左西孟旦在臨床工作中逐漸被推廣開來。它是一種具有血管舒張特性的增加Ca2+增敏劑正性肌力藥物,其用于治療AHF、CHF已有10余年的歷史。左西孟旦具有獨特的心臟保護效應,并有可能通過調節細胞因子和神經內分泌信號減輕心肌細胞凋亡或心室重構[12],同時其對腎臟、肝臟、消化道、肺和呼吸肌、中樞神經系統的保護作用[13]亦有益于改善心力衰竭患者的癥狀及預后。早期臨床試驗觀察到其對于失代償的心力衰竭或AHF合并急性心肌梗死患者的短期結局改善,然而大型臨床試驗表明該藥對患者的遠期預后并無改善甚至有較為不利的影響,但仍有meta分析對其在AHF治療中的有效性和安全性做出了肯定[14-16],亦不失為可考慮的選項之一。
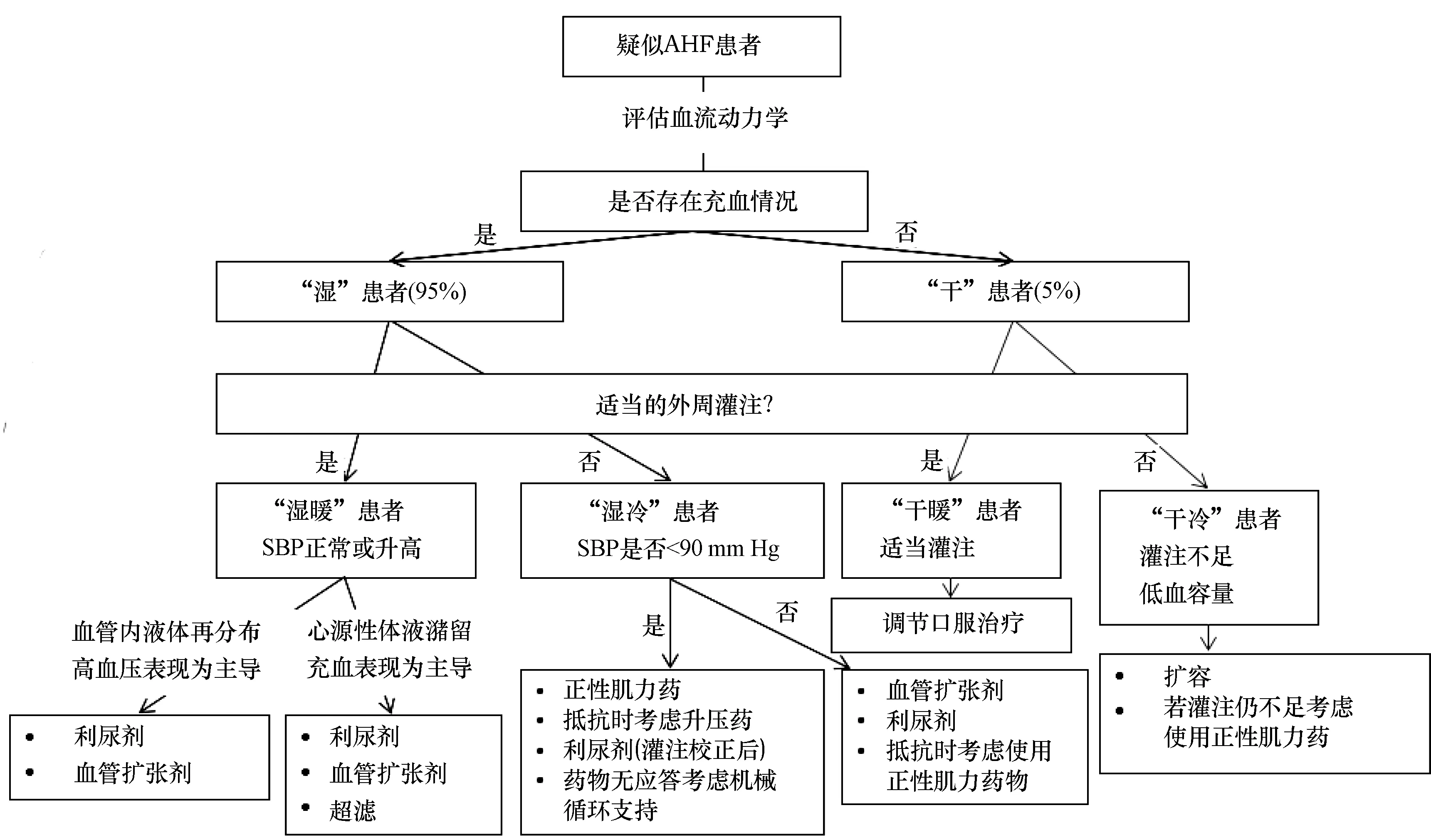
圖3 AHF患者按照臨床情況處理流程
2.2.4 新型藥物
除傳統藥物外,近年來,伊伐布雷定和沙庫巴曲/纈沙坦也因獲益確切而被指南推薦為射血分數降低的心力衰竭治療的基石藥物,應納入考慮[1-2]。
伊伐布雷定是第一個特異性心臟起搏電流抑制劑,具有特異性降低心率的作用,其相關的動物實驗及臨床研究也在日益增多。 SHIFT的子研究顯示,伊伐布雷定能顯著減少左室射血分數≤35%和靜息竇性心率≥70次/min的心力衰竭患者的收縮末期和舒張末期容積指數,相對改善心臟泵血功能、逆轉心臟重構、降低心率[17],進而使患者獲益。
沙庫巴曲/纈沙坦是第一種RAAS和腦啡肽酶雙重阻斷劑,避免了單獨應用腦啡肽酶抑制劑引起致死性不良反應(嚴重血管性水腫),且降低了腎功能損傷、高血鉀及咳嗽等不良反應發生率,有效降低心力衰竭患者的住院率及病死率,改善臨床癥狀,提高生活質量[18]。
2.2.5 其他藥物
包括升壓藥、血管緊張素轉換酶抑制劑、β受體阻滯劑、抗凝劑、阿片類藥物、抗焦慮藥及鎮靜藥均在一定情況下有所應用,在此不做贅述。
2.3 非藥物治療
相比于藥物治療,非藥物治療可以顯著而迅速地改善患者癥狀。
雙水平氣道正壓通氣呼吸機是一種無創輔助通氣手段,可迅速改善患者低氧血癥、酸中毒等并發癥并減少回心血量,緩解肺淤血。國內的一個meta分析表明,應用雙水平氣道正壓通氣患者組的心功能指標改善方面和臨床總有效率方面較不使用的患者組均顯著改善[19]。
超濾治療可改善容量負荷過重且利尿劑無效患者的癥狀。
伴發胸水患者抽液可緩解呼吸困難,對伴發腹水的患者抽液可緩解癥狀,并通過降低腹內壓部分改善跨腎壓力梯度,從而改善腎臟濾過。
主動脈內球囊反搏、心室輔助裝置可用于在積極治療基礎心臟疾病的前提下短期輔助心臟功能或作為心臟移植或心肺移植的過渡[1]。
體外膜肺氧合(ECMO)是一項新興技術,將血液引出體外后經人工心肺旁路氧合后注入患者動脈或靜脈系統以維持人體臟器組織足夠的氧合血供,可部分地替代心肺功能,具有創傷小、操作簡便、花費較少等優點。
3 新思路
隨著認識的不斷深入,對AHF患者的管理逐漸從發病時延伸到全程,從心內科逐漸延伸到其他科室,從院內逐漸延伸到院外,在此對近年來出現的新思路進行簡介。
3.1 多團隊聯合管理
心力衰竭作為多種心內科疾病的終末期綜合征,其本身診治較為復雜,且主要罹患人群為老年人,往往合并退行性病變及包括認知功能受損和/或抑郁癥在內的多種并發癥,因此在治療過程中需心臟專科醫生、心力衰竭專業護士、家庭醫生、社會工作者、心理醫生、藥劑師、理療師、營養學家等多個團隊和角色通力協作,采取心力衰竭門診隨訪、家庭遠程監控、運動和飲食建議、心理干預等綜合手段共同管理,才能有效地治療和控制心力衰竭[20]。
3.2 心力衰竭易損期
以往多將心力衰竭按病程分為慢性和急性兩類并分別施治,但近年來越來越多的研究開始關注AHF出院后1~6個月這一“過渡時期”。CHARM研究表明,心力衰竭患者出院后1~3個月這一時間段的死亡風險最高[21],稱為“心力衰竭易損期”。因此對AHF患者出院前及“心力衰竭易損期”這一段“圍出院期”的管理尤為重要。
AHF患者的出院指征應滿足出院前24 h血流動力學穩定、無容量超負荷、腎功能穩定、無電解質紊亂、已使用基于循證的口服藥物等。院外應為患者制定個體化的健康宣教方案和自我管理的方案,具體包括復診時間、自我監測的生命體征以及如何調整藥物劑量。研究表明,患者的收縮壓、心率、血鈉、血肌酐、利鈉肽、醛固酮水平均對患者預后有影響,對其進行監測和干預對預后有益,其中對于心率的控制尤其是重中之重。
即將發布的2018年中國心力衰竭指南特別強調,需加強對心力衰竭患者的長期隨訪及綜合管理、多學科管理,管理方案應覆蓋診療全程,實現從醫院到家庭的“無縫銜接”,加強對患者及家屬的健康教育,以提高患者的依從性,降低再入院率。

