茄子對褐紋病的抗性及其生理響應
李 可,金 輝,鄒華芬,高曉敏,閆海霞,王琚鋼
(1.中國熱帶農業科學院南亞熱帶作物研究所 廣東湛江 524091;2.內蒙古自治區呼和浩特市環境監測中心站 呼和浩特 010030)
茄子(Solanum melongenaL.)是一種世界性栽培蔬菜,但易遭病害侵襲而造成大面積減產和品質下降[1]。茄子褐紋病(Phomopsis blight of eggplant)是由茄褐紋擬莖點霉(Phomopsis vexans)引起的一種病害,又稱褐腐病、干腐病,與黃萎病(EggplantVerticilliumwilt)、青枯病(Eggplant bacterial wilt)并稱為茄子的三大病害[2]。該病多在高溫多雨季節發生,初期并無明顯癥狀,一旦出現明顯癥狀會嚴重影響茄子的商品價值[3]。依據陳姍姍等[4]的介紹,茄子褐紋病發病癥狀為:發病葉片病斑呈圓形或不規則形,邊緣暗褐色,中間為灰白色至淡褐色病斑,其輪生許多黑色小點粒;果實上產生近圓形凹陷病斑,初為淺褐色,后變為暗褐色;病斑上常密生同心輪紋狀排列的小黑點。廣東省作為“南菜北運”主產區之一,冬季潮濕多雨,茄子褐紋病的發病率高,一般腐果率達30%~40%,留種田內發病更為嚴重,給茄子種植戶和育種工作者帶來極大困難[3]。
目前關于茄子褐紋病的研究相對較少,Mahadevakumar等[5]調查了印度卡納塔克邦茄子褐紋病流行的主要時間、發病率,并對病原菌進行了分子表征;黃蔓葉片提取物[1]、苯并咪唑[2]和木霉屬真菌(Trichodermaspp.)[3]均被證實可抑制茄子褐紋病的發生和病原菌生長;陳姍姍等[4]系統綜述了國內茄子抗褐紋病育種工作。但目前茄子在褐紋病病原菌侵染后的生理生化抗性響應機制尚不清楚[6]。從病原菌微生物接觸寄主開始,植物自身會發生一系列生理生化反應以應對病原菌侵染,抗性響應系統越強,植物對病原菌的抵抗力越高[7]。近年來,大量植物病害相關研究表明,超氧化物歧化酶(Superoxide Dismutase,SOD)、過氧化物酶(Peroxidase,POD)、過氧化氫酶(Catalase,CAT)、多酚氧化酶(polyphenoloxidase,PPO)、苯丙氨酸解氨酶(Phenylalanine ammonialyase,PAL)等保護酶和丙二醛(Malondialdehyde,MDA)在植物的抗病應答中發揮著重要作用[8-9];SOD、POD和CAT是植物體內主要的活性氧清除酶,可幫助植物抵抗活性氧帶來的侵害。PPO可催化酚類物質氧化成醌,對病原菌的繁殖起到抑制作用[10]。而POD也被證實參與苯酚類和植保素等物質的合成[11]。PAL是植物抗病代謝過程中莽草酸途徑的關鍵酶和限速酶,與細胞內木質素生成和沉淀有關[12],可誘導植物細胞壁形成物理屏障物,阻止病原菌侵入細胞內,進而參與植物的抗病過程[9]。
筆者首先對疑似發生褐紋病的茄子葉片及果實中病原菌進行分離純化,利用純化病原菌和不同茄子材料進行了盆栽試驗,然后測定不同材料的發病率,根據發病率計算出苗期和結果期病情指數。然后測定接種病原菌后的8 d內,不同茄子材料葉片內SOD、POD、CAT、PPO、PAL活性及MDA 含量的變化規律,以期從生理生化水平揭示不同茄子材料對褐紋擬莖點霉的抗性響應機制,研究結果可為篩選茄子抗褐紋病品種提供理論依據。
1 材料和方法
1.1 病原菌的分離純化及鑒定
2016年在中國熱帶農業科學院南亞熱帶作物研究所實驗基地采集癥狀明顯的疑似病果,后續試驗在海南省熱帶作物營養重點實驗室進行。將疑似病果用無菌水沖洗干凈后晾干,然后用75%乙醇進行表面消毒。用滅菌的解剖刀片在病健交界處切取果實組織,用吸水紙吸取多余水分,然后將其接種于PDA培養基中[13],每皿接入5塊發病組織,置于28℃恒溫培養箱中培養。菌落長滿整個培養基之后再進行2~3代的繼代培養,純化后的病原菌置于4℃冰箱中備用。
將純化后的病原菌繼續培養,待其在PDA培養基上長出黑褐色斑點,用滅菌牙簽挑取斑點置于載玻片上,用LEICA DM 2500顯微鏡鏡檢,觀察分生孢子器形狀及孢子大小,并依據真菌鑒定手冊[14]和中國真菌志[15]中所介紹的菌落形態、分生孢子器形態對病原菌進行鑒定。
1.2 供試茄子材料
供試茄子品種為市售‘黑貴長茄’和‘長豐二號’。2017年4月在中國熱帶農業科學院南亞熱帶作物研究所試驗基地進行試驗。將茄子種子催芽后播于育苗穴盤,育苗基質為丹麥品氏托普泥炭營養土。當幼苗第2片真葉完全展平時,將其移栽至10 cm×10 cm的營養缽中,轉移至試驗基地遮陽棚中,以供后續試驗。
1.3 苗期抗病性鑒定
待茄子苗齡達60 d時,采用噴霧法接種[16],配制孢子濃度為 1×106個·mL-1病原菌懸浮液[17],在葉片正反面均勻噴施,用硫酸紙袋將植株葉片套袋2 h以保證病菌孢子全部接種在葉片上。對照處理噴施等體積無菌水。3次重復,每次重復10盆,每盆1株,正常田間管理。接菌10 d后,每隔2 d進行1次病情調查。
葉片侵染的分級標準如下:
0級:健康,葉片不發病;
1級:輕微感病,葉片只有1/3面積出現輕微黃色病斑癥狀;
2級:癥狀明顯,葉片只有1/2面積有不規則形的黃色病斑;
3級:癥狀較重,葉片上有大面積黃色或者褐色病斑,邊緣略有卷枯;
4級:所有葉片都感病,多為褐色枯斑,有少數葉片凋落;
5 級:整株死亡[5]。
病情指數計算公式如下:

1.4 結果期抗病性鑒定
當苗齡達到60 d時,將其移栽至規格為上口直徑40 cm、基部直徑35 cm、高45 cm的花盆中,正常肥水管理,待植株掛果達到3~6個,果實長度約為15~20 cm時,采用“十字”法進行活體果接菌試驗[18],將健康的茄子果實表面用無菌水沖洗干凈,濾紙拭去多余水分,用滅菌解剖刀在果實近果蒂5 cm和靠近果尾5 cm處分別劃5 mm×5 mm的“十字”傷口,用直徑6 mm的圓形濾紙片蘸取濃度為1×106個·mL-1的孢子懸浮液,再用滅菌鑷子取圓形濾紙片放于果實“十字”傷口處,然后將其放置在溫度為28~30℃、相對濕度為70%的氣候培養箱中進行培養。對照為無菌水處理。每株3個果實,每盆1株,每次重復10盆,3次重復。接菌處理7 d后統計發病率,每隔1 d進行1次調查,共調查5次,統計發病果實上的病斑面積,按病斑面積占茄子果實單面表面積百分比(LSP)進行分級。根據蔬菜病蟲害診斷中茄子褐紋病診斷標準[19]診斷病害。
果實侵染的分級標準如下[18]:
0級:果實無發病;
1級:果實出現水漬狀病斑,LSP≤10%;
2級:果實出現淺褐色橢圓形四陷斑10% 3級:果實出現淺褐色至暗褐色的圓形或者近圓形四陷斑,30% 4級:病果果肉凹陷呈腐爛狀具有明顯的同心輪紋,40% 5級:病果果肉凹陷腐爛,病部密生許多黑色小點粒,LSP>50%。 將新育好的茄子幼苗按照方法1.3進行接菌培養。在培養的過程中,每次重復30株進行生化指標的測定:10株測定SOD、POD和CAT活性,10株測定PPO和PAL活性,10株測定MDA含量。在接菌的 0、2、4、6、8 d 分別取葉片,用試劑盒(南京建成生物工程研究所)測定5種防御酶活性和MDA含量。各時間點變化率計算公式如下: 正值即為增幅,負值即為降幅。 數據采用MicrosoftExcel2010處理,用SPSS20.0進行單因素隨機區組試驗方差分析,使用Origin Pro 8軟件繪圖。 從茄子疑似病果中分離微生物,在27℃下PDA培養基上培養6 d后,菌落長滿培養基,再經過2次繼代培養,純化完成,此時菌落形態呈白色毛絨狀,均勻分散在培養基上(圖1 a);繼續培養6 d后,在其白色絨毛上發現了散生的黑色小點(圖1 b),疑為病原菌的分生孢子器,顯微鏡下觀察,其形狀接近橢圓形(圖 2 a),大小約為(5~8)μm×(2~8)μm(圖2 b)。依據菌落形態、分生孢子器形態大小以及真菌鑒定手冊和中國真菌志中的描述,確定疑似病果中分離純化的微生物為褐紋病病原菌茄褐紋擬莖點霉。 圖1 茄子褐紋病病原菌在PDA培養基上純化的菌落形態(a)及分生孢子器(b) 圖2 不同顯微鏡倍數(a:100倍,b:400倍)下褐紋病菌分生孢子器鏡下形態 不同品種茄子回接病原菌后,均出現褐紋病感染癥狀。苗期葉片接種后2個品種的發病率均較對照差異顯著,‘黑貴長茄’發病率達到64.98%,而‘長豐二號’為47.61%(圖3-A),且2個品種之間存在顯著差異;2個品種苗期接種后的病情指數同樣符合此規律,‘長豐二號’的病情指數顯著低于‘黑貴長茄’(圖3-B)。而結果期回接試驗也表明,‘長豐二號’的果實發病率和病情指數均低于‘黑貴長茄’,且二者之間差異顯著(圖3)。‘黑貴長茄’較‘長豐二號’更容易發生褐紋病。因此,將‘黑貴長茄’作為本次研究中的易感褐紋病材料,將‘長豐二號’為本次研究的較抗褐紋病材料。 圖3 茄子苗期及結果期接種鑒定的發病情況 接種褐紋病病原菌后,2種茄子的酶活性變化均呈現先增加后降低的趨勢。‘長豐二號’的SOD酶活性變化率一直高于‘黑貴長茄’;在接菌第2天達到峰值,‘長豐二號’和‘黑貴長茄’的SOD酶活性變化率分別達到14.88%和12.26%(圖4-A)。由圖4-B可知,接種后2個品種茄子的POD酶活性變化率均逐步增加,且酶活性變化率差異顯著;‘長豐二號’和‘黑貴長茄’的POD酶活性變化率均在接菌4 d后達到峰值,分別達到26.31%和15.49%,隨后二者的酶活性變化率逐漸下降。CAT酶活性(圖4-C)和PPO酶活性(圖4-D)的變化規律和POD酶活性的變化規律幾乎完全相同。PAL酶活性變化規律(圖4-E)也與上述3種酶基本類似,不同的是,在接種病原菌第2天后,2種茄子的PAL酶活性值達到最大,之后呈現急劇下降趨勢。而由圖4-F可知,接種褐紋病病原菌后2種茄子的MDA含量變化率差異顯著,在接種第4天達到峰值,二者的變化率分別為21.31%和10.03%,之后MDA含量迅速下降。 圖4 不同抗性茄子接菌褐紋病菌后超氧化物歧化酶(SOD)(A)、過氧化物酶(POD)(B)、過氧化氫酶(CAT)(C)、多酚氧化酶(PPO)(D)、苯丙氨酸解氨酶(PAL)(E)活性和丙二醛(MDA)(F)含量的變化 茄子褐紋病的病原菌為茄褐紋擬莖點霉,這在許多研究中已被證實[1-5]。本研究從疑似感染褐紋病的茄子果實中純化培養微生物,菌落、分生孢子器的形態特征均符合真菌鑒定手冊中的介紹;苗期和結果期的病原菌回接試驗也證實,2個品種的茄子在回接微生物后產生了明顯的褐紋病感染癥狀[5],因此確定純化后的微生物為茄褐紋擬莖點霉。病情指數是全面考慮發病率與嚴重程度的綜合指標,和發病率相比,更能反映植物對病害的抗性響應。和‘長豐二號’相比,‘黑貴長茄’在回接試驗中苗期和結果期的發病率比‘長豐二號’高17.37%和42.99%,而病情指數則高出0.22和0.4。這表明,‘長豐二號’不僅能降低褐紋病的發病率,更主要的是降低了發病的嚴重程度。因此在后續茄子育種工作中,可考慮將‘長豐二號’作為一個抗褐紋病材料。 植物體受到病原菌侵染時可引發植物產生活性氧,進而導致氧化脅迫[20];活性氧對病原菌有一定的殺傷或抑制作用,產生活性氧的量與其自身的抗性有關,過多的活性氧則影響植物自身的生理活動,引發植物產生膜脂過氧化反應,導致細胞死亡[21];而SOD、POD及CAT是植物體內主要活性氧清除酶[22]。在本研究中,未接菌的2個處理中,‘長豐二號’的SOD、POD和CAT酶活性均高于‘黑貴長茄’;接種褐紋病病原菌后,2個材料葉片內的3個指標較各自對照均有所升高,但‘長豐二號’的3個指標與對照(未接菌)相比的增加量要高于‘黑貴長茄’;這表明植株體內的保護酶活性大小與品種的基礎抗性有關[23],且‘黑貴長茄’葉片內的活性氧清除系統對來自外界脅迫的響應速度較為遲緩。無論是‘長豐二號’還是‘黑貴長茄’,保護酶活性在達到峰值后迅速下降,這意味著植物體內的保護酶對活性氧的清除能力在一定時間內有效,保護酶活性過高或者過低并不能一直清除多余活性氧[24]。PPO也被認為是植物體內活性氧清除酶,但它也是引起植物褐變的主要因素,2種茄子接菌后,葉片內PPO酶活性呈現先升高后降低的趨勢,這可能與植株體內活性氧清除系統的自我調節有關[25]。葉片內PAL酶活性在接菌第2天達到最大值,‘長豐二號’較對照變化最顯著,PAL酶活性達到最大。這說明‘長豐二號’在受到病原菌侵染時,可以形成更多的木質素或者其他抗病的次生代謝產物,來增加自身的抗病性和免疫能力[26]。MDA含量與茄子褐紋病的抗性呈負相關關系,此結果與前人研究的結果一致[27],茄子在受到褐紋病病原菌侵染后,‘長豐二號’MDA含量的變化率低于‘黑貴長茄’,說明‘長豐二號’受到病原菌侵害后膜質傷害程度小,這與‘長豐二號’有一個較強的活性氧清除系統是一致的。1.5 葉片生化指標測定

1.6 數據分析
2 結果與分析
2.1 病原菌鑒定
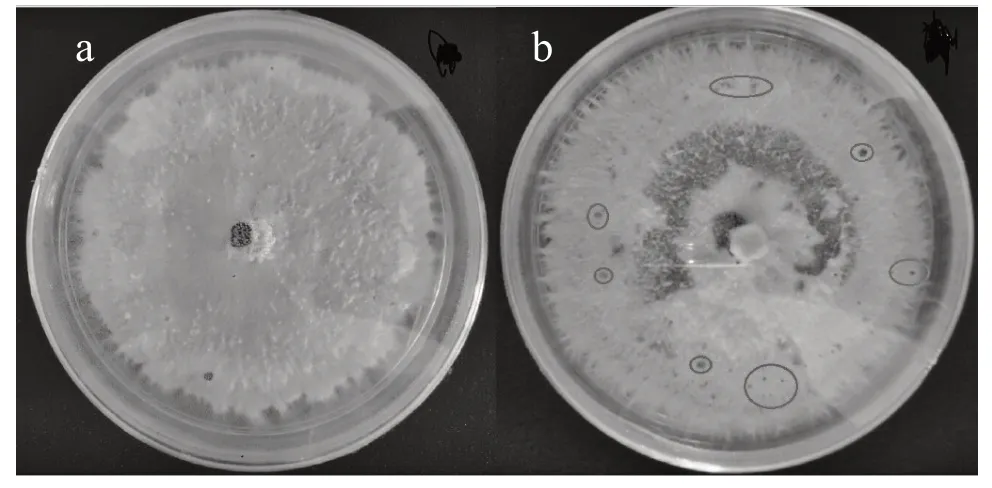
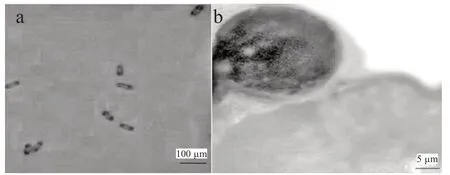
2.2 不同品種苗期和結果期對病原菌的抗性
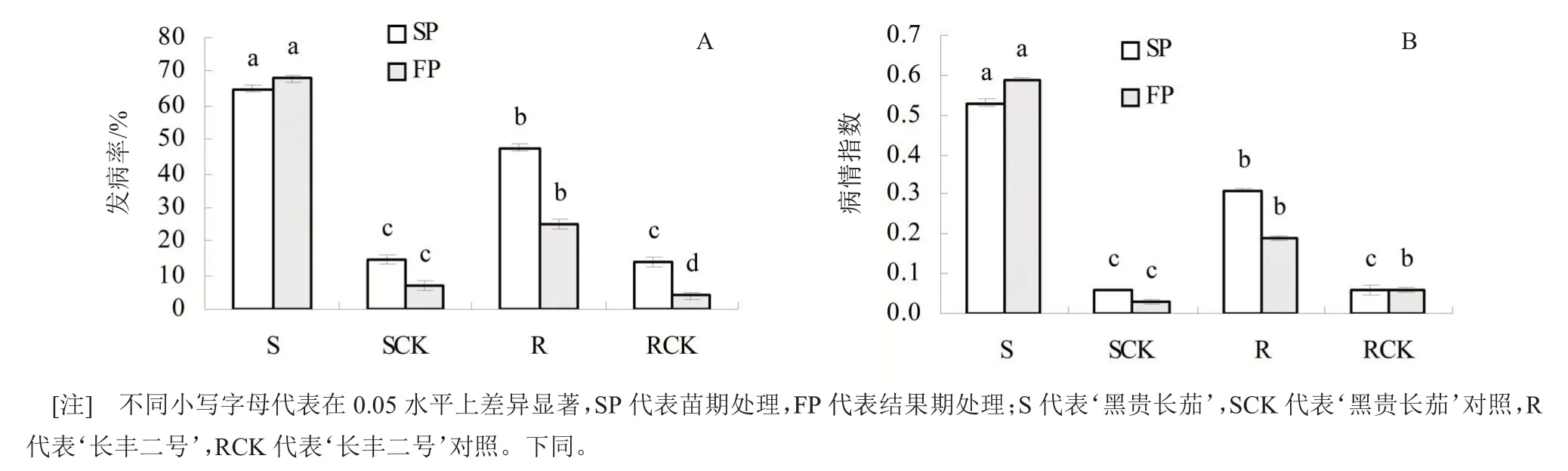
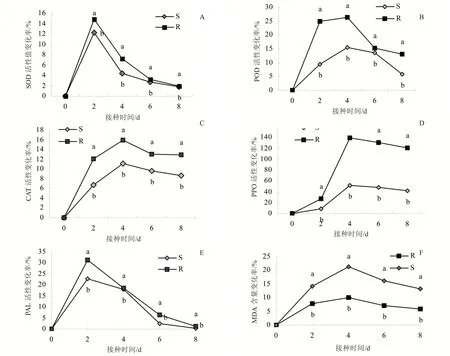
2.3 不同抗性茄子感染病原菌后葉片生化指標的變化
3 討論

