初始溫度對丙酮爆炸下限的影響
高志崇
(泰山學院 化學化工學院,山東 泰安 271000)
可燃氣體與空氣或氧氣混合時并不是在任何濃度范圍內均可以發生爆炸,而必須是在一定的濃度范圍內才能夠發生爆炸。其中,能夠發生爆炸的最低濃度為爆炸下限,能夠發生爆炸的最高濃度為爆炸上限。不同的可燃氣體有不同的爆炸極限,即使是同一種可燃氣體在不同的情況下也有不同的爆炸極限,也就是說,多種因素會影響爆炸極限。其中,初始溫度是影響爆炸極限的重要因素。在之前的研究中曾計算了不同初始溫度下甲烷爆炸后體系的溫度與壓力,從計算結果可以看出,不同初始溫度下甲烷爆炸后體系的溫度是很接近的[1]。下面討論丙酮在不同初始溫度、爆炸下限時爆炸后的溫度與壓力,以期對該問題有進一步的認識。
1 恒容熱效應ΔU與光子的波長、數量之間的關系
光是一種非體積功。假設某爆炸反應發出n mol波長為λ的光子,那么,爆炸反應的內能的變化與光子的量及波長之間的關系為[1-5]:

下面利用該公式討論不同溫度下丙酮爆炸反應的極限。
2 丙酮燃燒反應機理
根據丙酮燃燒反應的溫度,提出了丙酮在空氣中燃燒反應的機理[6]。丙酮在空氣中不完全燃燒,形成黑煙,在空氣中燃燒反應的機理為:

丙酮在空氣中不完全燃燒的反應式為:
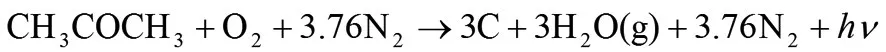
由反應式可以看出,1mol丙酮在空氣中不完全燃燒發出1mol光子。
3 不同溫度下丙酮在爆炸極限時爆炸產生的溫度與壓力
3.1 丙酮在0℃爆炸下限時爆炸產生的溫度與壓力

表1 不同初始溫度下丙酮爆炸的極限[7]及爆炸后溫度與壓力的計算值
0℃ 丙酮爆炸下限為4.2%。取丙酮的量為1mol,則反應前總的氣體的量為n1=mol=23.81mol,空氣的量為22.81mol。按21%O2計算,則nO2=4.79mol,nN2=18.02mol。因而,丙酮在0℃ 爆炸下限時的反應式為:CH3COCH3(g ) +4.79O2+18.02N2=3C(s)+3H2O(g)+3.79O2+18.02N2+hv.反應后氣體物質的量為n2=24.81mol,反應前后氣體物質的量的差值△n(g)=1mol。為方便計算起見,現將某些物質的熱力學性質列于表2。
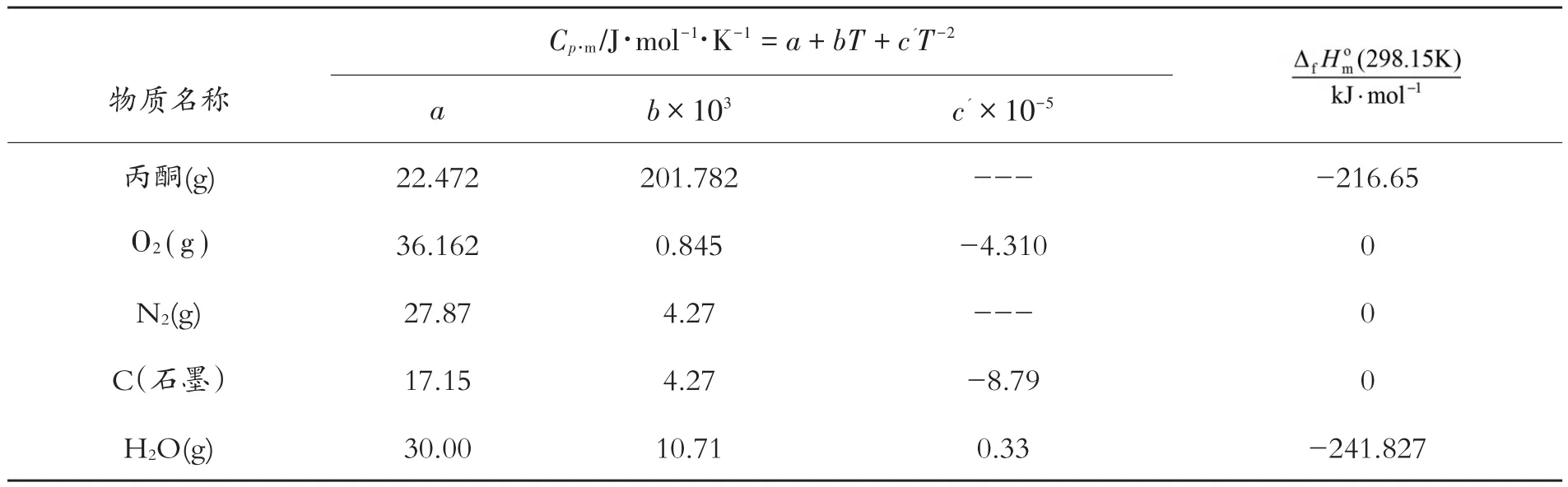
表2 298.15K、101.325kPa下某些物質的熱力學性質[8]
為計算丙酮爆炸反應的溫度與壓力,設計途徑見圖1。假設本文中所有其他均為理想氣體.對于理想氣體和純固體而言,內能和焓僅僅是溫度的單值函數,因而,
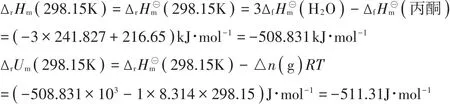
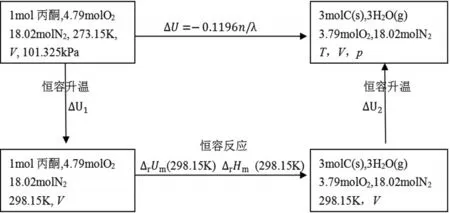
圖1 丙酮在0℃、爆炸下限時設計途徑

?U與溫度T之間的關系式為:

丙酮在空氣中爆炸反應的火焰為紅色,紅色的波長為650-750nm,取λ=750nm進行計算。根據(1)式,則有:
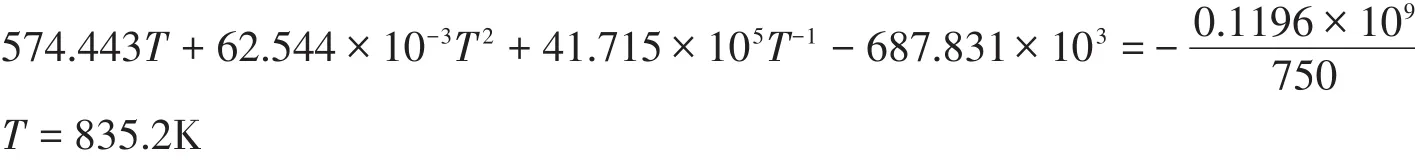
爆炸反應在恒容的條件下進行,因而,爆炸后的壓力為:
即丙酮在0℃、爆炸下限時的爆炸溫度為835.2K,爆炸時產生的壓力為322.83kPa。
3.2 其他溫度下丙酮在爆炸極限時爆炸產生的溫度與壓力
利用相同方法計算丙酮在50℃、100℃爆炸下限時?U與溫度T之間的關系式,進而計算了爆炸后形成的溫度與壓力。取丙酮的量為1mol,不同溫度下丙酮爆炸時?U與溫度T之間的關系式見表3,爆炸后形成的溫度與壓力見表1。

表3 1mol丙酮不同初始溫度、爆炸下限時?U與溫度T之間的關系式

