基礎與素養(yǎng)并舉 物質(zhì)與應用交融
——以元素化合物知識復習為例
■湖南省長沙縣實驗中學 黃景華 張水強
最新的全國高考考試大綱明確指出:“了解常見金屬元素(如 Na、Mg、Al、Fe、Cu等)和常見非金屬元素(如 H、C、N、O、Si、S、Cl等)的單質(zhì)及其重要化合物的制備方法,掌握其主要性質(zhì)及其應用。”從近幾年的高考試題看,元素化合物知識滲入到了大部分試題中,是實驗類試題、工藝流程類試題,乃至化學反應原理類試題的載體和素材;從考查熟悉的物質(zhì)悄悄地演變成考查陌生的物質(zhì),如近幾年高考考查的陌生物質(zhì)有H3BO3、LiFePO4、Na2S2O5、NaClO2、As2S3、As2O5、H3AsO3、H3AsO4、Na3AsO3等。這就要求我們復習時不僅要注意元素化合物基礎知識的儲備,更要注重從原子結(jié)構和元素周期律(表)等學科核心素養(yǎng)層面掌握其性質(zhì)和應用。
一、診斷基礎知識,促進有效落實
2016年高考全國Ⅰ卷第13題的題干中出現(xiàn)了“二元化合物”一詞,2014年高考全國Ⅰ卷第27題中出現(xiàn)了“一元中強酸”“正鹽”和“酸式鹽”等詞匯……在解析相關的高考試題時,有不少同學對試題中出現(xiàn)的這些學科專業(yè)詞匯感到茫然。下面,把這些專業(yè)詞匯逐一鞏固。
1.厘清幾個重要的學科專業(yè)詞匯。
無機物:單質(zhì)和無機化合物的統(tǒng)稱。(摘自《現(xiàn)代漢語詞典》)
二元化合物:由兩種不同元素組成的化合物。
一元酸:一個酸分子最多只能電離出一個氫離子。(摘自“百度百科”)
中強酸:電離常數(shù)(Ka)在10-1~10-4之間的酸(pKa=1~4)。(摘自“百度百科”)
正鹽:既不含能電離的氫離子,又不含氫氧根離子的鹽。正鹽只含金屬陽離子(或NH+4)和酸根離子。正鹽是酸和堿完全中和的產(chǎn)物,但正鹽的水溶液不一定顯中性。(摘自“百度文庫”)
酸式鹽:電離時產(chǎn)生的陽離子除金屬離子(或NH+4)外還有氫離子,陰離子為酸根離子的鹽。(摘自“百度文庫”)
涉及到元素及其重要化合物推斷的高考試題已屢見不鮮,解答好這類試題的前提是,能夠根據(jù)題意準確地推斷出相應的元素或者物質(zhì),這一般需要“調(diào)度”哪些基礎知識呢?
2.梳理元素及其化合物推斷的必備知識。
(1)理解常見單質(zhì)及其重要化合物的轉(zhuǎn)化關系。
①借助轉(zhuǎn)化關系圖,定性掌握物質(zhì)的化學性質(zhì)。《化學1·必修》的“金屬及其化合物”和“非金屬及其化合物”兩章章末處的“歸納與整理”板塊,都有常見單質(zhì)及其重要化合物的轉(zhuǎn)化關系圖,這些圖都比較充分地表現(xiàn)出了常見單質(zhì)及其重要化合物的化學性質(zhì),落實好了,應用起來便能得心應手。
②構建定量關系,深入理解重要物質(zhì)的化學性質(zhì)。以典型的兩性氫氧化物Al(OH)3為例,其電離過程為:
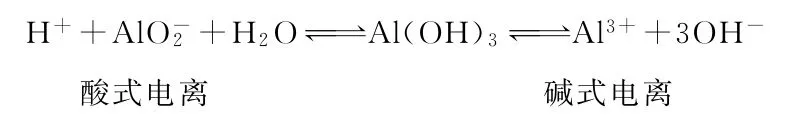
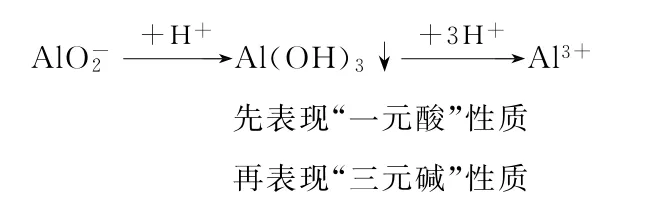
由此可見,Al(OH)3若作酸參加反應時,它是一元弱酸,Al(OH)3若作堿參加反應時,它是三元弱堿。據(jù)此便可建立如下定量關系:

可知1molAl3+與足量OH-作用時,最多消耗4molOH-。同理:
(2)了解滲透到有機化學中的一些無機物體現(xiàn)的性質(zhì)和用途,以及化學反應。Cl2、Br2、Na、NaOH、Na2CO3、CO2、HNO3、H2SO4、H2S、CuSO4、NH3·H2O、AgNO3、KMnO4等無機物都在有機化學中有相關的應用,這其中當屬 Br2、NaOH、H2SO4和KMnO4應用最為廣泛。近幾年的高考試題已經(jīng)涉及這些方面,要引起關注。
(3)了解常見金屬的活動順序和常見非金屬單質(zhì)的活動順序。常見金屬活動順序:K>Ca>Na>Mg>Al>Zn>Fe>Sn>Pb>(H)>Cu>Hg>Ag>Pt>Au;常見非金屬單質(zhì)活動順序:F2>O2>Cl2>Br2>I2>S。識記這兩個順序關系,在進行比較、分析、推斷一些物質(zhì)時,往往能夠提供有效的幫助,尤其是在跟氧化還原反應關聯(lián)度特別大的“電化學基礎”板塊,更可大顯其神功。
(4)彰顯原子結(jié)構和元素周期律(表)對無機物的性質(zhì)和用途的理論支撐。原子的結(jié)構決定了元素在周期表中的位置,也決定了元素的性質(zhì),借助“結(jié)構—位置—性質(zhì)”三者的神秘關系,可比較順利地進行元素的推斷。同理,常見元素的單質(zhì)及其重要化合物的結(jié)構,也決定了相應物質(zhì)的物理性質(zhì)和化學性質(zhì),進而決定了相應物質(zhì)的用途等。利用這層關系推斷(或判斷)物質(zhì)的性質(zhì)和用途的高考試題早已層出不窮。
縱觀近幾年的高考試題,除了推斷類型的試題,利用已經(jīng)給定物質(zhì)的性質(zhì)分析問題,進而解決問題的試題也逐漸熱起來了,如2017年高考全國Ⅰ卷第27題的第(3)小題和2018年高考北京卷第26題的第(4)小題都考查了同一個知識點——溫度稍高時,因H2O2分解而使物質(zhì)的轉(zhuǎn)化率降低。
3.對應典型無機物的性質(zhì)與用途,性質(zhì)與基本實驗操作。
H2O2可作氧化劑,但受熱易分解;當H2O2遇到較強的氧化劑(如酸性KMnO4溶液)時,H2O2也可作還原劑。NH3·H2O不穩(wěn)定,受熱易分解。NH3易液化,液氨常用作制冷劑,這在2017年高考全國Ⅰ卷第12題考查了。HF可刻蝕玻璃,這在2018年高考全國Ⅰ卷第12題考查了。復習H2O2、NH3·H2O、液氨、HF、ClO2、SO2等典型無機物的性質(zhì)時,注意跟其用途對應起來,在分析和解答問題時就不會有阻礙。
把無機物的性質(zhì)與一些化學實驗基本操作對應起來考查,也已經(jīng)成為近年高考試題的新時尚,如2016年高考全國Ⅰ卷第26題第(1)小題的第②問,考查了吸收尾氣中的NH3要選擇那個倒扣漏斗的防倒吸裝置,因為NH3極易溶于水;又如2018年高考天津卷第9題的第(3)小題,要求畫出裝有NaOH溶液的洗氣瓶,用于吸收含有NOx的尾氣。
會推斷元素或者物質(zhì),也會用“對應”等方法分析和解決一些疑難問題了,還得學會用化學語言(如化學方程式等)進行規(guī)范表達,而這個前提是能夠理解基本的化學方程式。
4.透析復分解反應和氧化還原反應兩大類基本化學方程式。
就復分解反應而言,酸、堿、鹽、氧化物之間的轉(zhuǎn)化要求非常熟練,這在最新的高考考試大綱中也是“理解”的能力層次要求,從其中還可以深挖出“強酸制弱酸”“強堿制弱堿”和競爭反應等基本規(guī)律。
就氧化還原反應而言,首先,要熟悉常見元素的化合價,能根據(jù)化合價正確書寫化學式(分子式),或根據(jù)化學式判斷元素的化合價。其次,要了解常見的氧化還原反應,這當然也包括《化學·選修4》中的H2C2O4溶液與KMnO4酸性溶液作用,Na2S2O3溶液與稀硫酸作用等在近幾年高考試題中已經(jīng)頻繁亮相的一些重要的氧化還原反應(前者出現(xiàn)在2015年高考全國Ⅱ卷第13題中,后者出現(xiàn)在2017年高考全國Ⅰ卷第12題中)。再次,要熟練掌握常見氧化還原反應方程式的配平和相關計算。
二、提升學科素養(yǎng),促進思維發(fā)展
1.科學閱讀,引發(fā)思考。
欲解答好試題,讀懂題意,看清設問是前提,否則,要么因無法對題目引發(fā)思考而造成不會解題或者胡亂地解題,要么因曲解設問而導致解題時答非所問。培養(yǎng)主動去抓題干中和設問中的關鍵詞的科學閱讀能力,往往會帶來三個方面的益處:其一是不會因答非所問等非智力因素而造成丟分;其二是對于難度不是很大的試題,往往能夠借助幾個顯性的關鍵詞而迅速架構好清晰的答題邏輯;其三是對于難度較大的試題,也需要借力一些關鍵詞來引發(fā)思考(這是什么→為什么這樣),甚至會將思維引向更深處(怎樣做到的),進而一些被命題人隱藏的信息和知識將逐一暴露出來,這樣就可以解答好試題。
例1次磷酸(H3PO2)是一種精細磷化工產(chǎn)品,具有較強還原性。回答下列問題:
(1)H3PO2是一元中強酸,寫出其電離方程式:____。
(2)H3PO2及NaH2PO2均可將溶液中的Ag+還原為銀,從而可用于化學鍍銀。
①H3PO2中,P元素的化合價為____。
②利用H3PO2進行化學鍍銀反應中,氧化劑與還原劑的物質(zhì)的量之比為4∶1,則氧化產(chǎn)物為____(填化學式)。
③NaH2PO2為____(填“正鹽”或“酸式鹽”),其溶液顯____(填“弱酸性”“中性”或“弱堿性”)。
(3)H3PO2的工業(yè)制法是:將白磷(P4)與Ba(OH)2溶液反應生成PH3氣體和Ba(H2PO2)2,后者再與H2SO4反應。寫出白磷與Ba(OH)2溶液反應的化學方程式:___。
解析:(1)其關鍵詞是“一元酸”“中強酸”,一個H3PO2分子最多只能電離出一個H+,且將其視為弱酸,因此其電離方程式為,而且第(2)小題的第③問的NaH2PO2為正鹽,其溶液顯弱堿性。(2)只要熟悉常見的H元素和O元素的化合價,根據(jù)化學式H3PO2容易判斷出其中P元素的化合價為+1;主題干明示了H3PO2有較強的還原性,與Ag+反應時,Ag+作氧化劑,還原產(chǎn)物為 Ag,H3PO2作還原劑,即,依據(jù)氧化還原反應方程式中得失電子守恒容易判斷氧化產(chǎn)物中P元素的化合價為+5,氧化產(chǎn)物為H3PO4。(3)題干明示了該氧化還原反應中與電子轉(zhuǎn)移直接相關的全部反應物和生成物,因此這實際上是在考查氧化還原反應方程式的配平。
答案:(1)
(2)①+1 ②H3PO4③正鹽 弱堿性
(3)2P4+3Ba(OH)2+6H2O==3Ba(H2PO2)2+2PH3↑
2.學會讀圖,思路暢通。
涉及“圖”的高考試題當下正盛行,主要表現(xiàn)為化學實驗裝置圖、電化學工作原理圖、坐標圖像、圖表和化學工藝流程圖等形式,尤其是化學工藝流程圖以大題的形式連續(xù)出現(xiàn)在了最近兩年的高考試題中。訓練并提高讀圖能力,方可確保解題思路暢通。
例2NaClO2是一種重要的殺菌消毒劑,也常用來漂白織物等,其一種生產(chǎn)工藝如下。
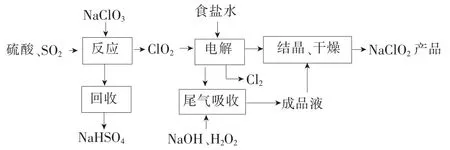
回答下列問題:
(1)NaClO2中Cl的化合價為____。
(2)寫出“反應”步驟中生成ClO2的化學方程式:___。
(3)“電解”所用食鹽水由粗鹽水精制而成,精制時,為除去 Mg2+和Ca2+,要加入的試劑分別為____、____。“電解”中陰極反應的主要產(chǎn)物是____。
(4)“尾氣吸收”是吸收“電解”過程排出的少量ClO2。此吸收反應中,氧化劑與還原劑的物質(zhì)的量之比為____,該反應中氧化產(chǎn)物是____。
(5)“有效氯含量”可用來衡量含氯消毒劑的消毒能力,其定義是:每克含氯消毒劑的氧化能力相當于多少克Cl2的氧化能力。NaClO2的有效氯含量為____。(計算結(jié)果保留兩位小數(shù))
解析:(1)略。(2)從工藝流程圖可以看出,反應物是NaClO3、SO2和H2SO4,產(chǎn)物為ClO2和NaHSO4,根據(jù)得失電子守恒、原子守恒配平化學方程式:2NaClO3+SO2+H2SO4==2ClO2+2NaHSO4。(3)粗鹽提純中加入NaOH溶液沉淀Mg2+,加入Na2CO3溶液沉淀Ca2+。結(jié)合工藝流程圖和氧化還原反應原理,電解過程中,Cl-(NaCl)在陽極放電得到Cl2,ClO2在陰極放電得到。(4)結(jié)合工藝流程圖和題意,用含NaOH的H2O2溶液與ClO2作用,
答案:(1)+3 (2)2NaClO3+SO2+H2SO4==2ClO2+2NaHSO4(3)NaOH溶液 Na2CO3溶液(4)2∶1O2(5)1.57
3.創(chuàng)新思維,學會書寫陌生情境方程式。
近些年的高考試題,更多的是要求能夠在陌生的素材和情境中提煉出有價值的信息,結(jié)合已經(jīng)積累的基礎與經(jīng)驗,創(chuàng)新思維方式,快速準確地書寫相應的方程式。
例3(1)生產(chǎn)Na2S2O5,通常是由NaHSO3過飽和溶液經(jīng)結(jié)晶脫水制得。寫出該過程的化學方程式:___。
(2)磷精礦濕法制備磷酸的一種工藝流程如下。
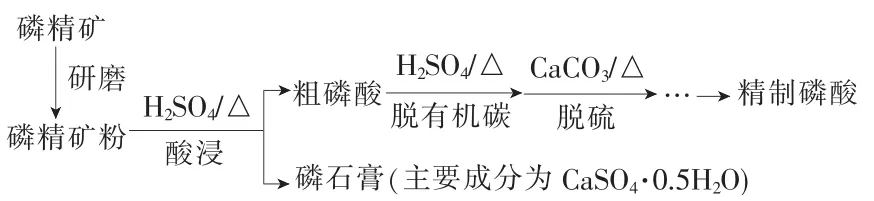
①H2O2將粗磷酸中的有機碳氧化為CO2脫除,同時自身也會發(fā)生分解。相同投料比、相同反應時間、不同溫度下的有機碳脫除率如圖1所示。80℃后脫除率變化的原因:___。
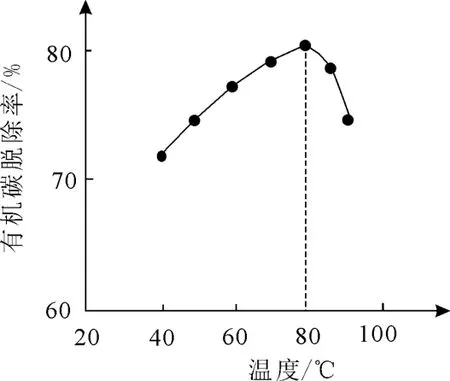
圖1
②脫硫時,CaCO3稍過量,充分反應后仍
解析:(1)Na2S2O5是中學化學教材中從未出現(xiàn)過的陌生物質(zhì),但對題干稍加提煉,不難看出該化學方程式的反應物為NaHSO3,生成物為Na2S2O5和H2O,然后配平即可。
(2)①有機碳的脫除率受兩個因素的共同影響:一方面,溫度越高,反應速率越快,在相同投料比、相同反應時間內(nèi),有機碳的脫除率越高;另一方面,溫度升高可使較多的H2O2分解,氧化劑的量減少,使得有機碳的脫除率降低。80℃后,H2O2分解對有機碳脫除率的影響超過了溫度升高的影響,導致脫除率逐漸降低。
②從工藝流程圖不難看出,脫硫是用CaCO3除去剩余的 H2SO4,由于生成的CaSO4是微溶物,所以即使CaCO3過量,充分反應后仍有殘留。加入BaCO3,使CaSO4轉(zhuǎn)化為更難溶的BaSO4,因此可進一步提高硫的脫除率。但要寫出其離子方程式,思維需要不斷地深入。首先,題干直接提及沉淀的轉(zhuǎn)化,即;其次,H3PO4的酸性強于H2CO3,所以H3PO4會與繼續(xù)反應產(chǎn)生H2CO3(但要寫成“CO2+H2O”);再次,需要思考H3PO4與反應后的生成物是,還是呢,由于之前加入的“CaCO3稍過量”,相對而言,H3PO4的量遠遠大于的量,從而H3PO4反應后應該變成。經(jīng)過這樣深思熟慮,便可得出其離子方程式。
答案:(1)2NaHSO3==Na2S2O5+H2O
(2)①80℃后,H2O2分解速率大,濃度顯著降低 ②CaSO4微溶
通過把脈元素化合物的基礎知識,敦促自己有針對性地落實到位,并在解題訓練中不斷使自己的閱讀能力、讀圖能力和書寫新情境方程式的能力得到提升,這樣在高考中才能夠穩(wěn)操勝券。

