力學拉伸對巨噬細胞極化影響的研究
陳咪咪 褚耿磊 黃迎康 李 斌 施 勤
(蘇州大學附屬第一醫院 蘇州大學醫學部,蘇州 215007)
巨噬細胞(Mφ),是一種廣泛分布于全身血液、組織的免疫細胞[1],能夠吞噬和殺滅胞內寄生蟲、細菌、腫瘤細胞以及自身衰老和異常的細胞,在機體的免疫防御、免疫自穩和免疫監視中發揮重要作用。巨噬細胞主要由骨髓干細胞發育而來,在多集落刺激因子(M-CSF)或粒細胞巨噬細胞集落刺激因子(GM-CSF)等刺激下,發育成單核母細胞,再進一步分化成為前單核細胞并進入血液,在此處分化成為成熟的單核細胞[2,3]。單核細胞穿過血管內皮,遷移到不同的組織,分化成為組織特異性的巨噬細胞。巨噬細胞按照其表型和分泌的細胞因子可以分為兩種極化類型,即經典活化的M1型和選擇性活化的M2型巨噬細胞。在 IFN-γ、LPS和TNF-α等因子的刺激下,分泌炎癥因子,發揮炎癥功能的巨噬細胞稱為M1型巨噬細胞,主要針對微生物的炎癥反應,通過大量分泌相關細胞因子殺死病原體和腫瘤細胞,發揮宿主免疫功能和防御功能[4-6];選擇性活化的M2型巨噬細胞主要分泌抗炎因子TGF-β、IL-4、IL-10等,M2型巨噬細胞會抑制炎癥反應,尤其在炎癥反應后期和促進創傷修復和纖維變性中發揮重要作用,一般與寄生蟲感染、組織重構、纖維化以及腫瘤疾病發展相關[7-9]。因此誘導環境中巨噬細胞M2的極化成為促進組織工程和再生醫學的運用的策略之一。
力學刺激在維持細胞穩態中起非常重要的作用,參與了骨骼、肌肉、肺、血管等組織和器官的發生、發育及生長。有文獻表明,力學刺激強度與炎癥反應的強弱有關,已知核因子-κB(NF-κB)是涉及炎癥,生長調節和凋亡以及多種基因的多效調節劑,與炎癥反應密不可分[10,11]。本實驗中通過力學拉伸這一形式探索力學刺激對巨噬細胞極化的影響及其可能涉及的調控機制。
1 材料與方法
1.1實驗材料、試劑 小鼠單核巨噬細胞白血病細胞Raw264.7細胞系購自上海中科院并在本單位保存,DMEM高糖培養基(Hyclone,美國)、胎牛血清(FBS,Gibco,美國)、100 U/ml青霉素、0.1 mg/ml鏈霉素、鼠尾膠原(Sigma,美國)、活/死細胞染色試劑盒(Thermo Fisher,美國)、凋亡試劑盒(BD,美國)、CCK-8試劑盒(同仁,日本)、CD11b-PE、CD86-FITC、CD206-FITC抗體(eBiosicence,美國)、磷酸鹽緩沖液粉末(博士德生物科技有限公司,中國)、逆轉錄試劑盒(TaKaRa,日本)、SYBR-Green(Bio-Rad,美國)、NIK、P65、Pi-P65抗體(Abcam,英國)、辣根過氧化物酶標記山羊抗小鼠IgG(H+L)和辣根過氧化物酶標記山羊抗兔IgG(H+L)(碧云天,中國)、化學發光試劑ECL顯影液(Thermo Fisher,美國)。
1.2方法
1.2.1細胞處理 提前12 h向無菌的拉伸皿內加入配制的collagenⅠ溶液(1 ml的PBS溶液中加入100 μl的鼠尾膠原),放在培養箱內靜置過夜。12 h后,接種1×105Raw264.7細胞,放置在培養箱內靜置2 d。2 d后開始拉伸,設置5%的幅度,頻率為0.5 Hz(拉伸的長度與原始長度的比例為5%),每天拉伸4 h,連續拉伸3 d、5 d后,再繼續培養24 h,收集細胞上清液和細胞進行流式細胞術、PCR和Western blot等實驗。
1.2.1.1活/死細胞染色檢測細胞生長狀態 吸掉上清液,用PBS溶液輕輕地洗一遍,按照活/死細胞染色試劑盒說明書配制,即A(鈣黃綠素)∶B(溴乙菲啶豪莫二聚體)∶培養基為 1 μl∶2 μl∶2 ml,加到各組的拉伸皿內,室溫避光孵育30 min,PBS溶液清洗2次,通過倒置熒光顯微鏡(Zeiss,德國)進行觀察拍照。
1.2.1.2流式細胞術檢測細胞生長狀態 吸掉上清液,用PBS溶液輕輕地洗一遍,0.25%胰酶消化細胞,1 000 r/min,離心5 min,棄上清,立即置于冰上,分別加入相對應體積的PBS+2%FBS溶液以及相對應的PI和AV,每孔分別加入PI、AV為5 μl、10 μl,加到各組的拉伸皿內,4℃室溫避光孵育30 min,離心,1 000 r/min離心5 min,棄上清(洗去未結合的凋亡試劑),每孔加入200 μl PBS+2%FBS溶液,轉移至96孔板內,流式細胞儀(Merk Millipore,德國)測試。
1.2.1.3Cell Count Kit (CCK-8)實驗檢測細胞生長狀態 吸掉上清液,用PBS溶液輕輕地洗一遍,按照CCK-8試劑∶培養基為1∶10配制液體,將配好的液體加入各組的拉伸皿內,完全覆蓋細胞,37℃培養箱孵育2 h,每皿分別吸出100 μl轉移至96孔板內,450 nm測其吸光度值。
1.2.2細胞表型分析 0.25%胰酶消化細胞,1 000 r/min,離心5 min,棄上清,立即置于冰上,分別加入相對應體積的PBS+2%FBS溶液以及相對應的熒光抗體(CD11b、CD86、CD206),冰上孵育30 min 后,1 000 r/min離心5 min,棄上清(除去未結合的熒光抗體),每孔加入200 μl PBS+2%FBS溶液,轉移至96孔板內,流式細胞儀(Merk Millipore,德國)測試。
1.2.3實時熒光定量PCR Trizol溶液裂解細胞,通過氯仿-異丙醇-75%酒精等試劑提取RNA,通過測量其在260 nm處的吸光度計算總RNA的濃度,1 μg RNA通過逆轉錄后得到cDNA,然后再進行實時定量熒光PCR(Bio-Rad,美國)。檢測的引物分別為致炎基因IL-1β、TNF-α、iNOS和抗炎基因IL-4、IL-10和TGF-β(本實驗引物由金唯智生物科技有限公司合成,基因序列如表1)。
表1基因引物序列
Tab.1Geneprimersequence

GenePrimer sequenceβ-actinForward:5′-GTGACGTTGACATCCGTAAAGA-3′Reverse:5′-GCCGGACTCATCGTACTCC-3′IL-1βForward:GCAACTGTTCCTGAACTCAACT-3′Reverse:5′-ATCTTTTGGGGTCCGTCAACT-3′iNOSForward:5′-ATAGTCCTTCCTACCCCAATTTCC-3′Reverse:5′-GATGAATTGGATGGTCTTGGTCC-3′TNF-αForward:5′-TGTTACTGCCAGGACCCATA-3′Reverse:5′-CTTCCTTGATGGTCTCCACA-3′IL-4Forward:5′-GGTCTCAACCCCCAGCTAGT-3′Reverse:5′-GCCGATGATCTCTCTCAAGTGAT-3′IL-10Forward:5′-GCTCTTACTGACTGGCATGAG-3Reverse:5′-CGCAGCTCTAGGAGCATGTG-3′TGF-β1Forward:5′-CAGTACAGCAAGGTCCTTGC-3′Reverse:5′-ACGTAGTAGACGATGGGCAG-3′
1.2.4Western blot 0.25%胰酶消化細胞,1 000 r/min,離心5 min,棄上清后立即置于冰上,加入100 μl 的蛋白裂解液, 4℃搖床上震蕩20 min, 14.8×103g離心20 min,上層無色液體為蛋白溶液。通過BCA試劑盒測出各組蛋白濃度,調節蛋白濃度,加入1/4體積的5×buffer溶液,100℃金屬浴5 min。蛋白上樣量為20 μg,孵育抗體有actin、P65、磷酸化P65和NF-κB誘導激酶(NIK)抗體,一抗4℃孵育過夜,選擇相對應的Western blot二抗(辣根過氧化物酶標記山羊抗小鼠IgG和辣根過氧化物酶標記山羊抗兔IgG),室溫孵育1 h。使用增強的化學發光試劑ECL顯影液來使蛋白條帶顯影,通過放射自顯影儀器曝光(Bio-Rad,美國),Image Lab軟件(Bio-Rad,美國)分析條帶的灰度值,檢測目標蛋白的表達水平。

2 結果
2.15%幅度的力學拉伸對Raw264.7細胞的生長無影響 細胞可以感受微環境的改變并產生生物學反應。力學刺激對小鼠Raw264.7細胞的增殖作用通過活/死細胞染色、CCK-8和流式凋亡實驗檢測,如圖1A所示,未拉伸對照組的Raw264.7細胞幾乎都是活細胞(綠色)。經過5%幅度拉伸的Raw264.7細胞幾乎也都是活細胞,圖1B中能觀察到零星的死細胞(紅色),但相對于對照組來說其差異性并不顯著。流式凋亡結果(圖1C、D)表明,經過5%幅度作用的Raw264.7細胞與對照組細胞的凋亡率相似,5%幅度拉伸組的凋亡率略大于對照組,但兩者之間的凋亡率并沒有顯著性的差異。由圖1E可得,對照組和5%幅度拉伸組的OD值都由0.53增加到4.0,兩組之間差異無統計學意義,因此,表明拉伸不影響細胞增殖。以上結果顯示5%幅度的力學拉伸不影響小鼠Raw264.7細胞的生長。
2.2拉伸抑制巨噬細胞M1方向極化而促進巨噬細胞M2方向極化 為了探索5%幅度的力學拉伸對Raw264.7細胞極化的影響,本實驗用流式方法來檢測Raw264.7細胞CD11b陽性的細胞表面CD86分子(M1型巨噬細胞的標志物)和CD206分子(M2型巨噬細胞的標志物)的表達量。結果顯示,相對于對照組,5%幅度的拉伸可以有效抑制CD86分子的表達。而CD206分子的表達略高于對照組。第3天對照組CD86/CD206比值是5%幅度拉伸CD86/CD206比值的2.5倍(圖2A、B、E),第5天對照組CD86/CD206比值是5%幅度拉伸CD86/CD206比值的15倍(圖2C、D、F)。因此,5%幅度的拉伸可以顯著性增加Raw264.7細胞CD206/CD86的比值,表明5%幅度的力學拉伸可以顯著地促進Raw264.7細胞M2方向極化。
2.35%拉伸調節Raw264.7細胞炎癥相關基因的表達 qRT-PCR結果顯示,5%幅度拉伸作用細胞3 d 后,細胞在致炎基因與抗炎基因的表達上與對照組幾乎沒有差異。而5%幅度拉伸作用細胞5 d后,細胞相對于對照組會顯著抑制致炎癥基因IL-1β、TNF-α和iNOS的表達(圖3A),同時促進抗炎基因IL-4、IL-10和TGF-β的表達(圖3B)。以上結果表明5%幅度拉伸促進Raw264.7細胞更多的表達M2抗炎基因,并抑制M1炎癥基因的表達。
2.45%幅度的力學拉伸抑制細胞NF-κB信號通路的激活 由PCR和流式實驗結果發現5%幅度的拉伸在抑制炎癥和促進抗炎都有很好的效果。為了研究力學刺激是如何引起Raw264.7細胞發生極化作用的,我們通過Western blot技術研究與炎癥調控相關NF-κB信號通路變化。通過WB結果可以看出,與對照組相比,5%幅度拉伸明顯地抑制了Raw264.7細胞NIK蛋白和磷酸化P65的表達量,5%幅度拉伸后磷酸化P65的表達量是僅有對照組的1/2,而P65的蛋白表達量并無差異(圖4)。由此推斷,5%幅度拉伸抑制了Raw264.7細胞NF-κB信號通路的激活。


圖15%幅度拉伸對Raw264.7細胞生長的影響
Fig.15%amplitudecyclictensilestrainaffectgrowthofRaw264.7cell
Note: A,B.The result of live/dead cell staining on the fifth day;C,D.The result of flow apoptosis analysis on the fifth day;E.The result of CCK-8.

圖2 5%幅度的拉伸對Raw264.7細胞表面CD86和CD206分子表達的影響Fig.2 Effect of 5% amplitude cyclic tensile strain on CD86 and CD206 expression of Raw264.7 cellsNote:A,B,E.The result of flow analysis on the third day;C,D,F.The result of flow analysis on the fifth day;compared with control group,*.P<0.05.
3 討論

圖3 5%幅度的拉伸對細胞因子基因表達的影響Fig.3 Effect of 5% amplitude cyclic tensile strain on expression of inflammation and anti-inflammation genesNote:Compared with control group,*.P<0.05.
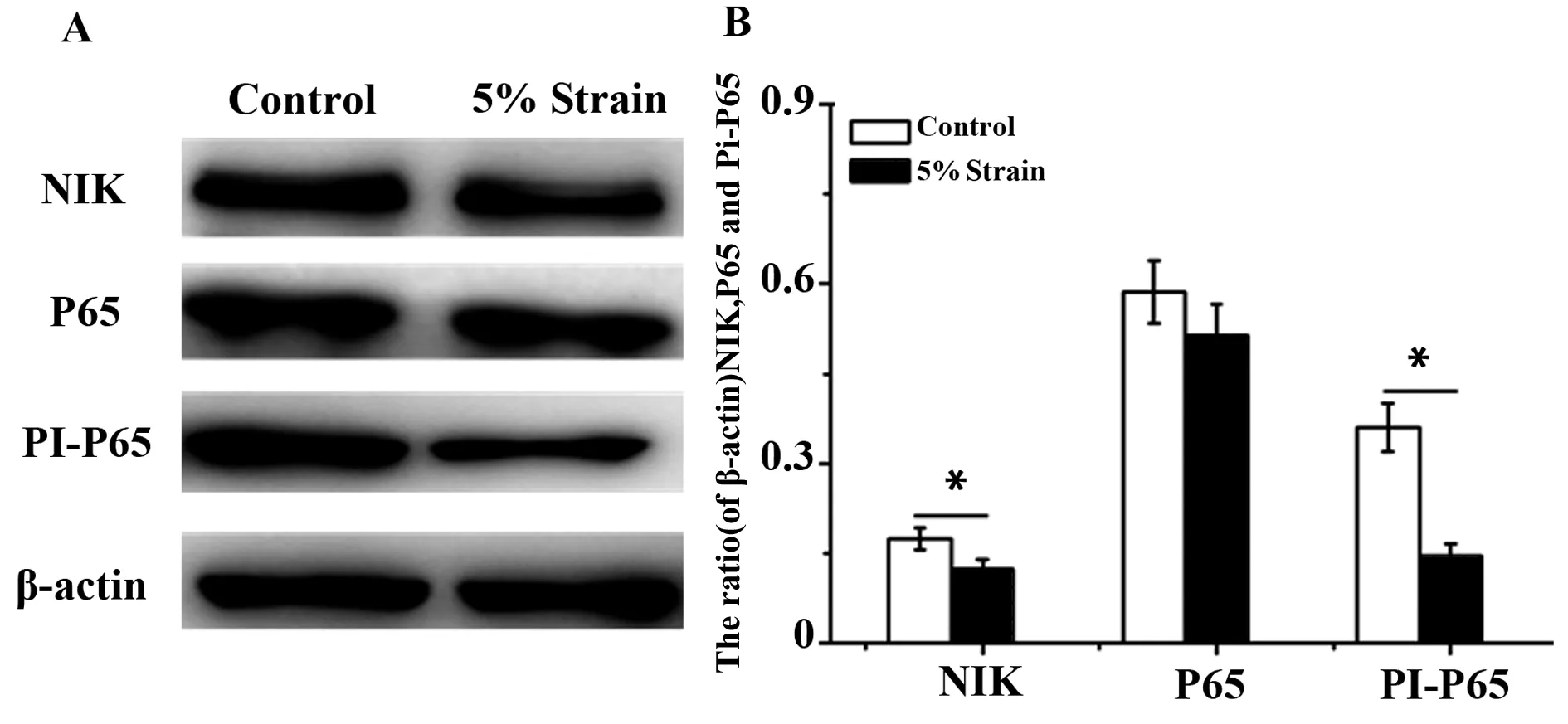
圖4 5%幅度的拉伸對NF-κB信號通路激活的影響Fig.4 Effect of 5% amplitude cyclic tensile strain on activation of NF-κB signaling pathwayNote:Compared with control group,*.P<0.05.
隨著科學與醫學的進步,人類發現巨噬細胞涉及幾乎每一種人類疾病,并在疾病的預防及治療中發揮重要作用。巨噬細胞是免疫系統的重要組成部分,它們不同的表型,經典活化(M1)和替代性活化(M2),在組織再生活動如外來體反應(FBR)和組織重塑中起關鍵作用[7],因此調控巨噬細胞的M1/M2比例為再生治療提供了新的思路和策略。巨噬細胞在組織修復中發揮重要作用[12-14],如在血管修復方面,在炎癥早期,M1型巨噬細胞會分泌VEGF、IL-1β和TNF-α等,而這些炎癥因子可以有效防御病原體或細菌感染傷口。如果炎癥反應在適當的時期沒有終止,就會導致組織損傷,因此,在發生炎癥反應之后,必須要有組織的修復過程,M2型巨噬細胞則通過分泌PDGF招募間質干細胞和周細胞,使其附著在新生毛細血管內皮細胞上來穩定新生血管[15]。此外,M2巨噬細胞能夠調節炎癥反應和適應性Th2免疫,促進血管生成,組織重塑和修復[8,16]。
機械刺激的生理水平對于組織中細胞的生長和成熟是重要的,存在于這些組織中的巨噬細胞也暴露于機械刺激并做出反應。有研究證明3%~8%幅度的力學刺激對于大多數細胞無損傷,在本實驗中活/死細胞染色實驗中可以看出5%幅度的拉伸對細胞的生長狀態并不會有太大的損傷。有文獻報道低幅度的拉伸(6%)可以通過下調Raw264.7細胞mRNA的活化水平而顯著性抑制IL-1β的表達,通過抑制IL-1β細胞因子的表達,拉伸應變可以顯著降低IL-1β依賴性免疫應答[17]。另有文獻報道在體外,只有低幅度拉伸刺激會引起抗炎反應,而高幅度拉伸(15%~18%)會促進炎癥反應[18,19],因此在本研究中,我們選擇研究5%幅度的拉伸對Raw264.7細胞的M1/M2極化的影響。有文獻報道,CD86和CD206可分別作為M1和M2巨噬細胞的表面標志[20]。如圖2、3所示,M1激活標志物CD86、IL-1β、TNF-α及M2激活標志CD206、IL-4[20],相對于對照組而言,5%拉伸刺激后,Raw264.7細胞的CD206+/CD86+的表達比例增強,在基因表達方面,抗炎基因IL-4和IL-10的表達增強,炎癥基因IL-1β和TNF-α的表達顯著性下降,而且連續拉伸5 d后,抑制炎癥基因和促進抗炎基因的表達效果要強于3 d。綜上所述,我們可以認為通過合適的拉伸幅度確實可以顯著抑制炎癥表達和促進抗炎反應,從而進一步促進組織的重塑和再生。
當細胞暴露于不同的機械應變水平下,作用于細胞骨架的力會導致多個機械傳感器激活的差異性,從而導致細胞的表達發生變化。隨著對細胞骨架認識的逐漸深入,人們發現細胞骨架在細胞對力學刺激的感受和信息傳導的過程中起重要作用。機械刺激作用于細胞后,可以通過蛋白激酶C、整合素以及絲裂原激活蛋白激酶等多條信號通路,且各種信號傳導通路中存在交聯,從而影響細胞骨架的重組,并將力學刺激進一步轉換成化學信號,最終完成其生物效應[21]。NF-κB參與機體免疫、炎癥和細胞凋亡等多種條件下的基因調控,靜息狀態下,NF-κB與抑制蛋白IκB-α結合,存在于胞漿中。當細胞受到外界刺激后,IκB磷酸化降解,P65與IκB解離進入細胞核,與靶基因啟動子或增強子的κB序列結合,啟動和調控眾多促炎細胞因子和炎癥介質(如TNF-α等)表達[22]。目前證實NF-κB可誘導細胞因子(如IL-β、IL-6、TNF-α)的過度或持續的表達,進而導致炎癥細胞浸潤,聚集于炎癥部位,最終形成炎癥反應[23]。如圖所示,Western blot結果可以得到5%幅度的力學刺激對NF-κB信號通路的激活有抑制作用,當細胞外的拉伸信號傳至細胞內,導致巨噬細胞向M2方向的極化,抑制了巨噬細胞分泌炎癥因子。巨噬細胞將感受到的力學刺激在體內轉化為生物信號,傳至細胞下游,引起NIK蛋白表達發生變化,繼而進一步引起P65蛋白核移位的變化,最終導致NF-κB信號通路激活被抑制。巨噬細胞在5%幅度的力學刺激后會通過抑制NF-κB信號通路的激活,進而抑制巨噬細胞向M1極化,促進巨噬細胞向M2方向極化。
研究表明,IL-1β、IL-6、TNF-α等炎癥因子能刺激破骨細胞活化,抑制細胞骨形成。文獻報道抗炎物質15-Deoxy-△12,14-S前列腺素J2被用于大鼠股骨皮質缺損時,可減弱周圍軟組織中IL-6、IL-1β和TNF-α的表達同時促進和促進與骨再生有關的生長因子的分泌和隨后的新骨形成[24]。研究發現,脈狹窄血管再通后腎功能得到改善、纖維化減輕,并使M1/M2比值降低,另外M2巨噬細胞通過刺激產生鳥氨酸以促進細胞增殖,通過促進TGF的產生及合成多胺和膠原進行組織修復[25]。5%幅度的拉伸通過抑制NF-κB信號通路從而抑制巨噬細胞向M1方向極化,促進巨噬細胞向M2方向極化,并引起抗炎因子分泌的增多,從而在組織修復中發揮作用。綜上所述,5%幅度拉伸的力學刺激Raw264.7細胞,抑制了NF-κB信號通路的激活,同時抑制了CD86分子的表達和促進了CD206分子的表達;進一步分析發現適度力學刺激下Raw264.7細胞可降低致炎癥因子IL-1β、IL-6、TNF-α的分泌而提高抗炎癥合成,促進Raw264.7向M2方向極化,為通過力學刺激調控巨噬細胞的極化促進組織重塑和再生提供了實驗依據。

