冠突散囊菌與茶葉生物堿共培養液態發酵體系的構建及特性
黃浩,鄭紅發,趙熙,鐘妮,,余鵬輝,,黃建安,劉仲華
(1.湖南省農業科學院茶葉研究所,湖南長沙 410125)(2.湖南農業大學茶學教育部重點實驗室,湖南長沙410128)(3.國家植物功能成分利用工程技術研究中心,湖南長沙 410128)
茯茶中的優勢真菌-冠突散囊菌[1~3],俗稱“金花”菌,一直被視作衡量茯茶品質的重要指標。現行研究已從茯茶品質化學[4]與功能成分化學[5~7]角度證實了冠突散囊菌對茯茶的重要性。課題組曾借助人工接種冠突散囊菌至茶葉固體發酵-“散茶發花”技術對不同茶類原料“發花”茯茶加工過程中的水浸出物、茶多酚、兒茶素組分、氨基酸、黃酮類、可溶性糖和可溶性蛋白等茶葉常量成分進行含量檢測與分析,并考察加工各階段微生物及優勢真菌的動態變化,其已基本探明茯茶的品質風味形成機理[8,9]。然而,茶是一種較為復雜的基質,其生化成分因產地、品種而異。因此,在特定的載體中加入規定的介質對更進一步研究微生物對茶葉單一生化成分的代謝機制具有重要的意義[10]。王小剛[11]等人用黑曲霉等5種微生物分別接種綠茶和紅茶的干茶與茶湯的發酵體系(32 d)來考察咖啡堿的含量變化,結果表明不同生長基質的同種真菌發酵體系對咖啡堿的含量產生較大差異。
本研究在前人研究的基礎上,設計已知、固定的培養基作為滿足冠突散囊菌生長需要的特定基質,并以高純度咖啡堿、可可堿和茶堿作為冠突散囊菌液體發酵培養的唯一外源添加底物,考察冠突散囊菌對上述3種單體成分為期10 d的發酵特性,為進一步豐富茯茶品質形成機理提供理論依據。
1 材料與方法
1.1 材料與試劑
“金花”菌-冠突散囊菌(Eurotium cristatum),為本實驗室自藏菌株[12],分離自益陽茶廠股份有限公司產茯磚茶(800 g裝,產于2007年)。
冠突散囊菌分離、純化培養基:PDA(馬鈴薯葡萄糖瓊脂培養基)、察氏等固體培養基;種子培養基、發酵培養基:1.0%(m/V)葡萄糖,國藥集團化學試劑有限公司;0.1%(m/V)蛋白胨,北京生工生物工程有限公司;0.05%(m/V)檸檬酸,成都市科龍化工試劑廠;2%(V/V)Vogel’s N[13](Vogel,1964)、0.015%(V/V)吐溫 80,中國醫藥上海化學試劑公司;校準pH 5.5。
馬鈴薯提取物,上海一研生物科技;葡萄糖(食品級),國藥集團化學試劑有限公司;瓊脂粉,北京振泰生物;咖啡堿(純度≥99%)、可可堿(純度≥95%)、茶堿(純度≥99%)。葡萄糖試劑盒、蛋白質含量檢測試劑盒,南京建程生物工程研究所。
1.2 儀器與設備
Delta 320 pH計,Mettler;Motic B1光學顯微鏡,Motic公司;萬分之一電子天平,Mettler AE240;MIKRO-35 高速冷凍離心機,德國產;蘇凈超凈工作臺,蘇凈集團安泰公司;振蕩式恒溫培養箱,上海蘇坤實業有限公司;恒溫培養箱,江蘇環保儀器廠;高溫高壓滅菌鍋,上海醫用核子儀器廠;恒溫鼓風干燥箱,上海精宏實驗設備公司;10 mL一次性注射器,河南曙光健士醫療器械集團有限公司;0.22 μm過濾頭,Millipore;定量濾紙,杭州特種紙業有限公司;多功能酶標儀,Thermo;96孔板,海門博陽實驗器材廠;7.5 cm玻璃漏斗、50 mL三角瓶、隔菌封口膜、10 mL、1.5 mL 離心管、1000 μL、200 μL Tip 頭,上海生工生物工程有限公司等。
1.3 實驗方法
1.3.1 種子液培養
將預先培養5 d的斜面冠突散囊菌菌種轉接于種子培養基(200 mL)中,置振蕩培養箱中30 ℃,轉速200 r/min條件下培養24 h。
1.3.2 誘導培養與取樣
從種子液中吸取4%接種量轉接至50 mL發酵培養基中,添加過濾除菌的 Caffeine母液終濃度 0.2 mg/mL(Caffeine組)、可可堿母液終濃度0.08 mg/mL(Theobromine組)、茶堿母液終濃度 0.08 mg/mL(Theophylline組),未添加單體的培養基為Caffeine空白對照(F-wC組)、Theobromine空白對照(F-wTheob組)、Theophylline空白對照組(F-wTheop組),以及設置添加單體但未接種冠突散囊菌的空白對照(C-wF)、(Theob-wF)、(Theop-wF);在溫度為28 ℃,轉速為160 r/min條件下震蕩培養10 d;每24 h取樣觀察,三組發酵培養液均經過濾處理,得到濾液和菌絲體,測定菌體干重和發酵清液的pH值,剩余葡萄糖含量,總蛋白質含量。
1.3.3 HPLC法分析咖啡堿、可可堿、茶堿在發酵液中的代謝情況
采用HPLC方法來定量分析底物咖啡堿、可可堿、茶堿在發酵過程中的消耗情況,反應液原液稀釋至合適倍數后經HPLC進樣分析,三種生物堿的定量檢測方法采用色譜條件[14,15]:C18柱(4.6×200 mm,5 μm,welchrom),流動相:A:去離子水,B:N, N-二甲基甲酰胺:甲醇:乙酸=40:2:1.5,流速:1 mL/min。進樣量:10 μL等條件在278 nm下檢測,試驗重復六次(n=6),分析并計算結果。
1.3.4 數據統計分析
試驗數據采用數學統計分析軟件SPSS 19.0進行檢驗分析,試驗重復三次并取 3次重復的平均值。
2 結果與分析
2.1 冠突散囊菌-咖啡堿共培養發酵液中發酵產物含量的變化
HPLC方法對添加咖啡堿的發酵液進行含量檢測分析,圖1結果顯示為期10 d的發酵對發酵液中咖啡堿的含量變化無明顯影響,這意味著以發酵液中的咖啡堿不能被冠突散囊菌生長繁殖所直接利用,這可能與咖啡堿較穩定的化學性質相關。
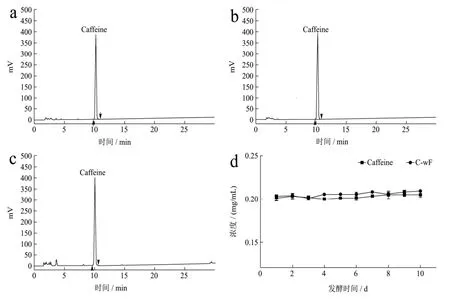
圖1 HPLC法檢測發酵液中咖啡堿的含量Fig.1 The content of caffeine in the fermentation broth was detected by HPLC
2.2 冠突散囊菌-咖啡堿共培養發酵體系的理化特性
圖2結果顯示咖啡堿組發酵液的pH值隨著發酵時間的增加持續下降,發酵前 6~7 d,咖啡堿組與未加咖啡堿組變化趨勢表現出高度一致,當發酵進入第7 d,咖啡堿組pH值下降的幅度逐漸增大直至第9 d趨于穩定,這可能是咖啡堿刺激菌體生長加速菌體代謝出有機酸,同時延緩了菌體自溶,進而導致延緩了發酵液pH值上升。總得來說,咖啡堿組菌體生物量增加并不明顯,這可能與咖啡堿的穩定性質而不易被菌體所利用有關。
兩組發酵液中剩余葡萄糖含量的變化趨勢一致,相比之下,添加咖啡堿的發酵液中葡萄糖的含量下降的更為明顯,說明有咖啡堿的存在可能對刺激菌體的生長繁殖存在積極作用,從而加速冠突散囊菌對發酵液中葡萄糖的消耗;二組發酵液總蛋白質含量都隨著發酵時間的增加而逐漸升高,而又分別在發酵第8、9 d相繼開始下降,一方面冠突散囊菌在發酵培養過程中胞外酶的分泌和積累,另一方面,也可能是由于菌體自溶導致胞內蛋白等大分子物質快速降解。
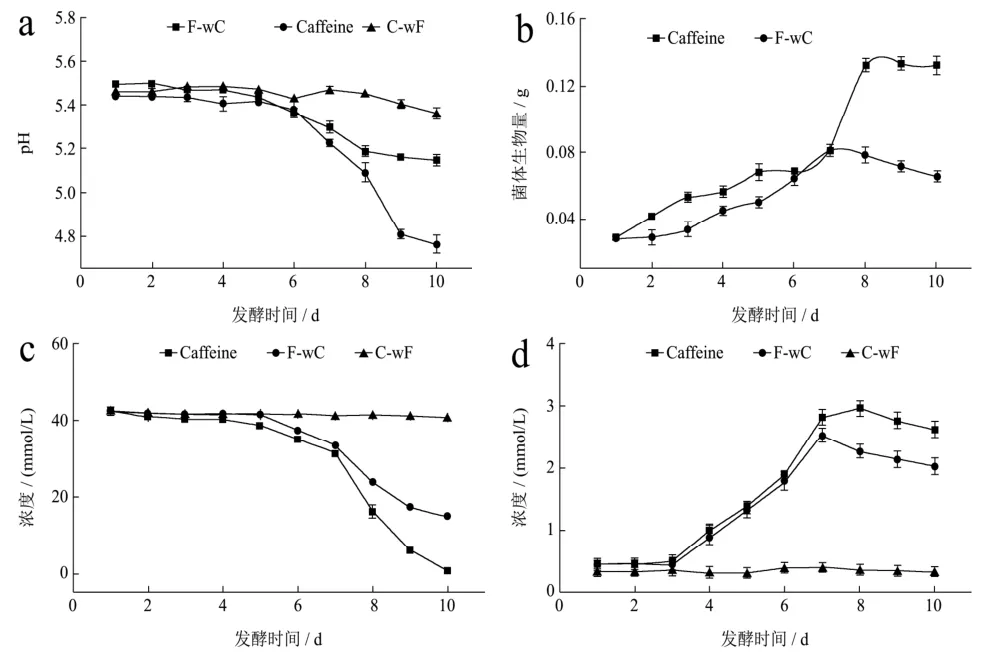
圖2 冠突散囊菌-咖啡堿共培養發酵體系的理化特性Fig.2 The physical and chemical characteristics of the co-culture fermentation system of Eurotium cristatum-caffeine
2.3 冠突散囊菌-可可堿共培養發酵液中發酵產物含量的變化
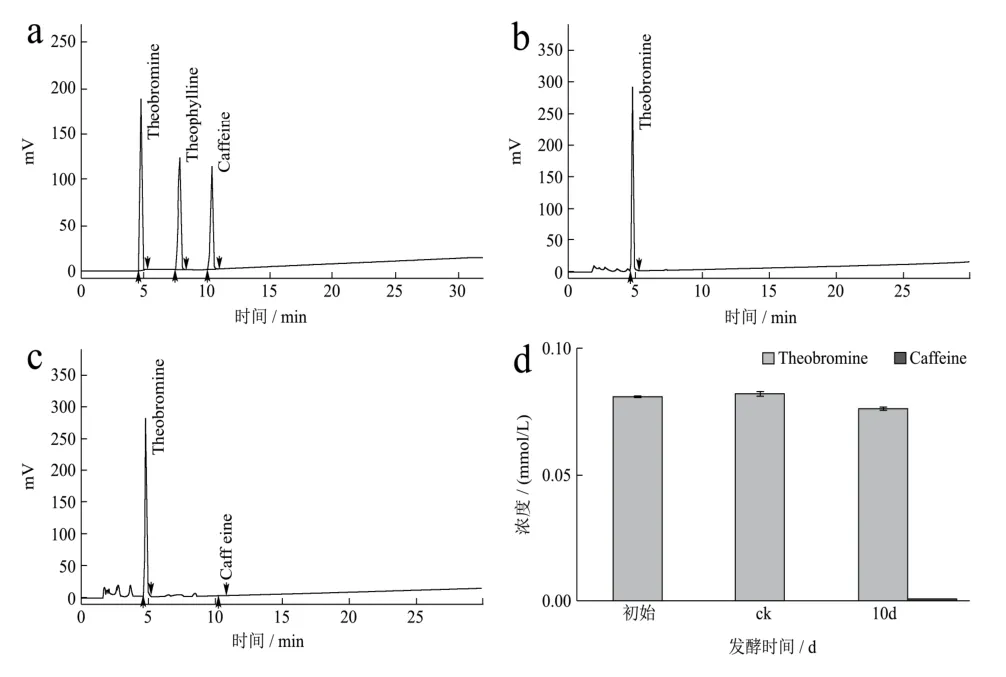
圖3 HPLC法檢測發酵液中可可堿及其發酵產物的含量Fig.3 The content of theobromine and its fermentation products in the fermentation broth was detected by HPLC
采用HPLC方法對添加可可堿的發酵液進行含量檢測分析,結果顯示為期10 d的發酵對發酵液中可可堿的含量變化無明顯影響,這意味著發酵液中的可可堿可能不能被冠突散囊菌生長繁殖所直接利用,這可能與咖啡堿較穩定的化學性質有關,由圖3可知,發酵結束時在發酵液中能檢測到少量的咖啡堿,這說明冠突散囊菌可能能以可可堿為前提合成咖啡堿。
2.4 冠突散囊菌-可可堿共培養發酵體系的理化特性
由圖4可知,可可堿添加組發酵液的pH值隨著發酵時間的增加持續下降,從發酵開始到結束,兩組變化趨勢表現出高度一致,菌體生長繁殖將碳源轉化為有機酸而導致發酵液pH值持續下降,直至第8 d趨于穩定。
二組菌體生物量呈現逐漸增加的趨勢,添加可可堿與未添加可可堿對照相比,其菌體生物量要稍高于后者,說明可可堿的添加對菌體生長有促進作用。發酵進入第8 d,菌體生物量開始下降,對照pH值曲線,這可能是因為菌體開始自溶所致。
添加可可堿的發酵液與未添加咖啡堿對照組發酵液中剩余葡萄糖含量的變化趨勢一致,相比之下,添加可可堿的發酵液中葡萄糖的含量下降的更為明顯,說明有可可堿的存在可能對刺激菌體的生長繁殖存在積極作用,從而加速冠突散囊菌對發酵液中葡萄糖的消耗;二組發酵液總蛋白質含量均隨著時間的增加而逐漸升高,而又分別在發酵第8、9 d相繼開始下降,一方面冠突散囊菌在發酵培養過程中胞外酶的分泌和積累,另一方面,也可能是由于菌體自溶導致胞內蛋白等大分子物質快速降解。

圖4 冠突散囊菌-可可堿共培養發酵體系的理化特性Fig.4 The physical and chemical characteristics of the co-culture fermentation system of Eurotium cristatum-theobromine
2.5 冠突散囊菌-茶堿共培養發酵液中發酵產物含量的變化
采用HPLC方法對添加茶堿的發酵液進行含量檢測分析,圖5結果顯示為期10 d的發酵對發酵液中茶堿的含量變化無明顯影響,這意味著發酵液中的茶堿不能被冠突散囊菌生長繁殖直接利用;由圖5-K可知,發酵結束時在發酵液中能檢測到少量的咖啡堿,這說明冠突散囊菌可能以茶堿為底物合成咖啡堿。
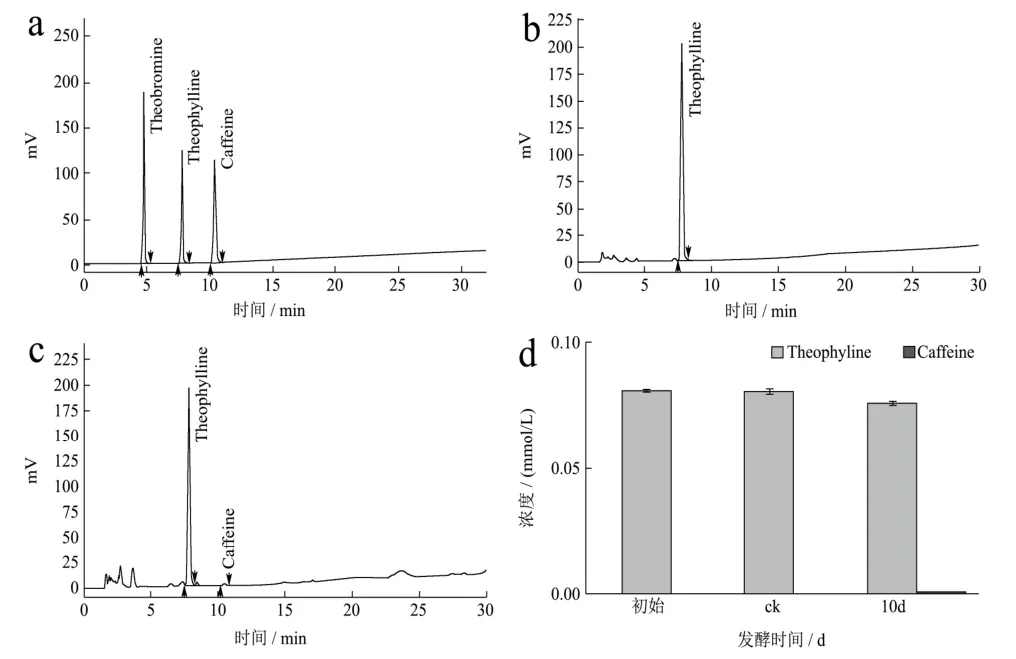
圖5 HPLC法檢測發酵液中茶堿及其發酵產物的含量Fig.5 The content of theophylline and its fermentation productsin the fermentation broth was detected by HPLC
2.6 冠突散囊菌-茶堿共培養發酵體系的理化特性
圖6結果顯示茶堿組發酵液的pH值隨著發酵時間的增加持續下降,從發酵開始到發酵結束,茶堿組與未加茶堿組變化趨勢表現出高度一致,菌體生長繁殖將碳源轉化為有機酸而導致發酵液pH值持續下降,直至第8 d趨于穩定。
二組菌體生物量均呈現增加的趨勢,添加茶堿與未添加茶堿對照比相比,其菌體生物量前者要稍高于后者,說明茶堿能刺激菌體生長。發酵進入第8 d,菌體量開始下降,對照pH值曲線,這可能是由于菌體自溶所引起的。
兩組發酵液中剩余葡萄糖含量的變化趨勢一致,添加茶堿的發酵液中葡萄糖的含量下降的更為明顯,說明有茶堿的存在可能對刺激菌體的生長繁殖存在積極作用,從而加速冠突散囊菌對發酵液中葡萄糖的消耗;二組發酵液總蛋白質含量都隨著時間的增加而逐漸升高,而又分別在發酵第8、9 d相繼開始下降,一方面冠突散囊菌在發酵培養過程中胞外酶的分泌和積累,另一方面,也可能是由于菌體自溶導致胞內蛋白等大分子物質快速降解。
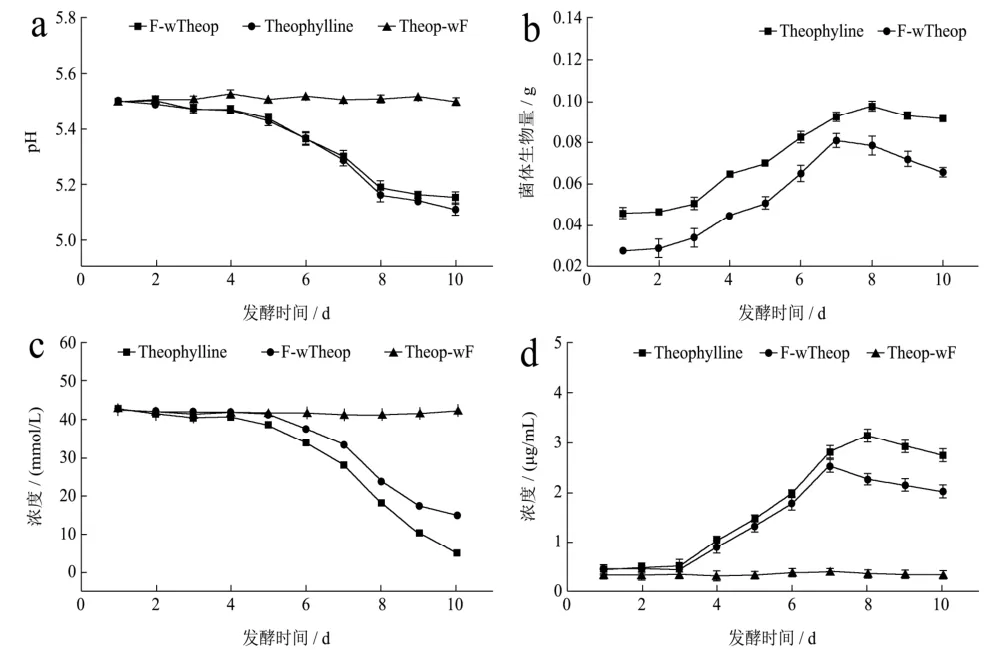
圖6 冠突散囊菌-茶堿共培養發酵體系的理化特性Fig.6 The physical and chemical characteristics of the co-culture fermentation system of Eurotium cristatum-theophylline
3 結論
3.1 茯茶中的“金花”菌(冠突散囊菌)之所以能生長繁殖是因為茶葉能為“金花”菌的生長繁殖提供必需的碳源、氮源,一方面,“金花”菌直接利用簡單含碳、氮化合物進行生長繁殖,另一方面,“金花”菌分泌的孢外酶作用于茶葉內含成分發生一系列生化反應,間接的為該菌的生長繁殖提供營養基礎。“散茶發花”技術[16]是在傳統茯磚茶加工工藝基礎上的創新與升級,其獨特之處在于較大地縮短了加工周期,從壓制到出烘由傳統的1個月的時間縮短至1周左右,且利用該技術加工的茯茶新產品品質無異于傳統茯磚,“菌花”香更為濃郁,此得益于人工大量接種純冠突散囊菌,本研究以此為基礎,配制單一基質作為滿足冠突散囊菌生長繁殖的基本需求,同時分別添加已知濃度的生物堿單體成分,構建茶葉生物堿單體成分-冠突散囊菌共培養發酵體系(10 d),考察冠突散囊菌對其的發酵特性,為進一步豐富茯茶品質形成機理提供理論依據。
3.2 咖啡堿是一類嘌呤類生物堿,是也茶葉特征性成分之一,占茶葉干重的2%~4%[17]。本研究以0.2 mg/mL的咖啡堿作為代謝底物添加到冠突散囊菌的發酵培養基中,考察咖啡堿與冠突散囊菌間相互影響,結果表明,該濃度的咖啡堿的添加對冠突散囊菌的生長繁殖,
pH值,剩余葡萄糖含量和總蛋白質含量具有一定影響。咖啡堿的添加能在一定程度上刺激冠突散囊菌的生長,但在發酵過程中,其含量并未出現明顯變化,這說明在該發酵系統中,冠突散囊菌既不能將其作為碳源、氮源分解代謝來維持生長,也不能利用共培養發酵體系中其他成分來合成咖啡堿。該結果與前人研究基本一致,且研究表明微生物體系中,利用真菌分解代謝咖啡因遠比細菌要難的多[18],而且只發生在極少數的青霉屬和曲霉屬類群中,逐級代謝為茶堿和3-甲基黃嘌呤[19]。
3.3 可可堿與茶堿互為同分異構體,是茶葉中除咖啡堿外兩種重要的生物堿,其添加與咖啡堿相似,能在一定程度上刺激冠突散囊菌的生長與繁殖,但不能將其作為碳、氮源消耗和分解,同時經HPLC檢測分析,在可可堿、茶堿與冠突散囊菌的共培養發酵體系中均能檢測到少量咖啡堿,意味著冠突散囊菌可能具有將可可堿與茶堿作為前提合成咖啡堿的能力,本研究結果為后續研究可可堿、茶堿的具體轉化途徑及共培養發酵轉化體系的進一步優化奠定了重要的前期基礎。

