阿爾茲海默病致病機制及新型治療藥物研究進展
謝玉婷,高雪峰,董貴成,李格格,趙鵬
(內蒙古科技大學包頭師范學院,內蒙古包頭 014030)
阿爾茲海默病(AD)是一種以記憶缺失、認知功能缺損為主的臨床綜合征[1],發病率隨年齡增長而增高,發病機制復雜多樣。目前,以細胞外β-淀粉樣蛋白(Aβ)沉積形成的老年斑(SP)、腦部炎癥反應和Tau蛋白過度磷酸化形成的神經纖維纏結(NFT)[2]為主要研究方向。本文對已確定的主要AD發病機制研究及有效藥物治療作一篇綜述。
1 AD主要致病機制
1.1 Aβ的毒性作用
AD患者體內Aβ的產生和清除失衡,且Aβ中有主要病理意義的是Aβ40和Aβ42,其中Aβ42含量較低,但凝集速度快,可觸發Aβ40積聚。Aβ也可在機體大腦內誘發神經毒性。傅燚[3]實驗表明,Aβ可破壞細胞膜完整性,使Ca2+大量內流,胞內產生大量活性氧簇(ROS),激活NO合成酶,誘導氧化應激反應[4],還會促進載脂蛋白E(APOE)表達,形成惡性循環,影響神經元功能。
1.2 Aβ抑制神經通路相關假說
Kodamullil[5]模型表明腦源性神經營養因子(BDNF)、神經營養酪氨酸激酶受體類型2(NTRK2)和泛素羧基末端酯酶L1(UCHL1)均受到Aβ作用,影響神經元活性[6];同時,通過貝爾模型的建立和數據對比提出了2型糖尿病(T2DM)是引發AD的重要因素之一,為AD的致病機制和治療研究提供新方向。
1.3 炎癥反應
AD患者體內,Aβ可通過對細胞表面的高度糖基化終產物受體和清道夫受體作用,過度激活炎癥因子小膠質細胞,破壞Aβ轉運至溶酶體通路,清除Aβ能力下降,使AD患者腦內腫瘤壞死因子-α(TNF-α)、白細胞介素-1β(IL-1β)和白細胞介素-1α(IL-1α)等促炎癥因子升高,形成惡性循環[7]。Albani[8]發現,TNF-α等位基因攜帶者獨立于APOE,有增加AD產生的風險,驗證了APOE-ε4等位基因具有產生AD風險調節劑作用,但此研究不能判斷AD類型。
1.4 Tau蛋白異常學說
異常磷酸化的Tau蛋白在神經元內大量成對的沉積,導致纏結形成,神經元功能受損直至退變,誘導AD形成。調節酶活性是抑制Tau蛋白異常磷酸化的重要途徑之一。糖原合成酶-3(GSK-3)和蛋白磷酸2A(PP2A)是調控Tau蛋白磷酸化的關鍵酶,體外實驗表明,PP2A與GSK-3相互作用,可抑制磷酸化[9],達到緩解AD的作用。
2 新型藥物研究
2.1 抑制Aβ生成
2013年,默克公司公布了新型肽類口服BACE-1抑制劑MK-8931Ⅱ期臨床研究結果,研究中發現Aβ40水平出現高效持續性下降,且未發生嚴重不良事件或停藥記錄,目前MK-8931已經開始Ⅲ期臨床試驗研究[10]。衛材公司的E2212、Vivo 制藥公司的EVP-0962還有Kareus Therapeutics公司的KU-046 已進入Ⅰ期臨床試驗、凱西制藥公司的CHF-5074進入Ⅱ期臨床研究等,這些甾體抗炎類藥物,目前都顯示良好的耐受性和安全性[11]。美國Aphios公司開發的APH0703通過PKC途徑激動α-分泌酶,該藥物正計劃Ⅱ期臨床研究[12];我國天士力公司和美國Proteo Tech共同開發的Exebry-1來調節β、α分泌酶活性,同時還有抗炎作用,在美國已進入臨床Ⅰ期研究。
2.2 抗炎癥反應
炎癥反應長期激動會造成大腦損傷,成為神經退行性疾病的病因之一[13]。基于炎癥致病機制治療AD的臨床研究目前還沒有成功實例,但正在進行的有近十項[14],如表1所示[15]。
2.3 抗Tau蛋白過度磷酸化
抑制Tau蛋白過度磷酸化可緩解AD癥狀,目前針對Tau蛋白過度磷酸化藥物的臨床試驗研究不容樂觀,7個進入臨床試驗藥物已有4個被終止,只有1個進入了Ⅲ期臨床,目前還沒有成功實例[14],如表2 所示[15]。
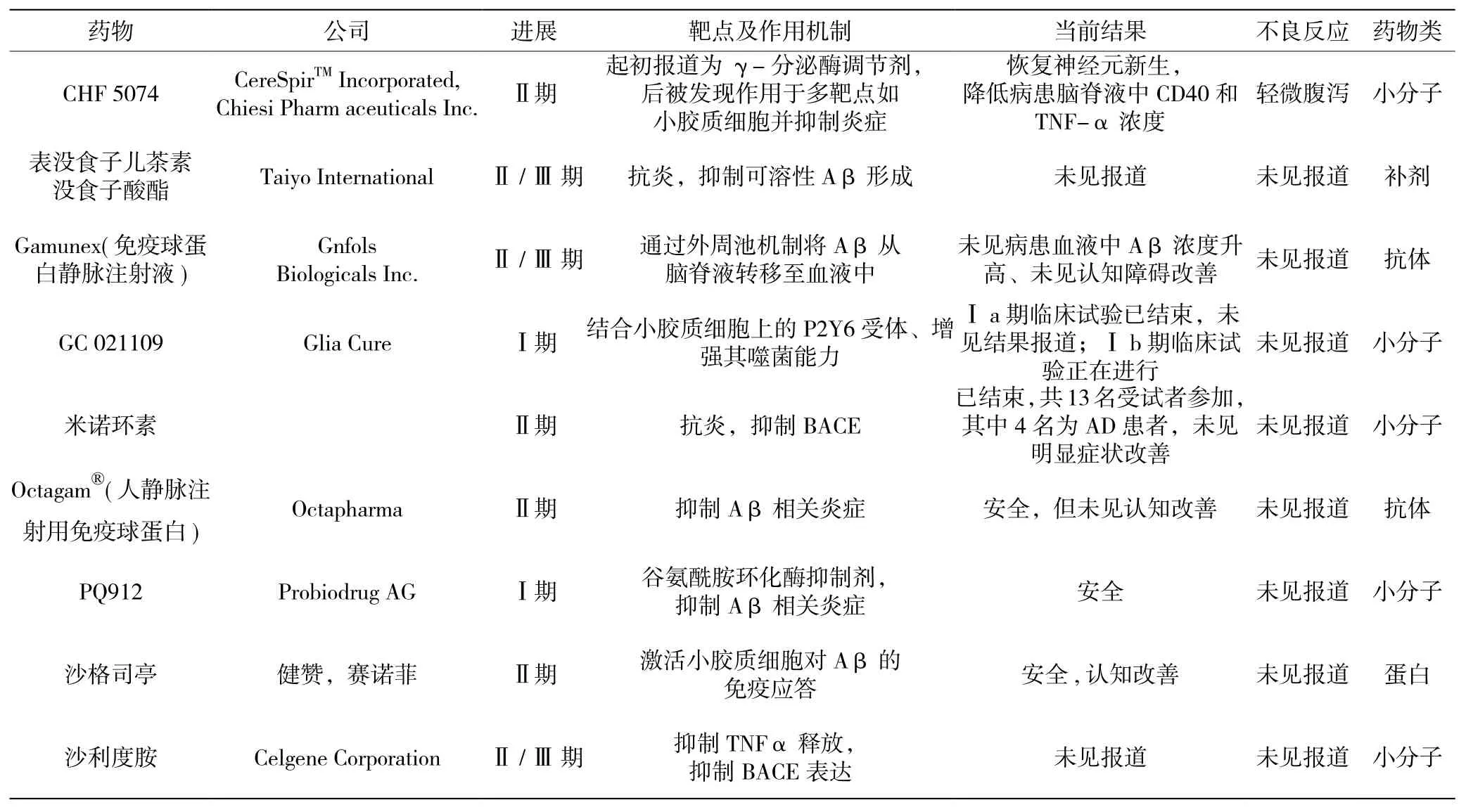
表1 靶向炎癥因子治療AD相關藥物臨床研究
3 天然藥物多靶點作用
中藥來源廣泛,靶點較多,因此近年來,國內外眾多學者從中藥及其有效成分著手,對治療AD的天然藥物進行廣泛研究。

表2 靶向Tau蛋白治療AD相關藥物臨床研究
研究發現,淫羊藿苷[16]能夠改善大鼠學習記憶能力,抑制海馬區TNF-α、IL-6分泌和星形膠質細胞過度激活,提高大鼠學習記憶能力;人參皂苷以Rg1和Rb1為代表性成分,降低Tau蛋白過度磷酸化和Aβ生成量,抑制炎癥反應[17],Rg1還可改善Aβ介導的線粒體功能紊亂,有保護神經系統作用;姜黃素可改善認知功能障礙,降低Aβ42單聚體與N端結合,減少Aβ生成,同時姜黃素還有很好的抗炎癥作用,有研究表明,BDNF-ERK信號通路上調可能與姜黃素改善學習記憶功能有關[18];黃酮類化合物有抗氧化、抗炎和抗癌活性,可通過影響外周或中樞血管系統降低各種神經毒性因素和神經元損傷,有一定穿越血腦屏障能力[19]。
4 結語
隨著老齡化發展,AD已成為繼腫瘤、心血管疾病、腦卒中后第4位致死性疾病。AD發病機制復雜,隨著分子生物學研究發展,對致病機制進行針對性研究,但尚未取得令人滿意的效果,很多研究仍在繼續探尋治療方案。

