補陽還五湯調控小膠質細胞/巨噬細胞極化抑制大鼠腦缺血后炎癥反應研究
甘海燕李琳楊琰諸葛陸杰儲利勝
1.浙江中醫藥大學藥學院 杭州 310053 2.浙江中醫藥大學基礎醫學院
缺血性腦卒中是中樞神經系統最常見的疾病,也是成年人致死致殘的主要原因之一。腦缺血損傷的發病機制非常復雜,其中繼發性炎癥反應在腦缺血損傷中發揮重要作用[1-2]。小膠質細胞(microglia)是腦內固有的免疫細胞,早期研究認為腦缺血后小膠質細胞迅速被激活,并聚集到損傷部位,釋放炎癥介質并募集其他炎癥細胞,加劇腦損傷[3-4]。
小膠質細胞有靜息態和激活態,激活的小膠質細胞有經典激活的M1型和替代激活的M2型兩種表型,與巨噬細胞在形態和表型上相似,兩者很難區分。近年來研究發現,激活的小膠質細胞/巨噬細胞在腦缺血損傷中發揮損傷和修復的雙重作用[5-6]。其中M1型小膠質細胞/巨噬細胞釋放誘導型一氧化氮合酶(inducible nitric oxide synthase,iNOS)以及促炎因子腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)、白細胞介素-1β(interleukin-1β,IL-1β)、白細胞介素-6(interleukin-6,IL-6) 和一氧化氮(nitrogen monoxide,NO)等加劇神經損傷,而M2型小膠質細胞/巨噬細胞釋放抗炎因子白細胞介素-10(interleukin-10,IL-10)、轉化生長因子-β(transforming growth factorβ,TGF-β)以及胰島素樣生長因子-1(insulin-like growth factor-1,IGF-1)等,促進炎癥消退和神經修復。Hu等[7]研究發現腦缺血后激活的小膠質細胞/巨噬細胞表型呈動態改變,早期以M2型為主,隨后逐漸向M1型轉化。激活的小膠質細胞/巨噬細胞具有損傷和修復的雙重作用提示腦缺血治療應從單純抑制小膠質細胞/巨噬細胞激活轉向調控M1/M2表型的平衡。
補陽還五湯(Buyang Huanwu Decoction,BYHWD)具有益氣活血通絡的功效,是中醫治療腦缺血的代表方劑。大量臨床和動物實驗證實BYHWD對腦缺血損傷具有保護和修復作用,機制包括抗氧化、抗凋亡、抗炎、促進血管生成和神經發生等[8-10]。本研究旨在從調控小膠質細胞/巨噬細胞極化角度探討BYHWD對腦缺血后神經炎癥的影響。
1 材料和方法
1.1 實驗動物 SPF級健康雄性SD大鼠30只,3~4月齡,體質量280~300g,由上海西普爾-必凱實驗動物有限公司提供[實驗動物生產許可證號:SCXK(滬)2013-0016],飼養于浙江中醫藥大學動物實驗研究中心屏障實驗室 [實驗動物使用許可證號:SYXK(浙)2013-0184],環境溫度(22±2)℃,相對濕度50%~60%,光照12h/12h明暗交替,自由飲食。
1.2 藥物 補陽還五湯處方來自《醫林改錯·卷下·癱痿》:“此方治半身不遂,口眼歪斜,語言蹇澀,口角流涎,大便干燥,小便頻數,遺尿不禁。”[11]處方組成:黃芪 120g,當歸 6g,川芎 4.5g,赤芍 4.5g,地龍 3g,紅花3g,桃仁3g,以上藥材均購自浙江中醫藥大學附屬門診部。將藥物加水浸泡1h,水煎2次,每次40min,合并后濃縮為含生藥2g·mL-1的水煎液,冷卻后放置4℃冰箱保存。
1.3 試劑 兔抗Iba1購于日本Wako公司(批號:LKG5732);鼠抗CD16/32購于美國BD公司(批號:5342941);山羊抗CD206為美國RD公司產品(批號:WFT0116121);FITC 標記的羊抗兔二抗、Cy3 標記的羊抗鼠二抗、FITC標記的驢抗羊二抗均購自北京中杉金橋生物技術有限公司(批號:123962、131209、125606);Cy3 標記的驢抗兔二抗購自美國Jackson ImmunoResearch公司(批號:711165152);Triton X-100、DIPA、羊血清均購自上海碧云天生物技術有限公司(批號:13993V11、K172720E、C0205);RNAiso Plus、SYBR Premix Ex TaqTM、Prime ScriptTMRT Master Mix、RNase-free Water均購自寶生物工程(大連)有限公司(批號:AA4301-1、AKA8605、AK5402、A3801A)。
1.4 主要儀器 冰凍切片機(美國 Thermo Fisher公司,型號:MH550);倒置熒光顯微鏡(德國 Leica公司,型號:DMIL);實時熒光定量PCR儀(Applied Biosystems,型號:7500);高速冷凍離心機(德國 Eppendorf公司,型號:Centrifuge 5424R);RNA 反轉錄儀(美國BIO-RAD公司,型號:T100TMThermal Cycler);紫外可見分光光度計(美國Thermo公司,型號:Nano drop 2000c)。
1.5 方法
1.5.1 大鼠局灶性腦缺血模型的建立 參照Longa等[12]的方法建立大鼠大腦中動脈阻塞(middle cerebral artery occlusion,MCAO)模型。采用10%水合氯醛以350 mg·kg-1的劑量對大鼠進行腹腔注射麻醉,依次分離右側頸總動脈、頸外動脈、頸內動脈,結扎并游離頸外動脈主干,在頸外動脈剪一小口,經頸外動脈將栓線輕輕插入頸內動脈,當尼龍線插入距頸總動脈分叉18~20mm處時可感輕微阻力,停留90min后,將栓線輕輕拔出恢復血流灌注。結扎頸外動脈,縫合皮膚。術中用加熱毯和白熾燈加熱,維持大鼠肛溫在37℃左右,術后將大鼠置于恒溫箱中直至蘇醒。假手術組,栓線只插入5mm左右。
1.5.2 大鼠分組與給藥 采用完全隨機法將大鼠分為假手術組、模型組、BYHWD 3組,每組10只。給藥劑量按人與動物間體表面積折算的等效劑量,BYHWD 組在缺血后 24h每日灌胃 13g·kg-1,1次/d,共14d[10]。假手術組和模型組灌服等容量的0.9%氯化鈉溶液。
1.5.3 免疫熒光雙標染色檢測小膠質細胞/巨噬細胞表型 缺血模型建立后第14天,將大鼠麻醉后插管,經左心室插管灌注0.9%氯化鈉溶液快速沖洗,4%多聚甲醛灌流固定,分離腦組織,經后固定、脫水后,采用冰凍切片機制備8μm的切片。免疫熒光雙標具體步驟:0.3%Triton X-100室溫破膜,3%H2O2滅活內源性過氧化物酶,血清封閉,分別加入M1型小膠質細胞/巨噬細胞表面標記物兔抗Iba1/鼠抗CD16/32(1:200),M2型小膠質細胞/巨噬細胞表面標記物兔抗I-ba1/山羊抗 CD206(1:100),4℃過夜后加入 FITC-羊抗兔/驢抗山羊和Cy3-羊抗鼠/驢抗兔標記熒光二抗(1:100),室溫避光孵育1h,用含有DAPI的封片劑封片,熒光顯微鏡下觀察并拍照。每張切片任選不重復的3個視野,計數雙標細胞數,取平均值作為測量值。
1.5.4 qRT-PCR檢測小膠質細胞/巨噬細胞表面標記物 用Trizol法提取總RNA,根據TaKaRa公司SYBR PrimeScript RT-PCR試劑盒說明書將RNA逆轉錄為cDNA。按照Takara SYBR Premix Ex TaqTM試劑盒進行qRT-PCR檢測。反應體系如下:2×SYBR Premix Ex TaqⅡ 5.0μL、10μmoL·L-1上下游引物各0.4μL、50×ROX Reference DyeⅡ 0.2μL、cDNA 1.0μL、ddH2O 3.0μL。反應程序:95℃預變性 30s,95℃ 5s,60℃ 30s,40 個循環;95℃ 15s,60℃ 1min,95℃ 15s。PCR反應結束后確認擴增曲線和熔解曲線,以GAPDH為內參,采用2-ΔΔCt法分析mRNA相對表達量。PCR引物引物均由上海生工生物工程有限公司合成,序列見表1。
1.6 統計學分析 應用SPSS 17.0統計軟件進行統計學分析,計量資料以±s表示,組間比較采用單因素方差分析 (Student-Newman-Keuls)。以P<0.05為差異有統計學意義。
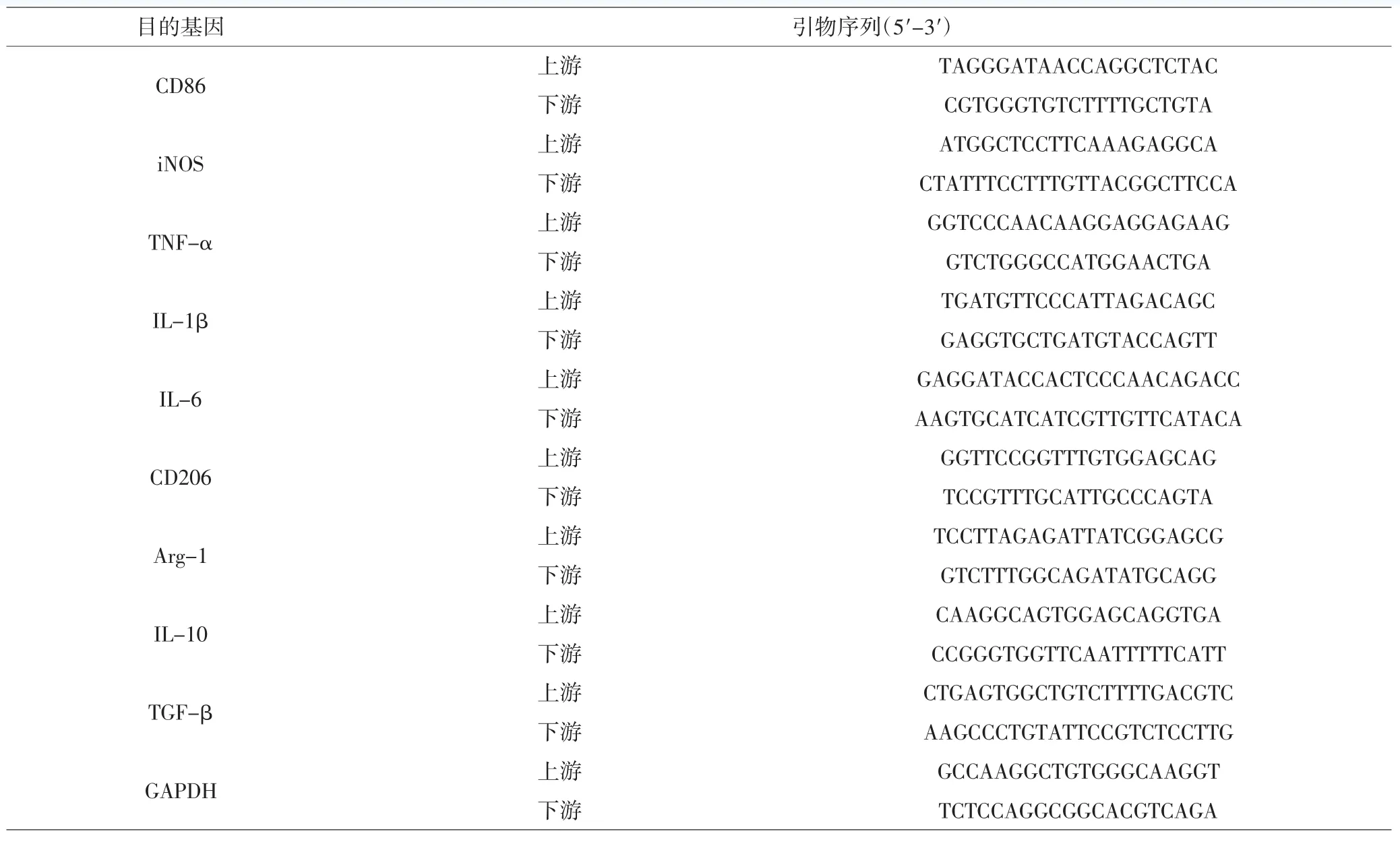
表1 引物序列Tab.1 Primer sequences
2 結果
2.1 BYHWD對大鼠腦缺血后小膠質細胞/巨噬細胞M1型極化的影響 免疫熒光雙標染色結果顯示,大鼠局灶性腦缺血后第14天,與假手術組比較,模型組小膠質細胞/巨噬細胞的M1型標記物CD16/32表達顯著增加(P<0.01);BYHWD組小膠質細胞/巨噬細胞的CD16/32表達也顯著增加(P<0.01)。與模型組比較,BYHWD組小膠質細胞/巨噬細胞的M1型標記物CD16/32表達顯著減少(P<0.01)。見圖1。
2.2 BYHWD對大鼠腦缺血后小膠質細胞/巨噬細胞M2型極化的影響 免疫熒光雙標染色結果顯示,大鼠局灶性腦缺血后第14天,與假手術組比較,模型組小膠質細胞/巨噬細胞的M2型標記物CD206表達顯著增加(P<0.01);與假手術組比較,BYHWD組的CD206表達也顯著增加(P<0.01)。與模型組比較,BYHWD組小膠質細胞/巨噬細胞的M2型標記物CD206表達顯著增加(P<0.05)。見圖2。
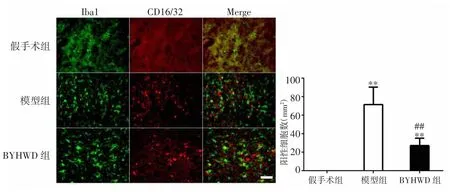
圖1 BYHWD對腦缺血大鼠小膠質細胞/巨噬細胞M1型極化的影響(比例尺:50μm,400×)Fig.1 Effect of BYHWD on M1 polarization of microglia/macrophage after cerebral ischemia in rats(scale bar:50μm,400×)
2.3 BYHWD對大鼠腦缺血后M1型小膠質細胞/巨噬細胞標記物mRNA表達的影響 大鼠腦缺血后第14天,qRT-PCR檢測提示,與假手術組比較,模型組 CD86、iNOS、TNF-α 和 IL-1β 的 mRNA 表達顯著增加(P<0.01);BYHWD 組 CD86、IL-6的 mRNA表達顯著減少(P<0.01),而 iNOS、TNF-α、IL-1β 的mRNA表達顯著增加(P<0.01)。與模型組比較,BYHWD 組 CD86、iNOS、TNF-α、IL-1β 和 IL-6 的mRNA表達顯著減少(P<0.01)。見圖3。
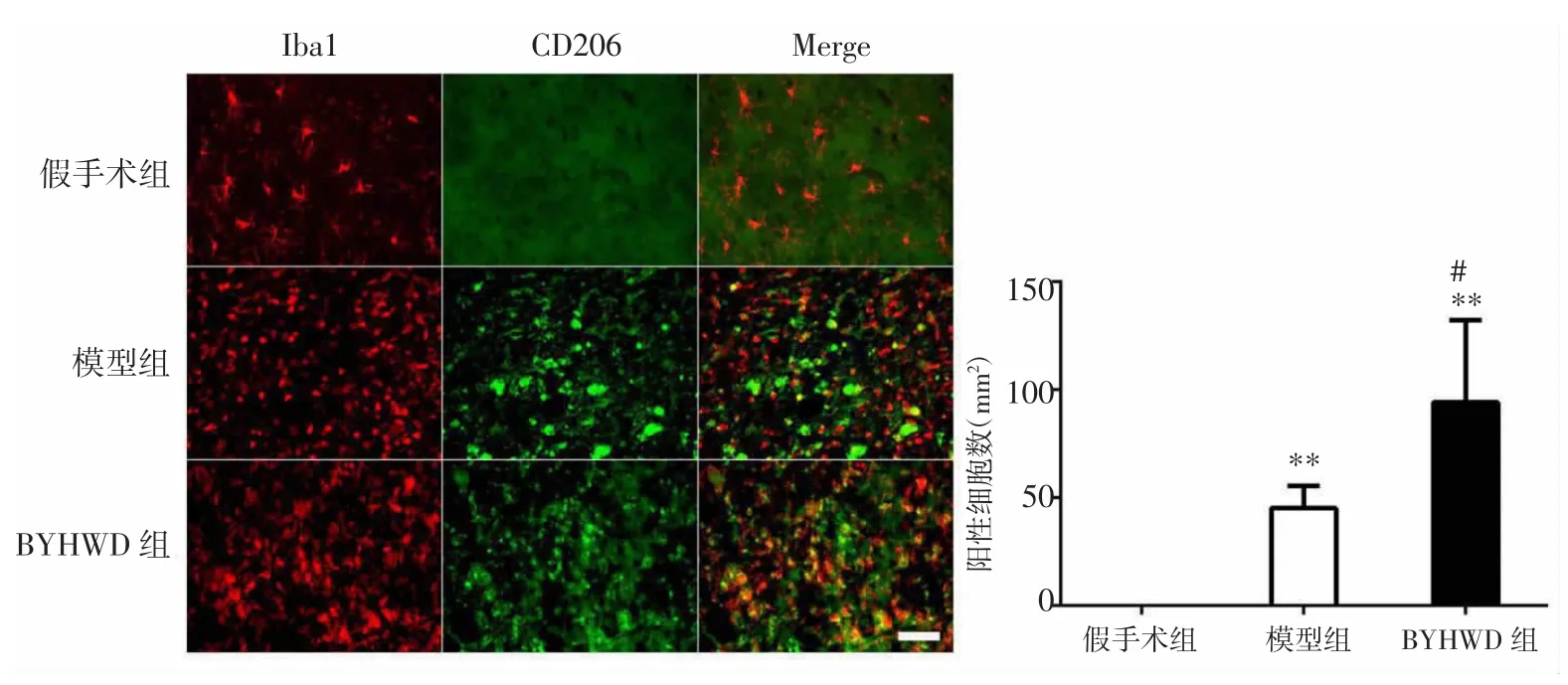
圖2 BYHWD對腦缺血大鼠小膠質細胞/巨噬細胞M2型極化的影響(比例尺:50μm,400×)Fig.2 Effect of BYHWD on M2 polarization of microglia/macrophageafter cerebral ischemia in rats(scale bar:50μm,400×)
2.4 BYHWD對大鼠腦缺血后M2型小膠質細胞/巨噬細胞標記物mRNA表達的影響 大鼠腦缺血后第14天,qRT-PCR檢測提示,與假手術組比較,模型組CD206、IL-10 mRNA 表達顯著增加(P<0.05,P<0.01),而Arg-1和TGF-β mRNA表達則無統計學差異(P>0.05);BYHWD 組 CD206、Arg-1、IL-10 和 TGF-β mRNA表達均顯著增加(P<0.01)。與模型組比較,BYHWD組CD206、Arg-1、IL-10和TGF-β mRNA 表達顯著增加(P<0.01)。見圖 4。
3 討論
BYHWD是中醫臨床治療腦缺血及其后遺癥的代表方劑。前期大量研究表明,BYHWD能夠促進腦缺血后神經功能恢復,減少梗死體積,其機制與抑制神經細胞凋亡、抑制氧化應激和炎癥反應以及促進神經發生和血管生成等有關[8-10]。本研究進一步發現BYHWD促進腦缺血后小膠質細胞/巨噬細胞從M1型向M2型轉化,抑制神經炎癥反應。

圖3 BYHWD對大鼠腦缺血后M1型小膠質細胞/巨噬細胞標記物mRNA表達的影響Fig.3 Effect of BYHWD on the mRNA expression of M1 microglia/macrophage markers after cerebral ischemia in rats

圖4 BYHWD對大鼠腦缺血后M2型小膠質細胞/巨噬細胞標記物mRNA表達的影響Fig.4 Effect of BYHWD on the mRNA expression of M2 microglia/macrophage markers after cerebral ischemia in rats
生理情況下,小膠質細胞呈分枝狀,突起不斷伸縮監視腦內微環境,維持中樞神經系統穩態。腦損傷后小膠質細胞迅速被激活,胞體變大,突起收縮呈阿米巴樣,并向損傷區遷移[3-4]。與巨噬細胞一樣,激活的小膠質細胞有M1和M2兩種表型。M1型小膠質細胞高表達CD16/32、CD86、主要組織相容性復合體Ⅱ(major histocompatibility complexⅡ,MHCⅡ)和 i-NOS,釋放促炎因子 TNF-α、IL-1β、IL-6、NO 和活性氧(reactive oxygen species,ROS)等加劇神經損傷;而M2型高表達CD206、Arg1、Ym1以及抵抗素樣分子-α(resistin-like molecule-α,RELM-α),釋放抗炎因子IL-10和TGF-β,同時釋放IGF-1和腦源性神經營養因子(brain derived neurotrophic factor,BDNF)等神經營養因子,促進炎癥消退和神經修復[5-6]。因此,本研究中選擇 CD16/32、CD86、iNOS、TNF-α、IL-1β和IL-6等作為M1型小膠質細胞/巨噬細胞標記物,CD206、Arg-1、IL-10 和 TGF-β 等作為 M2 型小膠質細胞/巨噬細胞標記物。
Hu等[7]首次在大鼠局灶性腦缺血模型中發現,缺血后1~3d,M2型小膠質細胞/巨噬細胞數量開始增加,3~5d達到高峰,7d開始減少,14d恢復到損傷前水平;而M1型小膠質細胞/巨噬細胞數量在缺血后3d開始增加,持續到缺血后14d。在創傷性腦損傷和脊髓損傷中也發現類似現象[13]。因此,促進腦損傷后小膠質細胞/巨噬細胞從M1型向M2型轉化為腦損傷的治療提供了一個新思路[14]。隨后大量研究發現,藥物可通過促進腦缺血后小膠質細胞/巨噬細胞從M1型向M2型轉換,以改善神經功能。如:姜黃素[15]、紅景天苷[16]、二甲雙胍[17]、西地那非[18]等。本研究中免疫熒光雙標結果顯示,缺血后第14天,與模型組比較,BYHWD組小膠質細胞/巨噬細胞的M1型標記物CD16/32表達減少,而M2型標記物CD206表達增加。qRT-PCR結果進一步顯示,BYHWD抑制M1型小膠質細胞/巨噬細胞表面標記物CD86、iNOS以及其分泌的促炎因子TNF-α、IL-1β和IL-6的mRNA表達。相反,BYHWD促進M2型小膠質細胞/巨噬細胞表面標記物CD206、Arg-1及其分泌的抗炎因子IL-10和TGF-β mRNA表達,與免疫熒光雙標結果一致。上述結果提示,BYHWD促進腦缺血后小膠質細胞/巨噬細胞從M1型向M2型轉化,從而抑制炎癥反應。
此外,近年來研究發現激活的小膠質細胞/巨噬細胞對神經發生也有損傷和促進的雙重作用[5-6]。其中M1型小膠質細胞/巨噬細胞通過釋放TNF-α、IL-1β和IL-6等促炎因子對神經發生起到損傷作用[19],而M2型小膠質細胞/巨噬細胞通過分泌IGF-1和TGF-β等神經營養因子促進神經發生[20]。進一步研究發現,二甲雙胍、米諾環素和茶多酚等藥物誘導腦缺血后神經發生與其促進小膠質細胞/巨噬細胞由M1型向M2型轉化有關[17,21-22]。筆者前期研究發現BYHWD促進腦缺血后神經發生和神經功能恢復[9-10],機制是否與其促進小膠質細胞/巨噬細胞向M2型極化有關尚需進一步研究。
總之,本研究結果提示BYHWD可能通過促進腦缺血后小膠質細胞/巨噬細胞從M1型向M2型轉化,從而抑制缺血再灌注炎癥反應,但是BYHWD調控腦缺血后小膠質細胞/巨噬細胞極化的分子機制以及意義尚待進一步研究。

