莖瘤芥新鮮種子總RNA提取研究
□ 符純愿 鄭曉華 林涵梅 廣東省食品工業研究所有限公司
1 引言
1.1 研究背景、目的及意義
莖瘤芥又名青頭菜,屬十字花科蕓薹屬芥菜種葉芥亞種大葉芥變種的變種,其最初由野生芥菜(Brassica juncea)進化而來,其進化次序是野生芥菜芥菜→大葉芥(Var. rugosa BaiLey)→筍子芥(Var. crassicauLis chen et ang)→莖瘤芥。在漫長的進化過程中,芥菜(Brassica. Juncea Coss. and Czern)分化出許多類型和品種。由莖瘤芥制成的榨菜質地脆嫩,風味鮮美,營養豐富,具有一種特殊的風味,具有特殊酸味和咸鮮味,脆嫩爽口,含豐富的人體所必需的蛋白質、胡蘿卜素、膳食纖維、礦物質等,以及谷氨酸、天門冬氨酸、丙氨酸等17種游離氨基酸。現今,人們對莖瘤芥所作的研究大多還停留在栽培、育種等宏觀水平上[1-4],在分子水平上的研究還比較少。
1.2 實驗技術路線
核酸分為DNA和RNA兩大類。根據DNA核蛋白和RNA核蛋白溶解度的研究發現,在氯化鈉濃度為0.41 mol/L時,DNA核酸蛋白的溶解度僅為水中的1/10,當氯化鈉濃度增加時,DNA核蛋白的溶解度逐漸增加,氯化鈉濃度增至1 mol/L時,DNA核蛋白溶解度比水中大2倍。而RNA核蛋白在0.41 mol/L氯化鈉濃度時仍有相當大的溶解度;當氯化鈉濃度增大時,溶解度又相對減少目前,關于莖瘤芥種子RNA的提取還沒有明確的方法,應用較多的有CTAB法、SDS法以及商業試劑盒Trizol等[5-6]。
CTAB法的最大優點是能很好地去除糖類雜質,所以對于莖瘤芥這類含酚類物質及糖類物質較高的植物材料,采用CTAB法是比較理想的。該方法的另一個優點是在提取的前期能得到高含量的DNA與RNA,可根據實驗的需要,分別進行純化。本次試驗根據前人的研究,由于莖瘤芥種子含有較高的酚類物質及糖類物質,為了使研究更準確,故采用CTAB法[7-9]。
2 材料與方法
2.1 材料
莖瘤芥種子(永安小葉,貯藏期為1年以內),由重慶涪陵種子公司提供。
2.2 莖瘤芥新鮮種子總RNA的提取方法
2.2.1 種子消毒處理
選擇均一完好的莖瘤芥新鮮種子于培養皿,用2%過氧化氫浸泡5 min進行消毒處理,消毒完成用蒸餾水沖洗數次后,徹底洗凈過氧化氫,晾干后-20 ℃冰箱下保存。
2.2.2 硫酸銅處理
取12份預處理好的種子,每份0.2 g,硫酸銅溶液的濃度為0、5、10、20 mg/L,分別用各種濃度的硫酸銅溶液對預處理好的種子在25 ℃下進行浸種處理,每一種濃度的溶液均對種子進行4 h、8 h、12 h處理,然后分別進行總RNA提取研究。
2.2.3 總RNA的提取方法
取經過氧化氫消毒的新鮮種子0.2 g放入預冷的研缽中,迅速加入2 mL預冷的提取液,快速研磨1 min,轉移至2 mL離心管中混勻,65℃溫浴30 min,期間混勻2~3次。加入0.5倍體積酚,混勻后冰浴15 min。12 000 r/min離心10 min,取上清液轉入新的離心管中,加入一倍體積酚∶氯仿(1∶1),混勻。
12 000 r/min離心10 min,取上清液裝入新的離心管中,加入一倍體積氯仿,混勻(此步驟重復2次)。
12 000 r/min離心10 min,取上清液裝入新的離心管中,加入1/3體積8 mol/L LiCl,混勻,在-20 ℃放置2 h。12 000 r/min離心10 min,棄去上清液,用70%乙醇快速洗滌,將沉淀溶解于500 μL SSTE溶液中。加入一倍體積氯仿∶異戊醇(24∶1),混勻。
12 000 r/min離心10 min,取上清液裝入新的離心管中,加入一倍體積氯仿∶異戊醇(24∶1),混勻(此步驟重復2次)。
12 000 r/min離 心10 min, 取上清液裝入新的離心管中,加入50 μL 3mol/L NaAc,混勻,再加入2倍體積無水乙醇,混勻,-20 ℃放置30 min。12 000 r/min離心10 min,輕輕棄去上清液,加入1 mL 70%乙醇洗滌。
12 000 r/min離心2 min,輕輕棄去上清液,加入1 mL 70%乙醇洗滌(此步驟重復2次)。
12 000 r/min離心2 min,棄去上清液,注意不要倒出沉淀物。離心管壁殘留液經瞬時離心后,用洗頭吸出殘液,室溫晾干沉淀。加入25 μL已滅活的DEPC水,充分溶解RNA,-20℃保存備用[10-14]。
2.3 總RNA濃度和純度的檢測方法
當OD260/OD280比值在1.8~2.0時,認為RNA中蛋白或者時其他有機物的污染是可以接受的,但當OD260/OD280比值小于1.8時,溶液中蛋白或者時其他有機物的污染比較明顯,當OD260/OD280比值大于2.2時,說明RNA已經降解。
①計算OD260/OD280、OD260/OD230。② RNA濃 度(μg/mL)=OD260×40 μg/mL×稀釋倍數。③RNA得率(μg/g)=RNA濃度(μg/mL)×體積(mL)/取材量(g)。
3 結果與分析
3.1 瓊脂糖凝膠電泳檢測結果
從電泳圖可以看出,都有比較清晰的條帶。顯示出28S rRNA和18S rRNA 2條完整的帶型,且前者的亮度約為后者的2倍。試驗結果表明得到的總RNA既未發生降解,又沒有DNA、蛋白質、酚和多糖等雜質污染,質量和純度較高。
3.2 RNA樣品吸光度值的測定
RNA樣品在230 nm、260 nm和280 m波長處的OD值見表1。
提取所得總RNA的OD260/OD280比值在1.8~2.0,OD260/OD230比值在2.0左右是最佳比值。說明提取所得總RNA受多糖、多酚和蛋白質等污染較少,純度較高。
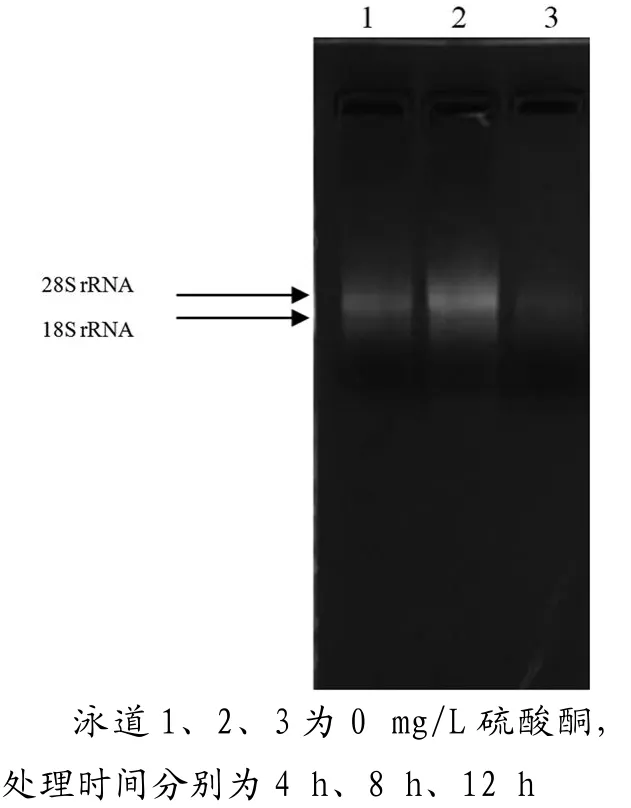
圖1 總RNA瓊脂糖凝膠電泳圖

圖2 總RNA瓊脂糖凝膠電泳圖
3.3 結果與分析
從電泳圖中電泳條帶可以看出,圖1條帶亮度最清晰,其中尤其是0mg/L,8 h的處理最為明顯,無論從亮度比還是清晰度都特別明顯,OD值分析中,OD260/OD280為1.94,OD260/OD230為2.26,均達到最佳比值,因此這個處理是最佳處理。其他的電泳圖與OD值之間并沒特別明顯的規律,但總體來說,0 mg/L處理的都比其他濃度處理要清晰,可以說明硫酸銅濃度越高處理時間越長對于提取RNA有抑制的作用。
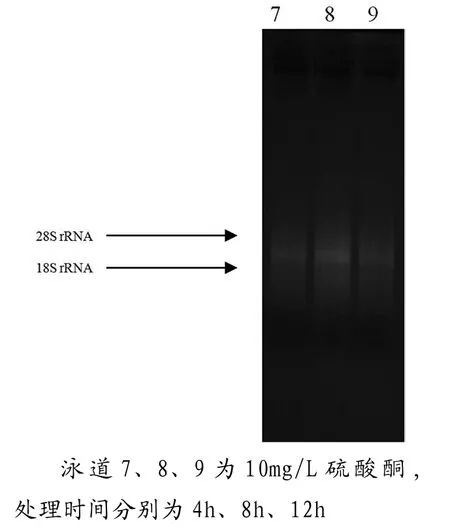
圖3 總RNA瓊脂糖凝膠電泳圖
4 小結
在提取植物種子RNA的實驗中,一般實驗室都是利用種子培育出幼苗葉片為材料,經液氮研磨提取RNA。此過程必須要經過浸種催芽、幼苗培養、液氮研磨等過程,一般要用兩周左右的時間才能進行RNA的提取并進一步開展實驗。此方法是在實驗條件不足的情況下通過添加提取液研磨來抑制RNase的活性,且不需要育種等培育過程,直接用處理好的種子進行研磨,整個實驗過程約在10 h即能檢測效果,能量大重復進行,盡管效果一般,但也能提取出能進行后續實驗的RNA,對于一般性實驗已經足夠,可為植物RNA的提取提供新的思路。
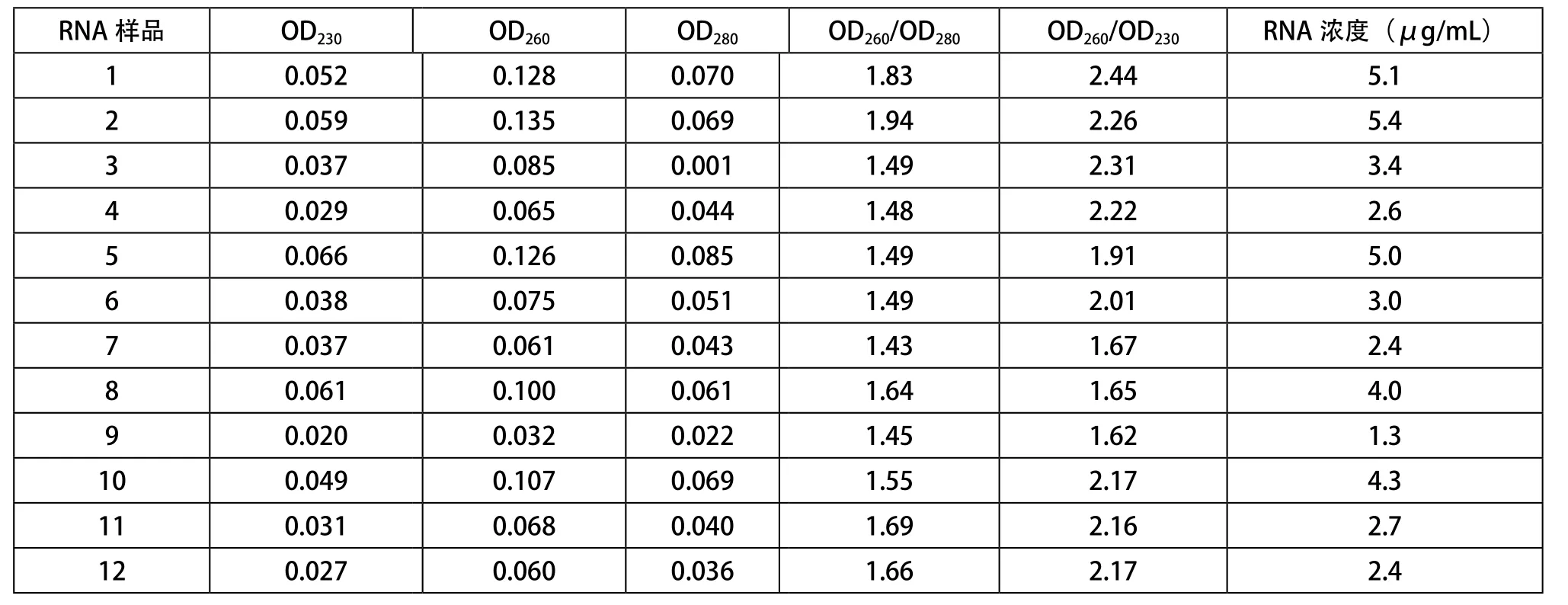
表1 RNA樣品的OD值
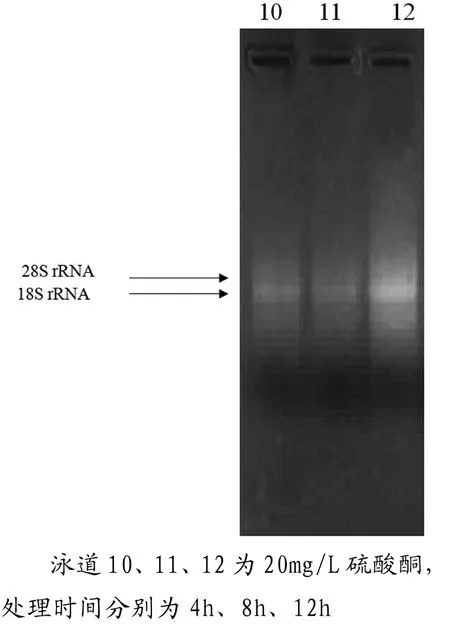
圖4 總RNA瓊脂糖凝膠電泳圖


