不同品種豇豆發酵過程中質構品質變化及產植物細胞壁降解酶微生物種類分析
厙 曉,錢 楊,李婭琳,何鵬暉,蔣珍菊,常 偉,龔 麗,饒 瑜
(1.西華大學食品與生物工程學院,四川成都 610039;2.西華大學理學院,四川成都 610039;3.成都產品質量檢驗研究院有限責任公司,四川成都 610100;4.通標標準技術服務有限公司四川分公司,四川成都 610100)
豇豆(VignaunguiculataL.),別名長豆角、飯豆、裙帶豆等,屬豆科一年生植物。莖有矮性、半蔓性和蔓性三種。豇豆喜溫,主要在夏秋兩季上市,其食用方法很多,泡制是一種最常見的貯藏和食用方式[1]。發酵豇豆(fermented-cowpea)是我國傳統特色發酵食品[2],也是我國產銷量較高的四川泡菜之一,不僅美味爽口,而且具有解膩開胃、促消化等功效[3-4]。無論是在家庭制作還是工廠生產中,發酵豇豆都是最易發生腐敗的泡菜之一,這是由于四川泡菜原料自身攜帶了多種微生物,其中包括易造成泡菜腐敗的微生物[5]。
發酵豇豆的主要腐敗特征表現有軟腐、產生酸敗腐爛味、“生花”即形成膜醭等[5]。蔬菜軟腐是由于部分微生物具有產植物細胞壁降解酶(plant cell wall degradation enzymes,PCWDEs)的特性,PCWDEs主要包括淀粉酶、纖維素酶、果膠酶、多聚半乳糖醛酸酶等,這些酶能分解泡菜中的纖維素、果膠、木質素等[6-7],從而導致蔬菜質地變軟,引起蔬菜軟腐。目前對新鮮蔬菜中產PCWDEs的微生物報道較多,且多為真菌,但對發酵蔬菜尤其是發酵豇豆中產PCWDEs的微生物報道甚少,而這些微生物代謝所產生的PCWDEs是造成蔬菜軟腐的重要因素,也是發酵蔬菜行業造成巨大經濟損失的主要原因。
本文選用不同品種的豇豆,用配制的老鹽水發酵制作發酵豇豆,研究發酵過程中發酵豇豆的質構品質變化并對產PCWDEs微生物種類進行分析,以期為發酵蔬菜的生產和貯藏提供一定的參考。
1 材料與方法
1.1 材料與儀器
豇豆 具體品種見表1,購于蔬菜基地;老鹽水活化用的蘿卜、豇豆、大蒜、生姜、花椒等 購買于當地的菜市場;老鹽水 采集于當地一家庭;DNA Marker、Taq DNA連接酶(2.5 U/μL)、dNTPs、DNA提取試劑盒、DNA純化試劑盒 北京天根生化科技有限公司;RNase A 美國Sigma公司;胰蛋白胨大豆瓊脂(tryptone soy agar,TSA)培養基、胰蛋白胨大豆肉湯(tryptone soy broth,TSB)培養基、MRS瓊脂培養基、虎紅瓊脂培養基 北京奧博星生物技術有限公司;蛋白酶(protease)鑒別培養基(以TSA培養基為基礎,添加1%脫脂牛奶)、淀粉酶(amylase)鑒別培養基(以TSA培養基為基礎,添加1%可溶性淀粉)、纖維素酶(cellulase)鑒別培養基(以TSA培養基為基礎,添加0.1%羧甲基纖維素,25 mmol/L磷酸鈉,pH7.0)、木聚糖酶(xylanase)鑒別培養基(以TSA培養基為基礎,添加1%木聚糖,25 mmol/L磷酸鈉,pH7.0)、果膠酶(pectate lyase)鑒別培養基(以TSA培養基為基礎,添加1%多聚半乳糖醛酸(PGA),1%酵母提取物,0.38 μmol/L CaCl2,100 mmol/L Tri-HCl,pH8.5)、聚半乳糖醛酸酶(polygalacturonase)鑒別培養基(以TSA培養基為基礎,添加1%多聚半乳糖醛酸(PGA),1%酵母提取物,2.2 mmol/L EDTA,110 mmol/L乙酸鈉,pH5.5) 實驗室自制;其他化學試劑 均為分析純。

表1 供試豇豆品種來源及特性Table 1 Sources and characteristics of tested cowpea varieties
TA-XT Plus型質構儀 英國Stable Micro Systems公司;Master cycler EP gradient聚合酶鏈式反應(polymerase chain reaction,PCR)儀 德國Eppendorf公司;Gel Doc EQ凝膠成像系統 美國Bio-Rad公司;DYY-8C電泳儀 北京六一儀器廠;pH S-3C酸度計 成都世紀方舟科技有限公司;MULTIFUGE X1R高速冷凍離心機、900 SERIES超低溫冰箱 賽默飛世爾科技有限公司。
1.2 實驗方法
1.2.1 老鹽水的活化 用無菌肖特瓶從當地一家庭采集老鹽水1000 mL,置于冰盒中,2 h內運送到實驗室,備用。將洗凈晾干的蘿卜、豇豆、大蒜、生姜、花椒等裝入30 L的土陶壇至2/3處,加入1000 mL老鹽水,并用含NaCl質量濃度60 g/L的冷開水補至土陶壇總體積的4/5處,液封,在25 ℃下發酵7 d,備用。
1.2.2 發酵豇豆的制作 將不同品種豇豆樣品洗凈、晾干,分別裝入10 L玻璃壇子至2/3處,接入活化后的老鹽水30 mL,再用NaCl質量濃度為60 g/L的冷開水補至玻璃壇總體積的4/5處,料液比約2∶1。液封,每個品種三個平行,在25 ℃下發酵24 d,每隔4 d取適量豇豆及鹽鹵檢測。
1.2.3 pH的測定 在豇豆發酵過程中每隔4 d用無菌移液管在無菌操作臺中移取10 mL鹽鹵,用pH計測定鹽鹵pH。
1.2.4 微生物計數 在不同品種豇豆的發酵過程中,每隔4 d取鹽鹵樣品并進行總菌、乳酸菌、真菌計數。參照GB 4789.2-2016《食品安全國家標準 食品微生物學檢驗 菌落總數測定》的方法制備樣品稀釋液,選取適當的稀釋度涂布于培養基。TSA培養基用于總菌落計數,MRS瓊脂培養基用于乳酸菌計數,虎紅瓊脂培養基用于真菌計數。
1.2.5 感官評價 在豇豆發酵過程中采用綜合評分法,以泡菜的色澤、香氣、鹽鹵渾濁度、膜醭生長情況為評價指標,以每個項目25分制評定,綜合評分滿分為100分,通過30名不同年齡階段的食品專業人員測評,測評人員的年齡在20~40歲之間,男∶女=2∶3,評價方式采用風味食品常用的盲評打分法,統計平均評價分值作為有效數據,評分按表2進行。

表2 發酵豇豆感官指標評價標準Table 1 Sensory evaluation standard of fermented cowpea
1.2.6 質構的測定 采用質構儀進行測定,探頭P/5。測試程序:測試前速度2 mm/s,測試速度3 mm/s,測試后速度2 mm/s,測定間隔時間5 s,壓縮量30%,壓縮力5.0 g,測定發酵豇豆的硬度、彈性、咀嚼性。每組試驗重復5次,以平均值表示試驗結果[8]。
1.2.7 產PCWDEs微生物的分離及特性分析 在四種豇豆發酵的第24 d,從鹽鹵固體培養基中各隨機挑取30株菌進行產PCWDEs檢測,編號分別為A-1~A-30、B-1~B-30、C-1~C-30、D-1~D-30,分別用6種產酶特性鑒別培養基培養進行產PCWDEs檢測[9],于28 ℃培養24 h后觀察各菌株產PCWDEs情況。判定方法:蛋白酶,可直接觀察透明區域;聚半乳糖醛酸酶和果膠酶,用4 N鹽酸加在菌落周圍并觀察透明區域;淀粉酶,用碘液染色并觀察透明區域;纖維素酶和木聚糖酶,用0.1%剛果紅溶液染色15~30 min,再用1 mol/L NaCl沖洗數次,觀察菌落周圍透明區域;若有透明區域,則表示此菌株產PCWDEs。
1.2.8 產PCWDEs微生物的分子生物學鑒定 對產植物細胞降解酶的單克隆菌株進行分子生物學鑒定。使用蔣云露等[10]研究的快速提取法提取總DNA,1.0%瓊脂糖凝膠電泳檢驗提取結果[11]。以提取的DNA為模板,細菌以引物Eu27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1490R(5′-GGTTACCTTGTTACGACTT-3′)為正向和反向引物;PCR體外擴增條件為:95 ℃、5 min;95 ℃、1 min、50 ℃、1 min、72 ℃、2 min,35個循環;72 ℃、10 min,進行16S rDNA片段擴增。真菌以引物ITS4(5′-TCCTCCGCTTATTGATATGC-3′)和ITS5(5′-GGAAGTAAAAGTCGTAACAAGG-3′)為正向和反向引物,其PCR體外擴增條件為:94 ℃、1 min;94 ℃、1 min,52 ℃、1 min,72 ℃、1 min,30個循環;72 ℃、5 min,進行18S rDNA片段擴增。將PCR擴增產物進行回收純化,送成都擎科梓熙生物技術有限公司測序,測得的序列于NCBI數據庫進行blast比對,其同源性≥97%時可認為是同一個屬,同源性≥98%時可認為是同一個種[7],并通過Clustal X軟件多重比對后用MEGA 6.0軟件中的Neighbor-Joining法構建系統發育樹[5],并對四種發酵豇豆中產PCWDEs微生物的種類進行分析。
1.3 數據統計分析
利用OriginLab 8.0軟件、MEGA 6.0軟件、Clustal X軟件、SPSS軟件、Excel 2007對實驗的數據進行處理。
2 結果與分析
2.1 不同品種豇豆發酵過程中的pH變化
以不同品種豇豆為原料進行發酵,在豇豆發酵過程中鹽鹵的pH變化有明顯的品種特異性(如圖1所示)。豇豆品種A在發酵過程中pH下降最快,第4 d時pH已達到4.0;豇豆品種C在發酵的第8 d時pH可降至4.7。pH是表征泡菜乳酸發酵成熟和泡菜腐敗的重要指標之一[12]。泡菜中的乳酸發酵是乳酸菌利用蔬菜中的糖進行厭氧發酵生成乳酸的過程,因此泡菜的發酵過程常伴隨著鹽鹵pH的下降。通常認為鹽鹵pH降至4.0左右時,泡菜發酵成熟[13]。以鹽鹵pH為參照,豇豆品種A發酵成熟速度最快。
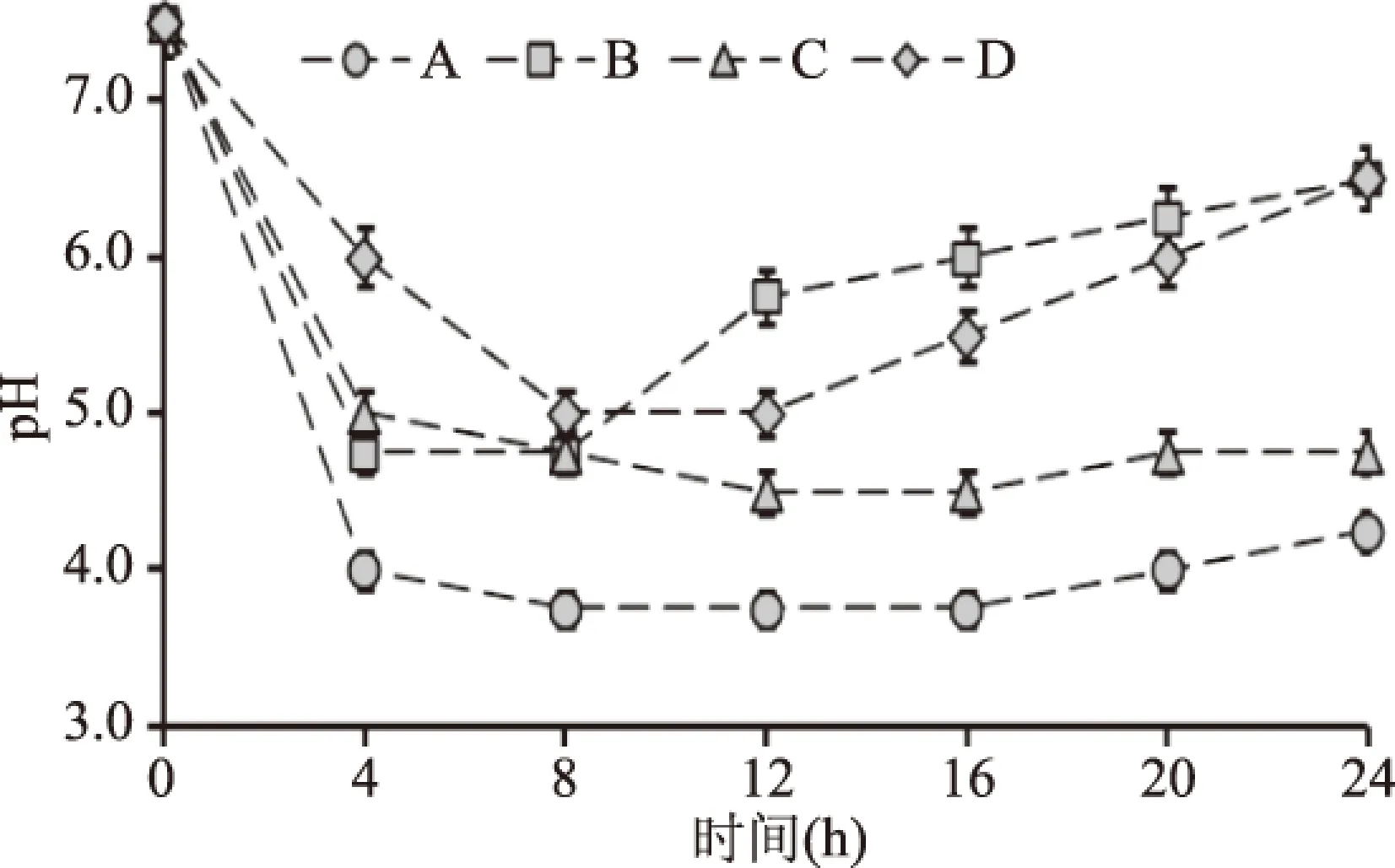
圖1 發酵過程中豇豆的pH變化Fig.1 The pH change of cowpea during fermentation
豇豆品種A和C在12~24 d保持pH相對恒定。豇豆品種B和D在發酵前8 d pH呈下降趨勢,隨即pH開始上升,第24 d時已回升至pH6.5以上。在泡菜發酵和儲藏過程中,鹽鹵pH的回升則是判斷泡菜腐敗的重要標志之一[12],這是由于某些微生物可以耐受低pH而生長,消耗以乳酸為主的有機酸或產PCWDEs造成泡菜腐敗[14]。由此可以看出,豇豆品種B和D在發酵后期和儲藏過程中更易發生腐敗。
2.2 不同品種豇豆發酵過程中的微生物變化
鹽鹵pH的變化主要由微生物生長代謝引起[12]。泡菜發酵過程中的微生物主要來源于蔬菜自身攜帶和所接種老鹽水中的微生物。本研究中所用老鹽水均為同一壇同一批次的老鹽水,因此在發酵過程中微生物數量變化的差異主要源于豇豆品種的不同。
不同品種豇豆發酵過程中的微生物群落變化表現出與鹽鹵pH變化一致的品種特異性。如圖2a,豇豆品種A發酵前期中乳酸菌生長最快,第4 d時已高于6.0 lg cfu/mL,第8 d時乳酸菌和總菌均達到最高,分別高于7.0、8.0 lg cfu/mL,這與豇豆A發酵過程中pH下降最快的結果相符,豇豆品種A在發酵過程中pH與乳酸菌的數量之間存在極顯著相關(r=0.888,p<0.01),這說明蔬菜在乳酸發酵過程中乳酸菌的生長與鹽鹵pH的下降相關,這與熊濤等[15]的研究一致。豇豆品種B、C、D發酵前期乳酸菌生長速度較品種A慢(圖2),這是這三種品種豇豆發酵前期鹽鹵pH下降相對緩慢的主要原因。不同品種的豇豆中還原糖、蛋白質、粗纖維等營養成分存在顯著差異[16],這是影響發酵過程中微生物群落生長差異的主要因素之一。
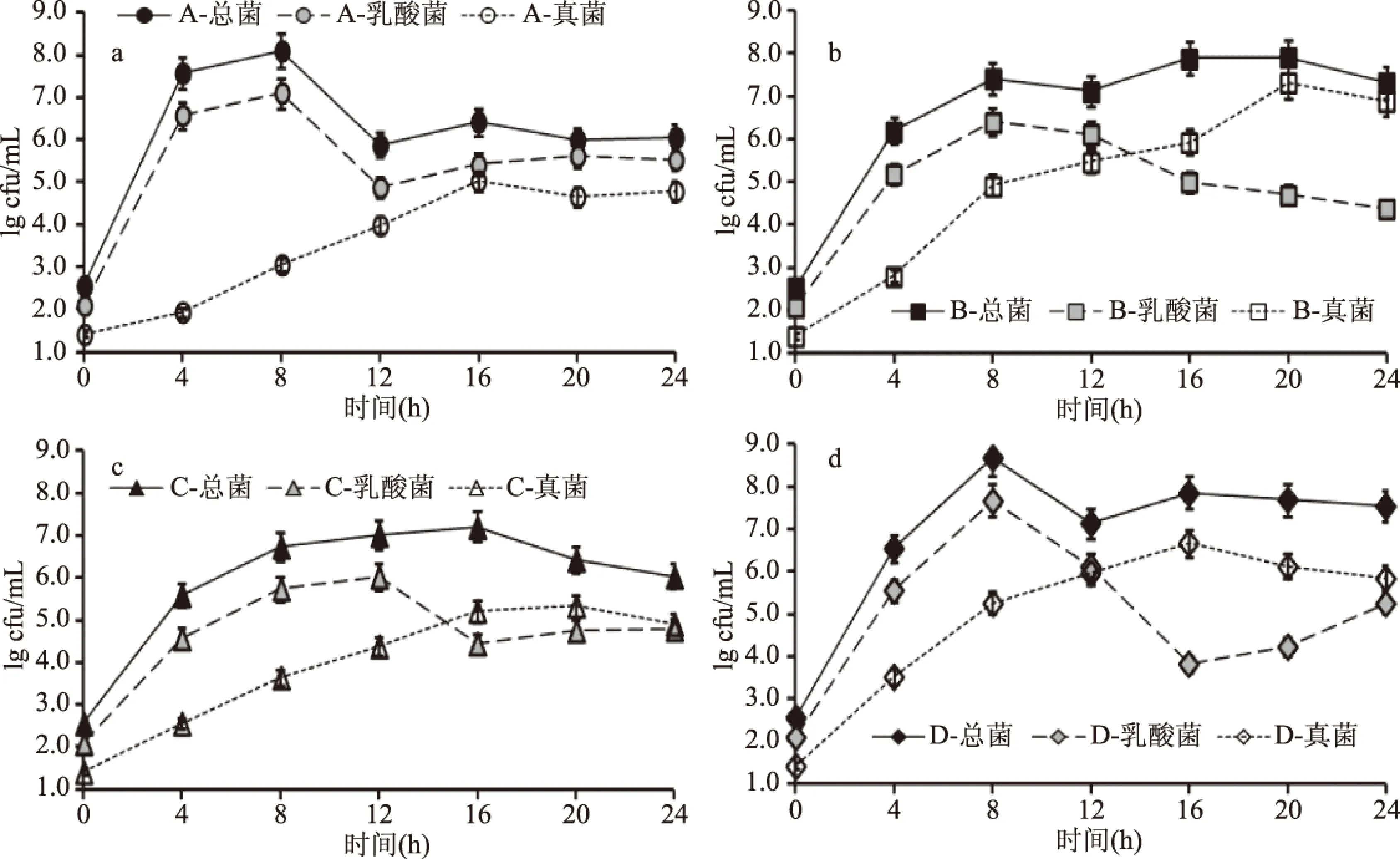
圖2 發酵過程中豇豆的微生物變化Fig.2 Microbial changes of cowpea during fermentation
發酵12 d后,品種A發酵豇豆中總菌和乳酸菌數量分別下降并隨即趨于平衡,真菌數量先增加后下降最后在4.5 lg cfu/mL左右波動(圖2);豇豆品種B、品種C和品種D中乳酸菌于12 d后開始減少,但總菌數量仍高于7.0 lg cfu/mL;真菌數量也持續增長,特別是品種B于15 d時發酵豇豆中的真菌數量可達到(5.9±0.3) lg cfu/mL,隨后持續增加,在發酵20 d時達到(7.3±0.4) lg cfu/mL。在整個發酵過程,品種A的pH、微生物數量變化與一般蔬菜在發酵過程的相似,而品種B、C、D在發酵過程中pH均未下降至4.0左右,且發酵后期的真菌數量明顯高于品種A的,這可能與豇豆的品種有關。
2.3 不同品種豇豆發酵過程中的感官評價分析
在實驗過程中,部分發酵豇豆在發酵第12 d開始出現腐敗膜醭,到第24 d時,發酵結束,由此對第12、24 d的發酵豇豆進行感官分析,其結果見表3。
由表3知,品種A在發酵第12、24 d時的感官評價得分均最高,發酵過程中,其色澤新鮮、鹽鹵清亮,有著較濃的泡菜香氣;品種B最低,在發酵第12 d時色澤偏暗沉,鹽鹵表面有連成一片的膜醭,第24 d時色澤發黑,鹽鹵渾濁;品種C與品種D在發酵第12 d時表現出正常的泡菜的品質,但在發酵第24 d時,色澤偏暗沉、出現腐爛味、鹽鹵較渾濁,泡菜品質下降,但好于品種B。
2.4 不同品種豇豆發酵過程中的質構分析
分別在發酵開始(第0 d)、部分發酵豇豆出現腐敗膜醭(第12 d)、發酵結束(第24 d)時取不同品種豇豆樣品,從硬度、咀嚼性和彈性三個特征參數來分析不同豇豆樣品的質構變化,結果如圖3。在發酵第0 d時,不同品種豇豆的硬度、彈性、咀嚼力差異不顯著(p>0.05),品種B的彈性(0.8825)略低于其他三個品種(0.92左右)。發酵前12 d,豇豆的硬度、咀嚼力降低很快,其中品種C的硬度下降率為81.97%,品種A、B、C的下降率在60%左右;發酵第12 d時,4個品種豇豆的硬度、彈性、咀嚼力差異均不顯著(p>0.05),但硬度和咀嚼力與發酵第0 d的差異顯著(p<0.05)。在發酵的12~24 d中,品種B的硬度、彈性、咀嚼力下降率分別為68.97%、48.50%、63.43%,而其余品種豇豆下降率都比品種B小;第24 d時品種B的彈性與其余三種豇豆有顯著性差異(p<0.05)。由表3知,發酵第24 d時,品種B表現出的感官品質最差,品種A最好;相比于品種C和品種D,品種A的質構特征更好,這也是品種A在發酵過程中鹽鹵清亮、色澤新鮮的重要原因之一。
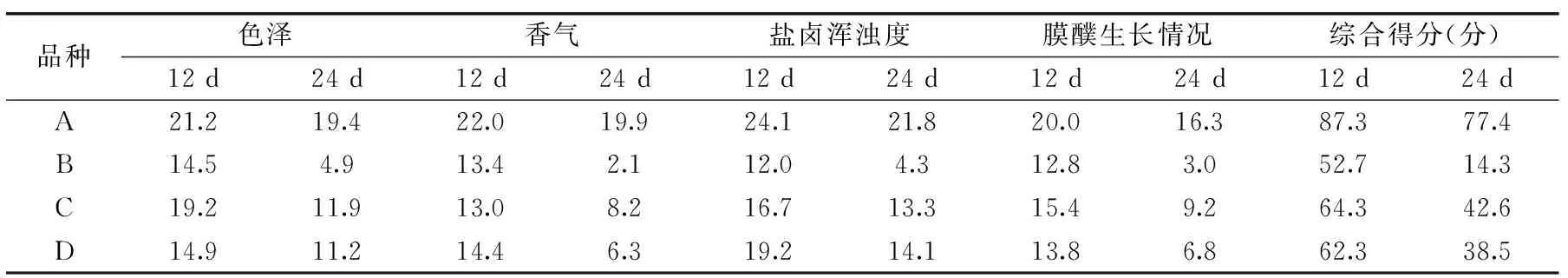
表3 感官評價結果Table 3 Results of sensory evaluation
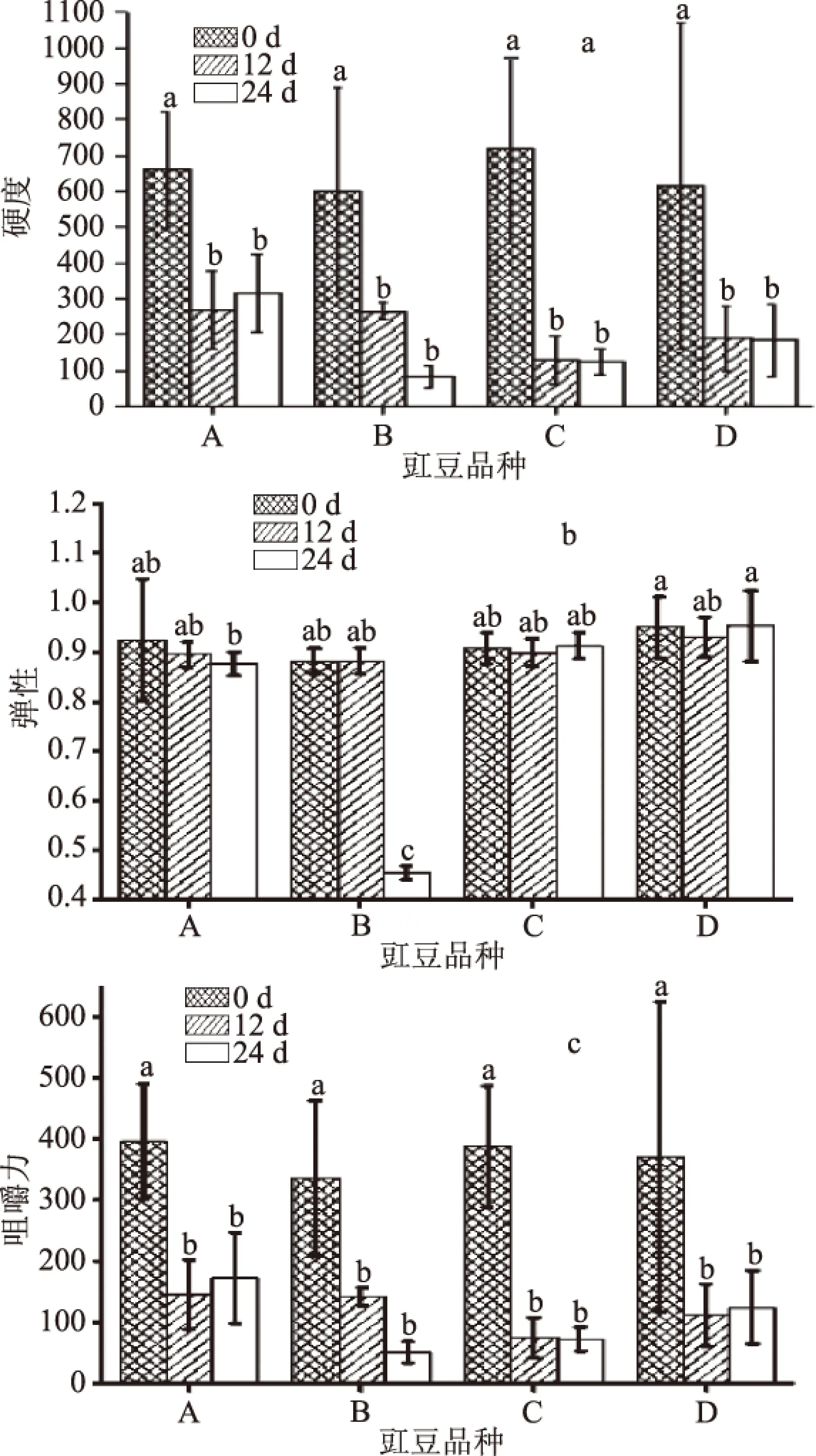
圖3 發酵豇豆質構測試結果Fig.3 Results of texture test of cowpea during fermentation注:誤差線上的a~d表示不同豇豆不同時間之間的顯著性差異。
蔬菜原料的品種會影響其發酵產品的品質。近年來已有報道不同品種芥菜、辣椒、蘿卜等在發酵后表現出不同的風味、質構、亞硝酸鹽等產品品質特征[17-18]。陳玲等[19]發現3種豇豆品種發酵后的總酸、還原糖和感官品質均有差異,周情操[20]以湖北地區9個豇豆品種為原料泡制后產品風味和質構也有較大不同。除不同品種蔬菜自身的差異之外,這些風味和質構的不同主要受發酵過程中微生物的生長代謝情況影響[21-22]。本研究中品種A豇豆發酵前期乳酸菌生長和鹽鹵pH下降速度快,后期微生物數量降低,pH穩定維持在較低水平,并表現出正常的發酵豇豆風味和質構;其他品種豇豆尤其是品種B豇豆在發酵后期微生物數量的增加和pH的上升,這三種發酵豇豆出現不同程度的軟腐,這可能與豇豆的品種以及PCWDEs微生物種類有關。
2.5 腐敗微生物產PCWDEs微生物種類分析
微生物產PCWDEs是導致蔬菜軟腐的重要原因之一[9],菌株的具體產酶情況見表4。檢測發現有45株產PCWDEs,其中品種A中的最少,有6株;品種B中的最多,有19株;品種C、D中分別有11株和9株。品種B中產PCWDEs的微生物及產酶種類最多,而品種A最少;實驗發現產蛋白酶與淀粉酶的菌株最多,產纖維素酶的最少;部分菌株同時產多種酶,如菌株B-1同時產淀粉酶、果膠酶、木聚糖酶。
將表4中的菌株進行16S rDNA及18S rDNA鑒定,結果發現這些菌株分屬于13個種,10個屬,進行系統發育樹構建,結果見圖4。對四種發酵豇豆中產PCWDEs微生物種類進行分析,結果見表5。

表4 腐敗發酵豇豆中顯著產酶菌株的篩選結果Table 4 Screening results of significant enzyme-producing strains in spoiled fermented cowpea
結合表5和圖4可知,產蛋白酶的植物乳桿菌(Lactobacillusplantarum)和產淀粉酶的異常威克漢姆酵母(Wickerhamomycesanomalus)在4種發酵豇豆鹽鹵中均可檢測到。植物乳桿菌是泡菜發酵中常見的主要乳酸菌[23-24],但近年來已有研究發現植物乳桿菌可能參與了泡菜腐敗過程中的乳酸代謝[25-26]。本研究中,植物乳桿菌還可能通過產蛋白酶破壞發酵豇豆的質構。異常威克漢姆酵母是常見的產淀粉酶酵母菌[27],張騰[28]研究發現食鹽含量4%的泡菜真菌微生物的主要優勢微生物為異常威克漢姆酵母。

圖4 部分細菌(a)和真菌(b)系統發育樹的構建Fig.4 Phylogenetic tree of part of bacteria(a)and fungi(b)

表5 四種發酵豇豆中產PCWDEs微生物的種類Table 5 Types of PCWDEs-producing microorganisms in four fermented cowpeas
品種B發酵豇豆中產PCWDEs微生物數量和種類最多且產酶種類多樣,包括腸桿菌屬(Enterobacter)、弗氏檸檬酸桿菌(C.freundii)、黃褐假單胞菌(P.fulva)、松鼠葡萄球菌(S.sciuri)、成團泛生菌(P.agglomerans)、肺炎克雷伯氏菌(K.pneumoniae)和類香味菌(M.odoratimimus)等。腸桿菌是發酵蔬菜中常見的腐敗菌,Franco等[26]在黃瓜二次發酵中發現陰溝腸桿菌,Krishnan等[29]也在番木瓜果實里發現產淀粉酶、木聚糖等的腸桿菌。在以白菜為原料的腐敗泡菜中也發現了陰溝腸桿菌、產氣腸桿菌、弗氏檸檬酸桿、肺炎克雷伯氏菌和成團泛生菌等[30]。品種B發酵豇豆在24 d時的嚴重軟腐與其產PCWDEs微生物的種類、數量多和產酶類型多樣有關。
僅在品種D發酵豇豆中發現解鳥氨酸拉烏爾菌(R.ornithinolytica),Rao等[30]在研究四川泡菜的腐敗過程中分離得到解鳥氨酸拉烏爾菌,Zogaj等[31]在研究人體腸道細菌時發現解鳥氨酸拉烏爾菌產纖維素酶。由表3知,豇豆品種C、品種D和品種A中的產PCWDEs微生物種類和數量相差不大,但品種C和品種D中的微生物產PCWDEs的種類更豐富,從質構分析結果中也得出品種C、品種D的質構品質(圖3)好于品種B但又差于品種A。由此可見,發酵后期豇豆的軟腐與產PCWDEs微生物的種類和數量有關。
3 結論
不同品種豇豆在發酵過程中的pH、微生物群落及質構品質變化均有差異。在24 d的發酵過程中,豇豆品種A發酵前期乳酸菌生長和pH下降最迅速,發酵后期微生物群落和鹽鹵pH穩定,且色澤新鮮、鹽鹵清亮,逐漸形成較濃的泡菜香氣,表現出較好的質構品質。豇豆品種B、品種C和品種D發酵前期乳酸菌生長以及pH下降速度較品種A慢,發酵后期,pH開始回升,總菌和真菌數量持續升高;品種B相比于品種A、品種C、品種D的硬度、彈性、咀嚼力降低得最快且最低,且在發酵第12 d時表現出顏色暗沉、鹽鹵表面有較厚膜醭出現等感官特征,其所表現出的質構品質也較差。
將不同品種發酵豇豆中產PCWDEs微生物分離鑒定后發現,品種B產PCWDEs微生物的種類最豐富且數量最多。發酵過程中,四種不同品種的豇豆中均發現產蛋白酶的植物乳桿菌和產淀粉酶的異常威克漢姆酵母產PCWDEs;此外在品種A、品種B和品種C中均檢測到腸桿菌屬產PCWDEs,如E.cloacae、E.aerogenes、E.faecium等;僅在品種D發酵豇豆中發現R.ornithinolytica產PCWDEs。結果表明發酵后期豇豆的軟腐與產PCWDEs微生物的種類和數量有關。

