解淀粉芽孢桿菌的強啟動子的克隆與鑒定
劉曉川,蔡旭新,陳華強
(廣東肇慶星湖生物科技股份有限公司,廣東 肇慶,526040)
啟動子是基因表達的重要作用元件,不僅在遺傳代謝調控作為關鍵調控因子起作用,在異源基因高效表達中也有重要的地位[1-2]。芽孢桿菌表達系統是原核表達系統中的一種重要表達系統,具有外源蛋白分泌能力強、不易形成包涵體、分泌的外源蛋白易分離純化、無致病性等特點,很多外源蛋白都在芽孢表達系統中成功表達[2-3]。挖掘性能優良的啟動子對于芽孢桿菌表達系統的作用毋庸置疑。
解淀粉芽孢桿菌是一種重要工業微生物,是多種工業酶(α-淀粉酶、蛋白酶、β-葡聚糖酶)的生產宿主[4]。以其為出發菌株挖掘強啟動子不僅有助于為芽孢桿菌表達系統提供有效的調控元件,也有助于加深對該菌株的了解。
本文以β-半乳糖苷酶基因(bgaB)作為報告基因的啟動子探針載體篩選解淀粉芽孢桿菌中的強啟動子,捕抓到一個強度較高的串聯啟動子,并且該啟動子成功運用于木聚糖酶基因的表達。
1 材料與方法
1.1 菌株和質粒
啟動子篩選出發菌株解淀粉芽孢桿菌XH7(BacillusamyloliquefaciensXH7)為本公司保存;大腸桿菌(Escherichiacoli) DH5α購于大連Takara公司;枯草芽孢桿菌WB800 (BacillussubtilisWB800)、啟動子探針質粒pBE-bgaB、表達質粒pBEP43-bgaB、pBEP43-xyn由華南理工大學生物科學與工程學院保存。表達質粒pBEP28-bgaB,pBEP28-xyn為本實驗構建。
1.2 試劑
DNA聚合酶、限制性內切酶和T4 DNA Ligase均購于Thermo公司;質粒提取試劑盒、細菌基因組提取試劑盒購于OMEGA公司;X-gal (5-溴-4-氯-3-吲哚-β-D-半乳糖苷)購于大連Takara公司;鄰硝基苯β-D-半乳吡喃糖苷(oNPG)購于Sigma公司。
1.3 培養基
大腸桿菌、解淀粉芽孢桿菌、枯草芽孢桿菌的培養均采用LB培養基,37 ℃ 200 r/min,必要時加入適當濃度的抗生素。大腸桿菌培養加入質量濃度100 ng/mL氨芐青霉素(Amp),枯草芽孢桿菌培養加入質量濃度25 ng/mL卡那霉素(Kan)。啟動子篩選平板加入終濃度0.2 mmol/L X-gal。
1.4 表達質粒的構建
以pBEP28-bgaB質粒為模板,為引物P28-F/R(表1)擴增P28片段,擴增片段5’和3’端分別帶有EcoRⅠ和SalⅠ 2個限制性酶切位點,片段純化、雙酶切后連接于相同酶切位點酶切載體質粒pBEP43-xyn,連接產物轉化E.coliDH5α,測序驗證得到構建正確的質粒pBEP28-xyn。
1.5 枯草芽孢桿菌的轉化
質粒轉入枯草芽孢桿菌WB800參考電轉化方法[5]。
1.6 β-半乳糖苷酶酶活測定
將重組菌株接種于LB培養基中,37 ℃、200 r/min培養16 h,離心收集細胞后超聲破碎細胞,測定β-半乳糖苷酶的酶活[2]。每分鐘分解ONPG釋放1 μmol ONP和1 μmol半乳糖所需的酶量為1個酶活單位。
1.7 SDS-PAGE分析
質量濃度為50 g/L濃縮膠和120 g/L分離膠進行SDS-PAGE電泳,考馬斯亮藍染色。
1.8 測序和序列分析
DNA引物合成與測序送交英濰捷基測序公司完成。序列的分析比對通過NCBI在線Web blast完成(https://blast.ncbi.nlm.nih.gov/Blast.cgi),通過BPROM(http://linux1.softberry.com)預測啟動子的啟動子區的基本結構,DBTBS (http://dbtbs.hgc.jp/)分析啟動子的σ因子類型。
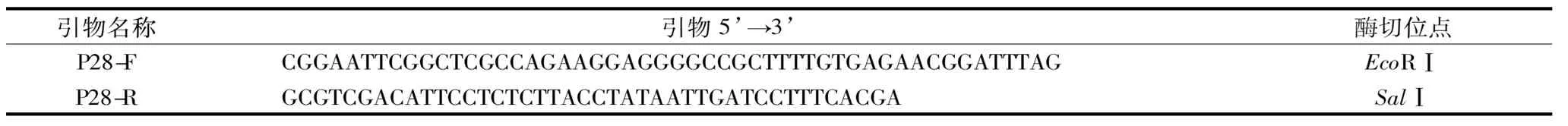
表1 引物及核苷酸序列
2 結果與分析
2.1 啟動子的克隆
啟動子探針質粒pBE-bgaB(圖1-a)是以β-半乳糖苷酶為報告基因的大腸桿菌、枯草芽孢桿菌穿梭質粒,設計帶SD序列的β-半乳糖苷酶(bgaB)基因起始密碼子之前無啟動子序列。MboI不完全酶切解淀粉芽孢桿菌XH7基因組,回收100~500 bp大小范圍的片段如圖1-b所示,純化回收的酶切片段。探針質粒pBE-bgaB用BclI單酶切開與回收的基因組片段連接,連接產物轉化大腸桿菌DH5α,轉化后的菌涂布于添加了X-gal的啟動子篩選平板上,挑取篩選平板上的藍色菌落,并測定其β-Gal酶活。從64株陽性重組子篩選得到1株β-Gal酶活最高的菌株P28,對其進行強度驗證和序列分析。

M-DL2000 DNA Marker;1,2-解淀粉芽孢桿菌XH7基因組
圖1 啟動子探針質粒pBE-bgaB圖譜(a)和基因組DNA酶切電泳(b)
Fig.1 A map of the promoter trap plasmid pBE-bgaB (a) and total DNA partial digested (b)
2.2 篩選的啟動子強度
克隆子中篩選的β-Gal酶活最高的重組菌株P28,考察其在大腸桿菌和枯草芽孢桿菌的β-Gal酶活,如圖2-a所示,P28在大腸桿菌中的β-Gal酶活為2350 Miller U/mL,在枯草芽孢桿菌中的酶活為3340 Miller U/mL,在枯草芽孢桿菌中的酶活強度與來源于枯草芽孢桿菌的組成型強啟動子P43[2]的強度接近,該結果與SDS-PAGE檢測的結果一致(圖2-b)。結果顯示在70 kDa處有清晰的條帶,與目標蛋白分子量大小一致,表明在P28和P43啟動子調控下的重組質粒bgaB報告基因成功表達。
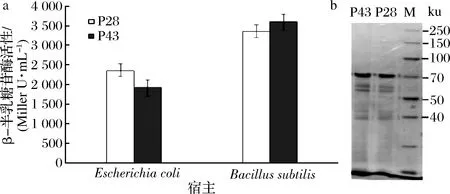
M-蛋白Marker;P28-枯草芽孢桿菌WB800(pBEP28-bgaB)在24 h的蛋白樣品;P43-枯草芽孢桿菌WB800(pBEP43-bgaB)在24 h的蛋白樣品。
圖2 啟動子的β-Gal酶活測定(a)和SDS-PAGE驗證(b)
Fig.2 β-Gal activities of clones in B.amyloliquefaciens(a) and SDS-PAGE analysis(b)
2.3 啟動子的序列分析
對啟動子P28進行測序,并與解淀粉芽孢桿菌XH7基因組序列進行比對,該片段長993 bp,有4個片段,從5’—3’的順序是yodH-ctpA部分編碼區片段(303 bp,yodH編碼S-腺苷甲硫氨酸依賴性甲基轉移酶,ctpA編碼羧基末端加工蛋白酶),gabT部分編碼區片段(161 bp,編碼4-氨基丁酸轉氨酶),dhaS部分編碼區片段(180 bp,編碼醛脫氫酶),fbaA-tal部分編碼區片段(349 bp,fbaA編碼果糖二磷酸醛縮酶,tal編碼轉醛酶)。如圖3-a所示,第2個片段和第3個片段落在gabT和dhaS基因編碼框內,具有啟動子活性的可能性較小,而第1個片段和第4個片段均有起始密碼子前端序列,因此推測P28啟動子是串聯型的啟動子,由啟動子PctpA和啟動子Ptal串聯。通過softberry啟動子預測P28兩個串聯啟動子的-35區和-10區,如圖3-b所示。將上述的啟動子片段一(yodH-ctpA部分編碼區片段,303 bp)和啟動子片段四(fbaA-tol部分編碼區片段,349 bp)提交DBTBS數據庫分析得到,PctpA啟動子是由σK因子識別調控的。σK因子是轉錄孢子形成Ⅳ期母細胞的基因編碼[1,6]。
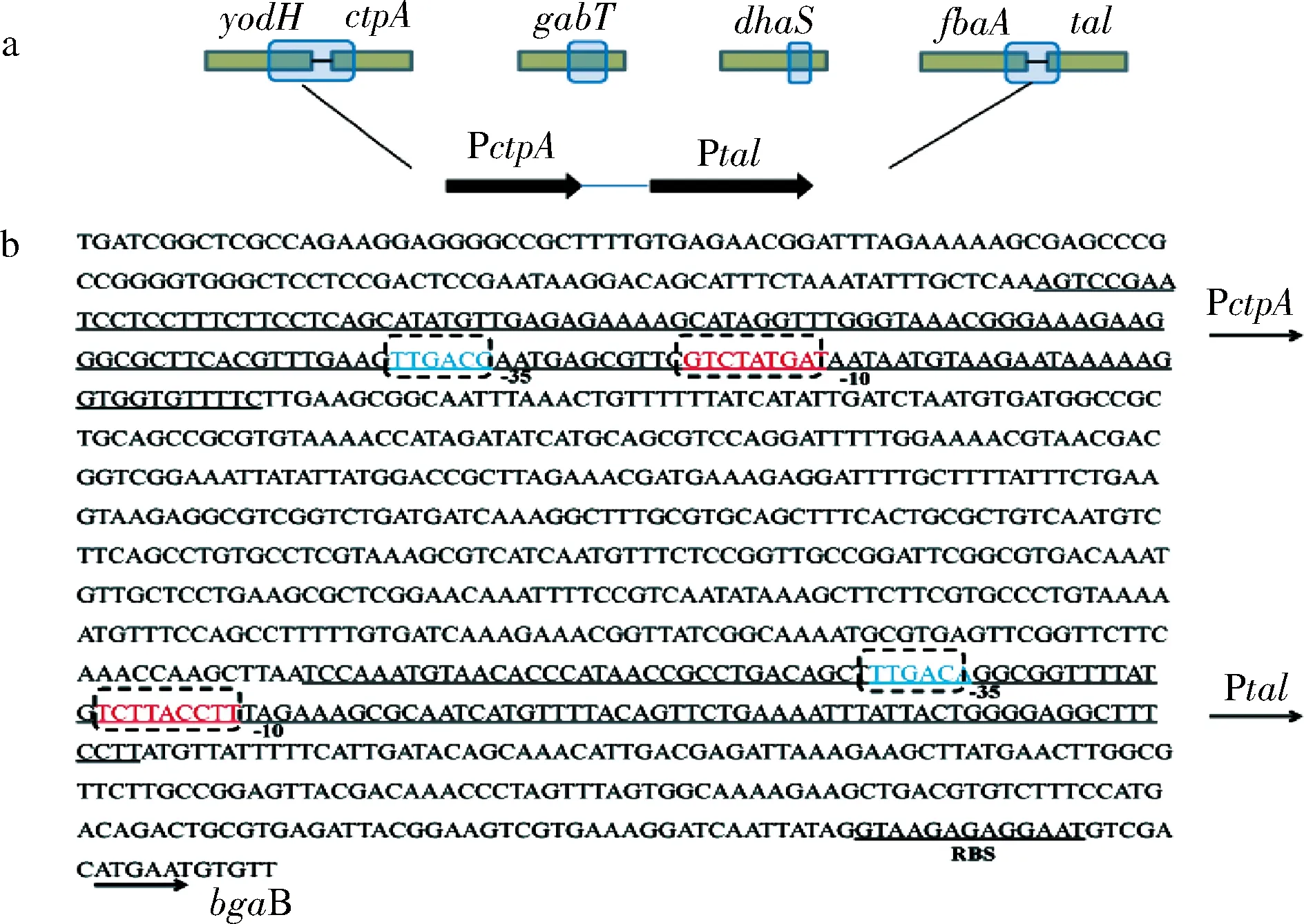
a-方框表示的是P28啟動子4個組成片段及其所在基因位置;b-虛線框內表示的是啟動子-35區、-10區和RBS位點
圖3 啟動子P28結構示意圖(a)與序列分析(b)
Fig.3 Schematic diagram (a) and sequence (b) of promoter P28
2.4 篩選的啟動子應用
將篩選的啟動子亞克隆表達木聚糖酶基因(xyn),圖4結果顯示在40 kDa處有清晰的條帶,與目標蛋白分子量大小一致,說明重組質粒在啟動子P28的啟動下成功表達xyn基因。
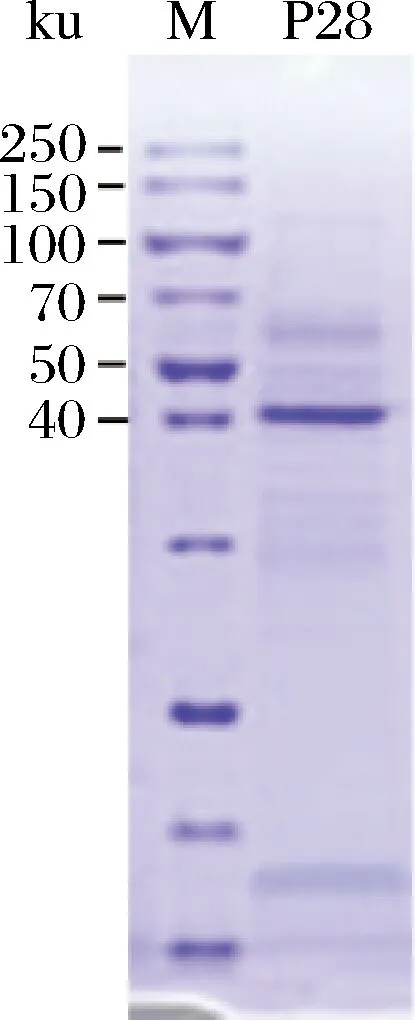
M-蛋白Marker;P28-枯草芽孢桿菌WB800(pBEP28-xyn)在24 h的蛋白樣品
圖4 pBEP28-xyn在枯草WB800中的SDS-PAGE分析
Fig.4 SDS-PAGE analysis of pBEP28-xyn in B.subtilis
3 討論
用啟動子探針載體捕抓啟動子是一種被廣泛使用的高效分離鑒定原核啟動子的方法,其方法不僅簡單有效,還可以雜合出新的啟動子[2,7-8]。
芽孢桿菌的啟動子類型較多(豐富的σ因子),其表達調控機理比較復雜,因此需要豐富的啟動子庫來表達各種外源基因[6,9]。啟動子庫里面不僅需要各種表達強度的啟動子,也需要各種芽孢桿菌屬來源的啟動子,因此擴大啟動子搜索的出發菌株也是行之有效的方法[10-11]。
本文以解淀粉芽孢桿菌為宿主,為芽孢桿菌表達系統的研究貢獻了可以利用的啟動子,但需要進一步優化P28啟動子的強度,如刪去啟動子的多余序列,優化2個啟動子串聯的距離等。

