D001型陽離子交換樹脂吸附Cr(Ⅲ)的平衡特性及動力學
張學峰,談定生,2,謝昀映,李增輝,丁偉中,2
(1.上海大學 材料科學與工程學院,上海 200444;2.上海大學 省部共建高品質特殊鋼冶金與制備國家重點實驗室,上海 200444)
不銹鋼酸洗、制革和電鍍等行業產生的廢水中常含有大量Cr(Ⅲ)。Cr(Ⅲ)的毒性比Cr(Ⅵ)的毒性小很多,約為1/300[1],且微量Cr(Ⅲ)對包括人類在內的哺乳動物,能起到調節身體血糖水平和控制代謝等有益作用[2],但人體內過量Cr(Ⅲ)的存在會破壞紅血球、降低人體免疫力[3-4];廢水中的Cr(Ⅲ)在一定條件下又有可能被氧化為毒性很大的Cr(Ⅵ)[5-6]:因此國家對含鉻廢水的排放有嚴格限制,允許排放的廢水中總鉻質量濃度不超過1.5 mg/L。
降低廢水中Cr(Ⅲ)濃度有多種方法。化學沉淀法目前應用較廣,但該法產生的含鉻污泥仍屬于危廢固體,需要進行二次處理[7]。液膜萃取、物理吸附和生物吸附、電化學處理、離子交換等方法均能不同程度地去除Cr(Ⅲ)[8-12],其中離子交換法因具有操作簡便、樹脂可再生循環利用、鉻離子可富集回收的特點而得到廣泛重視[13-15]。
試驗選用D001型陽離子交換樹脂,通過靜態吸附試驗研究樹脂對Cr(Ⅲ)的吸附效果,考察Cr(Ⅲ)在樹脂上的吸附平衡和動力學行為,確定該類型樹脂在含Cr(Ⅲ)廢水治理中的作用。
1 試驗部分
1.1 試劑與儀器
主要試劑:D001樹脂(上海遜爾化工科技有限公司);硝酸鉻、氫氧化鈉、鹽酸和1,5-二苯基碳酰二肼等,均為分析純(國藥集團化學試劑有限公司)。
主要儀器:pHS-3C型pH計(上海精密科學儀器有限公司),722型可見分光光度計(上海精密科學儀器有限公司),超級數顯恒溫水浴(上海浦東榮豐科學儀器有限公司),循環水式多用真空泵(上海豫康科教儀器設備有限公司)。
1.2 分析方法
采用高錳酸鉀氧化-二苯碳酰二肼分光光度法測定Cr(Ⅲ)質量濃度,即在酸性介質中,用高錳酸鉀將三價鉻氧化成六價鉻,六價鉻與二苯碳酰二肼反應生成紫紅色化合物,在波長540 nm處以分光光度法測定[16]。
1.3 試驗方法
1.3.1樹脂預處理
離子交換樹脂用去離子水浸泡,待充分溶脹后,用8倍樹脂體積的鹽酸(1 mol/L)、去離子水、氫氧化鈉(1 mol/L)、去離子水、鹽酸(1 mol/L)依次淋洗轉化為H型,之后再用去離子水洗至中性,抽濾后備用。
1.3.2靜態吸附試驗
準確稱取(1.00±0.01) g濕樹脂于250 mL燒瓶中,加入由硝酸鉻(Cr(NO3)3·9H2O)配制的Cr(Ⅲ)質量濃度一定的溶液200 mL,在一定溫度、300 r/min條件下充分混合,定時分析吸附后溶液中Cr(Ⅲ)質量濃度,計算Cr(Ⅲ)在樹脂上的吸附量(q)和吸附去除率(r)。
(1)
(2)
式中:q—樹脂對Cr(Ⅲ)的吸附量,mg/g;V—溶液體積,L;m—樹脂質量,g;ρ0—吸附前溶液中Cr(Ⅲ)質量濃度,mg/L;ρ—吸附后溶液中Cr(Ⅲ)質量濃度,mg/L。
2 試驗結果與討論
2.1 吸附時間對樹脂吸附Cr(Ⅲ)的影響
在溶液中Cr(Ⅲ)質量濃度1 027.4 mg/L、25 ℃、溶液pH=1.0條件下,吸附時間對樹脂吸附Cr(Ⅲ)的影響試驗結果如圖1所示。

圖1 吸附時間對樹脂吸附Cr(Ⅲ)的影響
由圖1看出:樹脂對Cr(Ⅲ)的吸附量隨吸附時間延長而提高;60 min內,Cr(Ⅲ)吸附量提高較快,而后提高較慢;120 min后吸附趨于平衡,平衡吸附量為39.14 mg/g。
2.2 吸附平衡等溫線
吸附等溫線是離子交換達到平衡時,離子在樹脂相濃度和溶液相濃度相互關系的具體描述。在25 ℃、溶液pH=1.0、Cr(Ⅲ)初始質量濃度57.53~430.7 mg/L條件下,吸附等溫線如圖2所示。
②河道堤防:在滿足河道防洪要求的條件下,改變堤頂同高、邊坡均同的河堤設計方式。在滿足水利規范要求的堤身寬度、高度、邊坡范圍內,充分利用天然堤防、自然地形等條件,形成微地形堤防,亦可將防洪堤暗藏在綿延起伏的高爾夫地形中,滿足景觀要求。

圖2 樹脂吸附Cr(Ⅲ)的等溫線及吸附模型擬合曲線
由圖2看出,樹脂對Cr(Ⅲ)的平衡吸附量隨溶液中Cr(Ⅲ)質量濃度增大而提高,直至Cr(Ⅲ)在樹脂上達到吸附飽和。
為描述Cr(Ⅲ)在樹脂相和溶液相之間的平衡關系,分別采用Langmuir、Freundlich和Redlich-Peterson吸附等溫模型對圖2數據進行擬合,相應方程為:
Langmuir模型,
(3)
Freundlich模型,
(4)
Redlich-Peterson模型,
(5)
式中:qe—樹脂對Cr(Ⅲ)的平衡吸附量,mg/g;ρe—吸附平衡時溶液中Cr(Ⅲ)質量濃度,mg/L;qm—樹脂對Cr(Ⅲ)的飽和吸附量,mg/g;kL—Langmuir平衡常數,L/mg;kF—Freundlich常數,mg(1-1/n)·g-1·L1/n;n—Freundlich吸附特征常數,量綱一;kR—Redlich-Peterson平衡常數,L/g;αR—Redlich-Peterson常數,(L/mg)β;β—Redlich-Peterson指數,量綱一。
3種模型的擬合曲線如圖2所示,相應參數及相關系數(R2)見表1。可以看出,試驗條件下,Redlich-Peterson模型與試驗數據擬合度最好(R2=0.991 8),Freundlich模型擬合度次之(R2=0.979 1),Langmuir模型擬合度最差(R2= 0.880 7)。

表1 D001樹脂吸附Cr(Ⅲ)的模型參數
Freundlich方程是描述離子在樹脂上吸附平衡的經驗方程,n為衡量樹脂和離子親和力的參數,n>1表明吸附容易進行[19]。擬合結果得到n=5.491,表明樹脂吸附Cr(Ⅲ)為優惠吸附,與Langmuir模型擬合得出的結論一致。但樹脂吸附Cr(Ⅲ)是非均勻吸附,所以采用適合非均勻吸附的Freundlich模型擬合效果優于Langmuir模型。
由圖2看出:Redlich-Peterson吸附等溫線能對試驗數據進行很好的擬合。該模型是3參數經驗方程,它結合了Langmuir和Freundlich方程的特點,同時又克服了前者受高濃度和后者受低濃度適用條件的限制[20-21],因而能更好地描述試驗條件下樹脂吸附Cr(Ⅲ)的平衡關系。
2.3 吸附熱力學特性
熱力學參數可以判斷離子交換自發進行的可能性及了解溫度對交換反應的影響。熱力學參數計算公式如下:
(6)
(7)
ΔG=ΔH-TΔS。
(8)
式中:ΔH、ΔG、ΔS分別為離子交換吸附過程的焓變(kJ/mol)、吉布斯自由能變(kJ/mol)和熵變(J/(mol·K));kD為吸附平衡時Cr(Ⅲ)在樹脂相和溶液相的分配系數,L/g;T為熱力學溫度,K;R為氣體常數,8.314 J/(mol·K)。
由不同溫度下的試驗數據繪制lnkD與1/T之間的關系曲線,如圖3所示,并進行直線擬合。根據式(6),ΔH、ΔS分別由直線斜率和截距求得,不同溫度下的ΔG按式(8)計算,所得結果見表2。
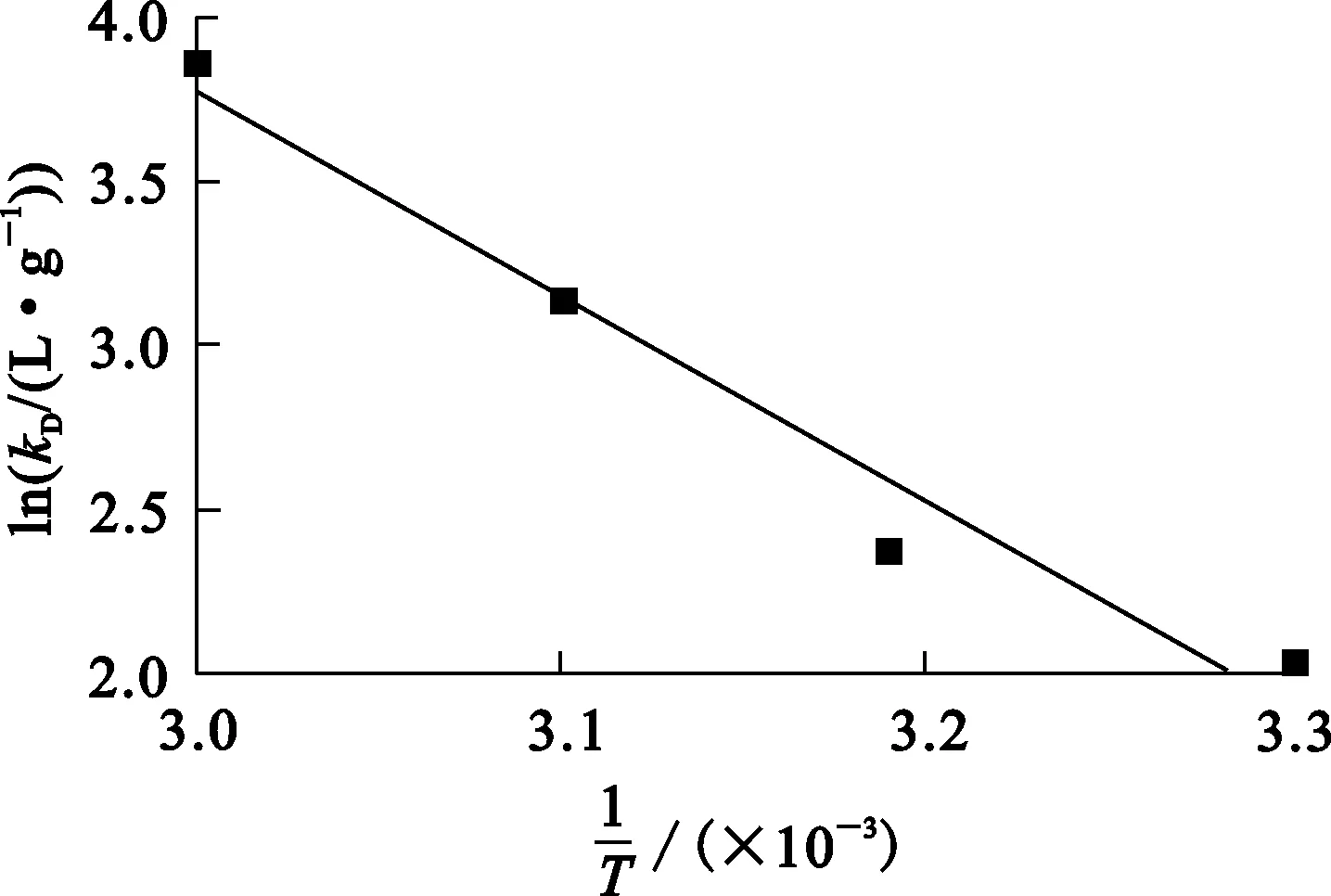
圖3 樹脂吸附Cr(Ⅲ)的lnkD與1/T之間的關系曲線

T/KΔG/(kJ·mol-1)ΔH/(kJ·mol-1)ΔS/(J·mol-1·K-1)303-4.77313-6.65323-8.53333-10.4152.21188.06
由表2看出:試驗條件下,ΔG均為負值,表明Cr(Ⅲ)的交換吸附可自發進行;而且隨溫度升高,ΔG絕對值增大,表明較高溫度加大了Cr(Ⅲ)吸附過程的自發程度;ΔH>0,表明樹脂吸附Cr(Ⅲ)過程中吸熱,升高溫度有利于吸附進行;ΔS>0,是因為選擇性較高的Cr(Ⅲ)交換出選擇性較低的H+后,一方面樹脂收縮,釋放出部分水化水到溶液相,使水的熵值增大,另一方面1個三價離子交換釋放出3個H+到溶液相,H+自由度增大[22]。盡管Cr(Ⅲ)從液相到樹脂固相后自由度有所降低,但整個體系的自由度還是增加的。
2.4 吸附動力學
2.4.1離子交換過程的反應級數
描述離子交換的吸附動力學模型有多種,其中準一級和準二級動力學模型應用更廣泛[21]。2個模型的線性化方程分別為:
ln(qe-qt)=lnqe-k1t;
(9)
(10)
式中:qt為吸附時間t時的吸附量,mg/g;k1為準一級速率常數,min-1;k2為準二級速率常數,g/(mg·min)。
分別將不同溫度下的試驗數據按式(9)(10)進行準一級和準二級動力學模型線性擬合,結果如圖4、5所示。D001樹脂吸附Cr(Ⅲ)的動力學參數見表3,直線的斜率和截距分別為速率常數和相關系數(R2)。
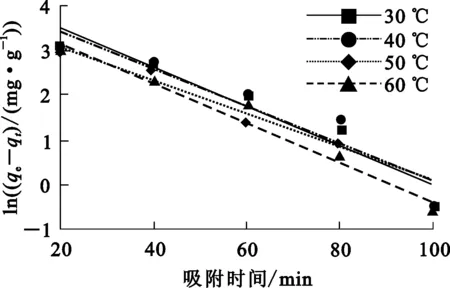
圖4 樹脂吸附Cr(Ⅲ)的準一級動力學擬合曲線

圖5 樹脂吸附Cr(Ⅲ)的準二級動力學擬合曲線
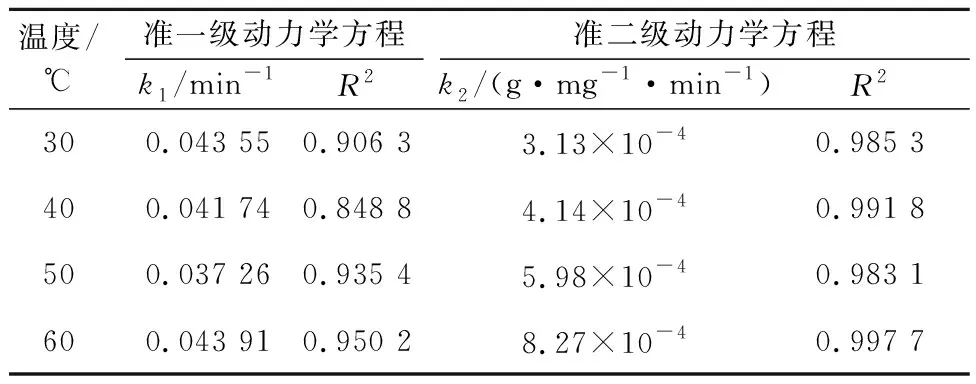
溫度/ ℃準一級動力學方程k1/min-1R2準二級動力學方程k2/(g·mg-1·min-1)R2300.043 550.906 33.13×10-40.985 3400.041 740.848 84.14×10-40.991 8500.037 260.935 45.98×10-40.983 1600.043 910.950 28.27×10-40.997 7
不同溫度下,準一級動力學模型的R2均小于準二級動力學模型的R2,表明樹脂吸附Cr(Ⅲ)的動力學特征能更好地用準二級反應動力學模型描述。準二級動力學模型基于Cr(Ⅲ)吸附在樹脂上包含有化學反應過程[23],即Cr(Ⅲ)和H+發生了離子交換反應。
根據阿倫尼烏斯公式,
(11)
以lnk2對1/T作圖(圖6),線性擬合相關系數R2=0.988 3,直線斜率為-3 302,計算求得樹脂吸附Cr(Ⅲ)的反應活化能為27.45 kJ/mol。

圖6 樹脂吸附Cr(Ⅲ)過程中lnk2與1/T之間的線性關系
2.4.2交換過程的控制步驟
離子交換過程一般經歷4個步驟:1)溶液中的金屬離子擴散到樹脂表面的液體薄膜邊界層(本體擴散);2)金屬離子擴散通過液體薄膜到達樹脂表面(外擴散);3)樹脂表面的金屬離子向樹脂內部擴散(顆粒內擴散);4)進入樹脂內部的金屬離子與樹脂上的可移動離子進行化學交換反應。
在靜態離子交換吸附過程中,攪拌強度足夠大時,可以忽略本體擴散的影響。離子交換反應一般進行得較快,因此,外擴散或顆粒內擴散通常是交換過程的速率控制步驟[24]。
交換過程的速率控制步驟可以用Weber和Morris經驗公式[25]來判斷。
(12)
式中:kid為顆粒擴散速率常數,mg/(g·min1/2);I為反映薄膜邊界層影響程度的參數。qt和t1/2之間呈線性關系,則離子在顆粒內擴散是離子交換過程的速率控制步驟,否則為混合控制步驟。
將試驗數據按式(12)作圖并進行線性擬合,結果如圖7所示。
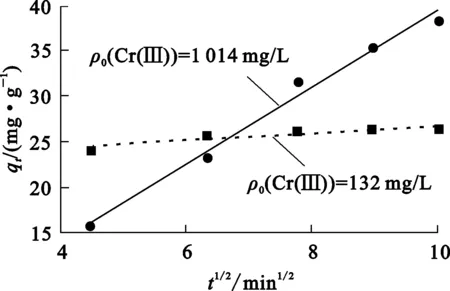
圖7 顆粒擴散方程擬合曲線
由圖7看出:不同初始Cr(Ⅲ)質量濃度下,qt與t1/2基本都呈直線關系,表明顆粒擴散是樹脂吸附Cr(Ⅲ)的速率控制步驟;但低初始Cr(Ⅲ)質量濃度下的I(截距)大于高初始Cr(Ⅲ)質量濃度下的I,說明初始Cr(Ⅲ)質量濃度較低時,薄膜邊界層影響程度較大[24],因為較低的初始Cr(Ⅲ)質量濃度在離子通過薄膜邊界層擴散時推動力較小。
3 結論
用D001陽離子交換樹脂可從廢水中吸附Cr(Ⅲ),吸附過程更符合Redlich-Peterson模型。D001樹脂吸附Cr(Ⅲ)的過程可自發進行,同時吸熱和增熵。動力學研究表明,Cr(Ⅲ)在樹脂上的吸附符合準二級動力學方程,吸附反應的活化能為27.45 kJ/mol,吸附過程的速率控制步驟為顆粒擴散。

