甘蔗渣基吸附材料對Cr(Ⅵ)的吸附特性研究
劉雪梅,馬 闖,吳 凡,趙 蓓
(華東交通大學 土木建筑學院,江西 南昌 330013)
鉻是一種典型的重金屬元素,主要通過鉻鹽生產、電鍍等人類活動進入環境中[1-2],水體中Cr(Ⅵ)的污染治理十分重要[1-3]。農林廢棄物或改性后農林廢棄物可吸附廢水中的Cr(Ⅵ)[4-6],如改性后的柚子皮、農作物和殼聚糖等復合材料[7-9]都對重金屬離子有較好的吸附效果。
試驗研究了普通甘蔗渣(OB)、真空條件下甘蔗渣炭(VB)、氮氣環境中甘蔗渣基炭(NB)對Cr(Ⅵ)的吸附行為。以甘蔗渣為原料,在真空及氮氣氛中經600 ℃炭化后分別制得甘蔗渣炭(VB)和氮炭化甘蔗渣(NB),以期為農林廢棄物或副產物在廢水重金屬離子去除中的應用提供新型材料。
1 試驗部分
1.1 材料、試劑及儀器
材料:甘蔗,取自廣西某地。
試劑:重鉻酸鉀、硫酸、丙酮、二苯基炭酰二肼、氫氧化鈉、磷酸及鹽酸,均為分析純。
儀器:L5S型紫外可見分光光度計,AL204型電子分析天平,pHS-3E型pH計,SHZ-82A數顯測速恒溫搖床,50 mL比色管,1 cm比色皿,容量瓶,移液管等。
1.2 甘蔗渣炭的制備
甘蔗渣炭(VB)的制備:甘蔗經破碎機粉碎,過100目篩,以去離子水反復清洗,80 ℃下干燥備用。將處理過的甘蔗渣在真空環境中進行炭化,以5 ℃/min升溫速度升溫到600 ℃,在600 ℃下炭化1 h,之后冷卻至室溫取出,放入干燥皿中備用。
氮炭化甘蔗渣(NB)的制備:甘蔗經破碎機粉碎,過100目篩,以去離子水反復清洗,80 ℃干燥后置于坩堝中,放入箱式氣氛爐中,通入氮氣,以5 ℃/min升溫速度從室溫升溫至600 ℃,在600 ℃下烘干1 h,冷卻至室溫后取出,放入干燥皿中備用。
1.3 模擬廢水的配制
稱取120 ℃下干燥2 h的重鉻酸鉀0.282 9 g,用蒸餾水溶解后移入1 000 mL容量瓶中,用蒸餾水稀釋至刻度,搖勻,配制成Cr(Ⅵ)質量濃度為100 mg/L的模擬廢水。試驗所需其他質量濃度的廢水均由此模擬廢水稀釋配制。
1.4 試驗與計算方法
在25 ℃下,移取不同質量濃度的Cr(Ⅵ)模擬廢水50 mL于250 mL錐形瓶中,以0.1 mol/L HCl溶液及0.1 mol/L NaOH溶液調節模擬廢水pH,加入一定質量OB、VB和NB,以120 r/min速度在恒溫搖床中振蕩一定時間后,靜置片刻,過濾,取上清液測定模擬廢水中Cr(Ⅵ)質量濃度,計算Cr(Ⅵ)吸附率。
采用式(1)(2)分別計算Cr(Ⅵ)吸附去除率(η)和平衡吸附量(qe):
(1)
(2)
式中:ρe為吸附平衡時模擬廢水中的Cr(Ⅵ)質量濃度,mg/L;ρ0為吸附前模擬廢水中Cr(Ⅵ)質量濃度,mg/L;m為甘蔗渣炭質量,g;V為廢水體積,L。 采用式(3)(4)(5)分別對準一級動力學模型、準二級動力學模型和顆粒擴散模型進行擬合:
ln(qe-qt)=lnqe-k1t;
(3)
(4)
qt=kt0.5。
(5)
式中:qe為平衡吸附量,mg/g;t為吸附時間,min;qt為吸附時間t時的吸附量,mg/g;k1為準一級吸附速率常數,min-1;k2為準二級吸附速率常數,g/(mg·min);k為顆粒擴散模型速率常數。
采用式(6)(7)分別對Langmuir和Freundlich等溫方程進行擬合:
(6)
(7)
式中:qe為平衡吸附量,mg/g;qm為吸附劑的最大吸附量,mg/g;b為Langmuir 常數;ρe為平衡質量濃度,mg/L;kF為Freundlich 常數;1/n為吸附指數。
1.5 分析方法
根據《水質六價鉻的測定——二苯炭酰二肼分光光度法》(GB7467—1987)測定模擬廢水中Cr(Ⅵ)質量濃度。
2 試驗結果與討論
2.1 吸附劑的比表面積
3種吸附劑的比表面積見表1。

表1 3種吸附劑的比表面積
由表1看出,3種吸附劑的比表面積、孔隙體積、孔徑大小均不同,比表面積表現為VB>NB>OB,總孔容表現為VB>NB>OB,孔徑表現為OB>NB>VB。在600 ℃溫度下,甘蔗渣組分之間發生反應改變了孔隙結構,使得炭化后的甘蔗渣的比表面積增大、孔容增大、孔徑變小。
2.2 吸附劑的電鏡分析
3種吸附劑的電鏡分析結果如圖1所示。

a—OB;b—VB;c—NB。
由圖1看出:OB為柱狀,主要為大孔結構,表面較為平整密實,只有少量裂縫;VB表面為蜂窩狀結構,形成大量孔隙,孔隙一直貫穿到底部;NB為多層片狀結構,每片上都有大量孔隙出現,且孔隙排列較為整齊。VB、NB比OB孔隙結構更為發達,VB中孔隙結構貫穿程度強于NB。
2.3 吸附劑的紅外光譜分析
3種吸附劑的紅外光譜分析結果如圖2所示。
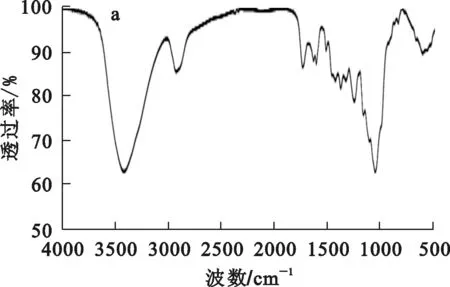
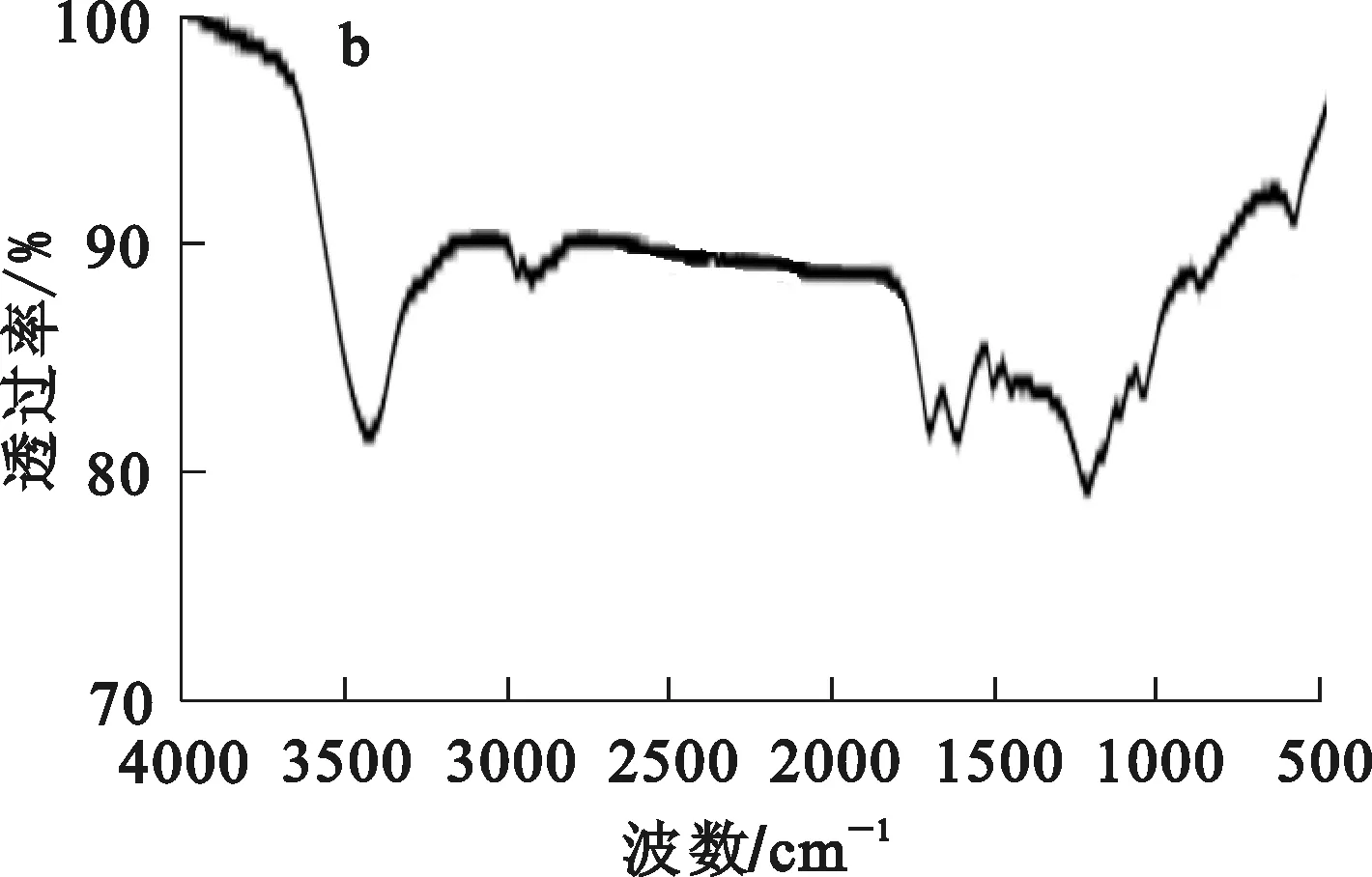

a—OB;b—VB;c—NB。

與OB相比,VB、NB新增的一些含氧官能團可通過氧化還原[4-5]、配合作用[10]大大增加對廢水中Cr(Ⅵ)的吸附能力;新增的含炭官能團可在酸性條件下發生質子化反應,產生大量正電荷,促進與Cr(Ⅵ)的吸附。NB在制備過程中與氮氣反應,生成氨基團,且在含炭及含氧官能團上強于VB,因此,對Cr(Ⅵ)的吸附效果在3種吸附劑中最優。
2.4 初始廢水pH對3種吸附劑吸附去除Cr(Ⅵ)的影響
將3種吸附劑分別投加到50 mL Cr(Ⅵ)質量濃度為50 mg/L的模擬廢水中,調整初始廢水pH,考察廢水初始pH對Cr(Ⅵ)去除率的影響。試驗結果如圖3所示。
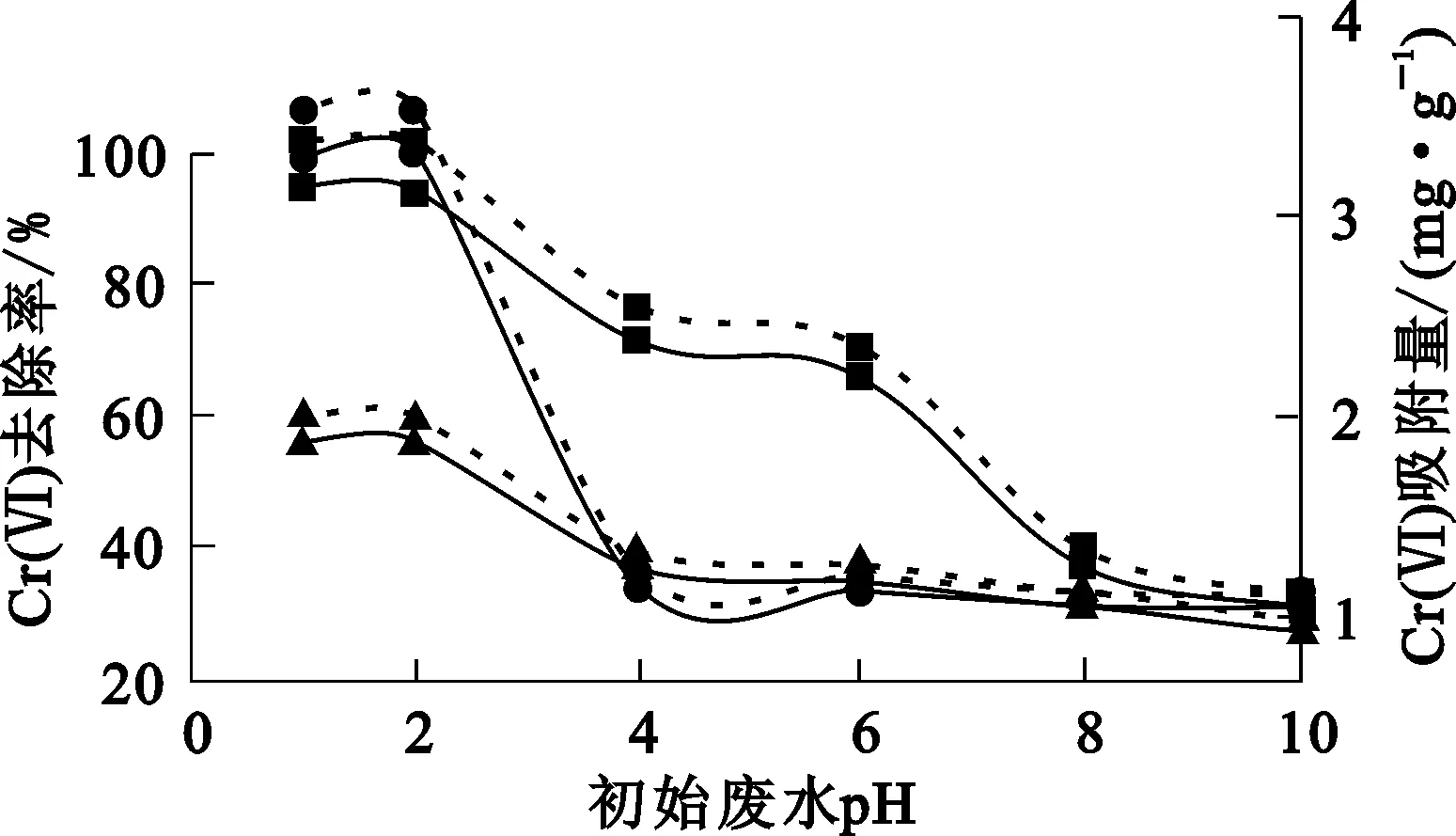
Cr(Ⅵ)去除率:—●—NB;—▲—OB;—■—VB。Cr(Ⅵ)吸附量:┈●┈NB;┈▲┈OB;┈■┈VB。
2.5 吸附劑用量對Cr(Ⅵ)去除率的影響
將3種吸附劑分別投加到50 mL Cr(Ⅵ)質量濃度為50 mg/L的模擬廢水中,考察吸附劑用量對Cr(Ⅵ)的吸附效果。試驗結果如圖4所示。

Cr(Ⅵ)去除率:—●—NB;—▲—OB;—■—VB。Cr(Ⅵ)吸附量:┈●┈NB;┈▲┈OB;┈■┈VB。
由圖4看出:3種吸附劑對Cr(Ⅵ)的吸附容量都隨吸附劑用量增大而降低;NB對Cr(Ⅵ)吸附去除率最高為99.1%,VB對Cr(Ⅵ)吸附去除率最高為94.5%,而OB對Cr(Ⅵ)吸附去除率最高僅為56.1%;繼續投加吸附劑,吸附效果幾乎不變。這是由于吸附劑較多時,吸附劑顆粒本身會發生黏附,碰撞概率加大,或Cr(Ⅵ)與吸附劑表面官能團反應時受到阻力作用(活性位點排斥)[20],因此發生吸附抑制,導致吸附效果下降[21-22]。由于NB與VB的比表面積及總孔容遠大于OB,故在相同投加量時,NB與VB所提供的活性位點遠多于OB,因此NB與VB對Cr(Ⅵ)的吸附去除率更高。總體來說,相同投加量條件下,吸附去除率及吸附容量表現為NB>VB>OB。
2.6 吸附時間對Cr(Ⅵ)去除率的影響
3種吸附劑分別投加到50 mL Cr(Ⅵ)質量濃度為50 mg/L的模擬廢水中,考察吸附時間對Cr(Ⅵ)的吸附效果。試驗結果如圖5所示。
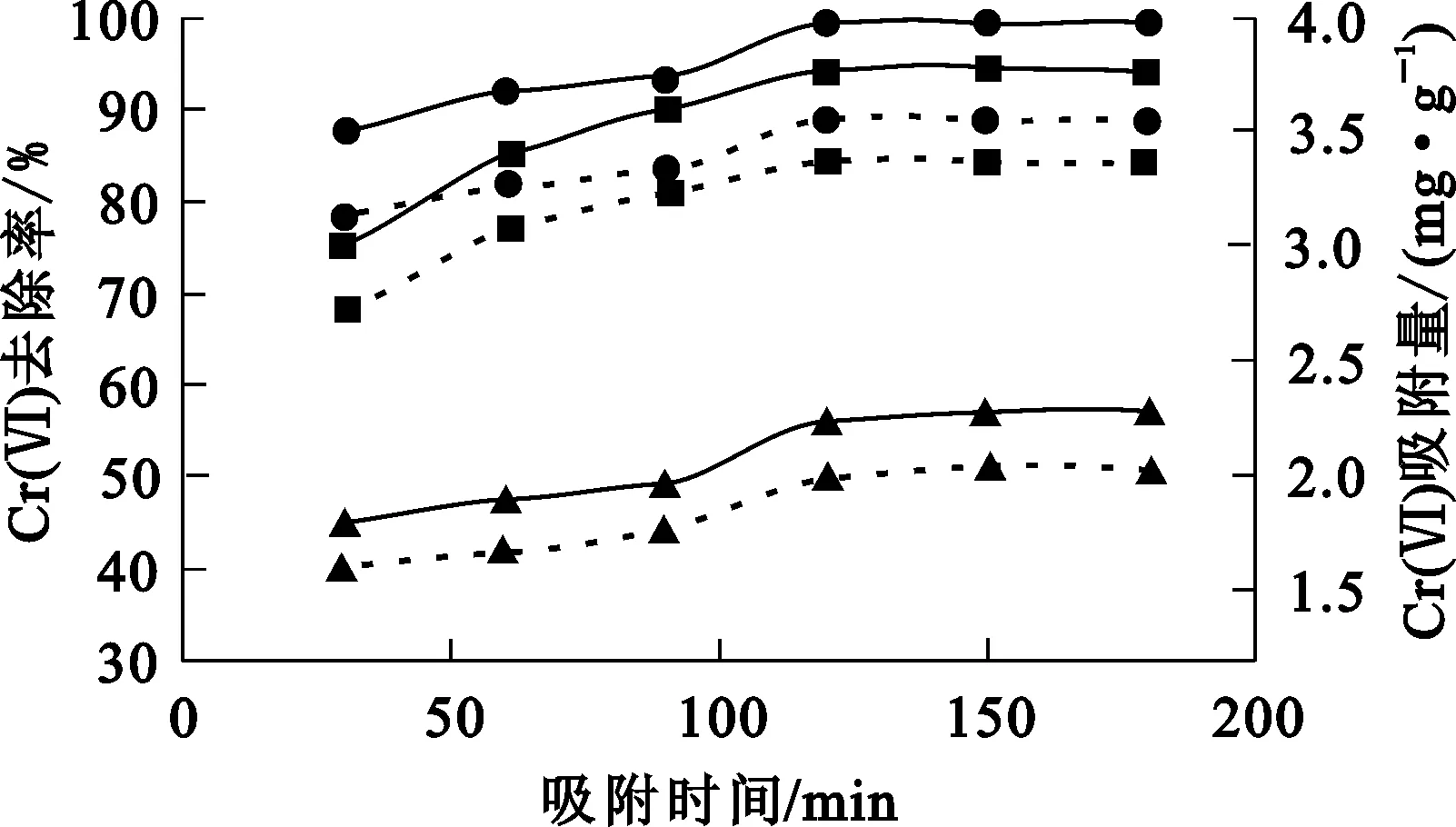
Cr(Ⅵ)去除率:—●—NB;—▲—OB;—■—VB。Cr(Ⅵ)吸附量:┈●┈NB;┈▲┈OB;┈■┈VB。
由圖5看出:隨吸附時間延長,3種吸附劑對Cr(Ⅵ)的吸附去除率都有所提高,且吸附容量與吸附去除率的變化趨勢基本一致;吸附120 min時,VB對Cr(Ⅵ)吸附率達最大,為94.5%,OB和NB對Cr(Ⅵ)吸附率分別為56.1%及99.1%;再繼續吸附,吸附率基本不變。
2.7 模擬廢水Cr(Ⅵ)初始質量濃度對去除率的影響
將3種吸附劑分別投加到50 mL Cr(Ⅵ)質量濃度為50 mg/L模擬廢水中,考察Cr(Ⅵ)初始質量濃度對Cr(Ⅵ)的吸附效果。試驗結果如圖6所示。
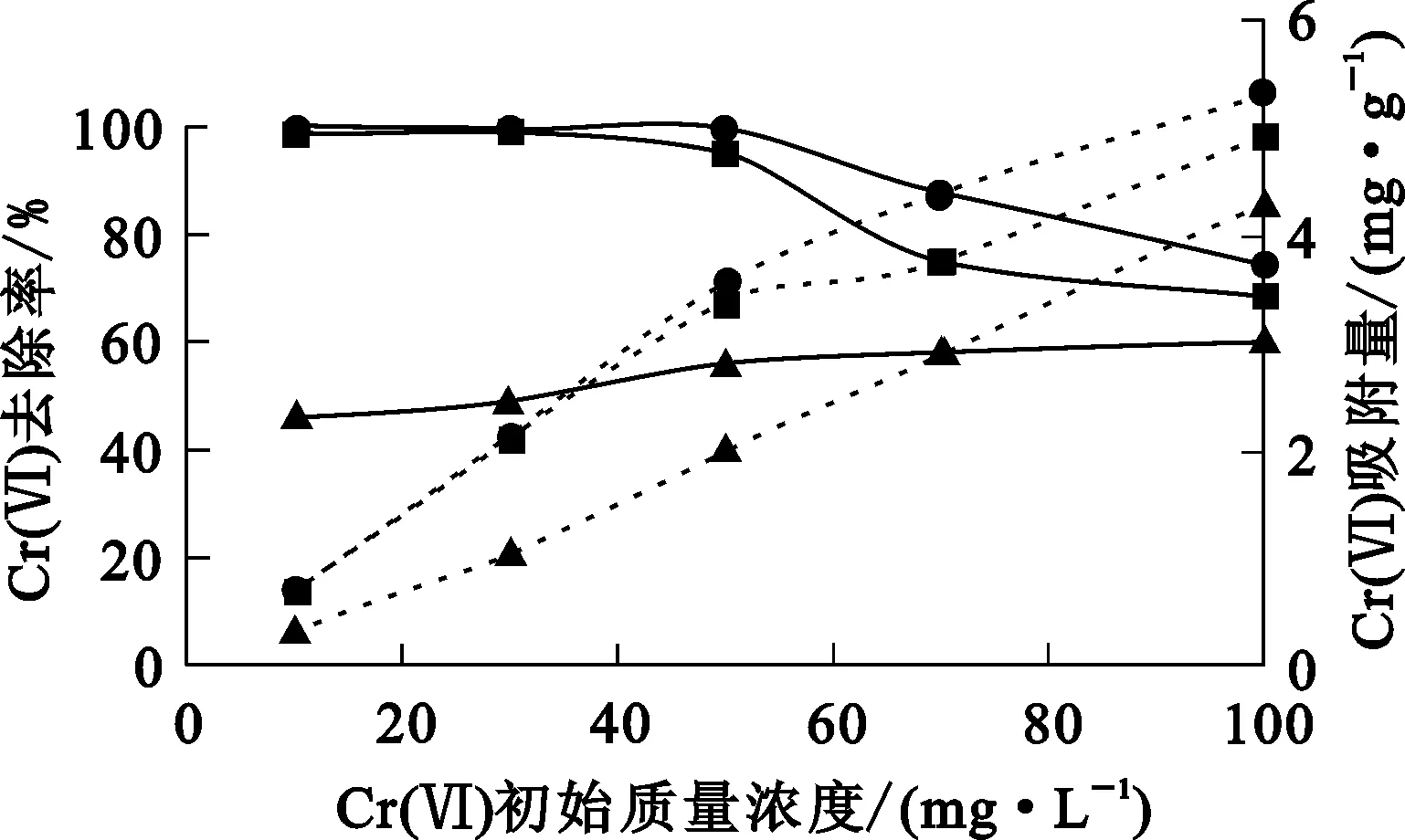
Cr(Ⅵ)去除率:—●—NB;—▲—OB;—■—VB。Cr(Ⅵ)吸附量:┈●┈NB;┈▲┈OB;┈■┈VB。
由圖6看出:3種吸附劑對Cr(Ⅵ)的吸附容量都隨Cr(Ⅵ)初始質量濃度增大而增大;當廢水Cr(Ⅵ)初始質量濃度為10~50 mg/L時,NB和VB對Cr(Ⅵ)吸附去除率變化幅度很小;當廢水Cr(Ⅵ)初始質量濃度在50~100 mg/L時,NB和VB對Cr(Ⅵ)吸附去除率迅速減小,而OB對Cr(Ⅵ)吸附去除率隨Cr(Ⅵ)質量濃度升高而提高,但幅度很小。Cr(Ⅵ)質量濃度較低時,吸附劑提供的活性位點數遠大于Cr(Ⅵ)數,NB及VB對Cr(Ⅵ)的吸附去除率相對較高;而當Cr(Ⅵ)質量濃度超過一定時,吸附劑中的活性位點數少于Cr(Ⅵ)數,進而發生競爭吸附[23]。總體而言,吸附去除率及吸附容量表現為NB>VB>OB。
2.8 吸附等溫線
在pH=2.0、溫度25 ℃、攪拌速度120 r/min、吸附12 h條件下,向錐形瓶中分別加入Cr(Ⅵ)初始質量濃度依次為10、30、50、70、100 mg/L的模擬廢水50 mL,再分別投加0.7 g VB和NB,試驗結果如圖7所示。

圖7 NB和VB對Cr(Ⅵ)的吸附等溫線
由圖7看出,用NB和VB吸附Cr(Ⅵ),吸附量與Cr(Ⅵ)質量濃度之間有一定聯系:2種吸附劑對Cr(Ⅵ)吸附量隨Cr(Ⅵ)平衡質量濃度增大而增大;吸附曲線的斜率都隨Cr(Ⅵ)平衡質量濃度增大而減小,最終斜率都基本為0,即2種吸附劑對Cr(Ⅵ)的吸附速率都在逐漸減小,最終變為0;但Cr(Ⅵ)平衡質量濃度基本相同條件下,NB對Cr(Ⅵ)的吸附量大于VB對Cr(Ⅵ)的吸附量。NB和VB對Cr(Ⅵ)吸附率隨Cr(Ⅵ)平衡質量濃度增大而減小,但吸附效率下降速率遠小于吸附量上升速率[24]。
Langmuir和Freundlich等溫吸附模型擬合結果見表2。
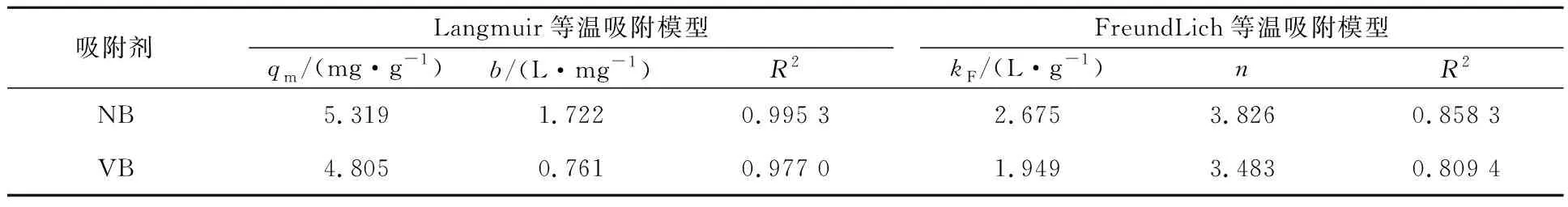
表2 Langmuir和Freundlich等溫吸附模型參數
由表2看出,2種吸附劑對Cr(Ⅵ)的吸附等溫線都與Langmuir等溫吸附模型擬合得相對較好,表明吸附過程以單層吸附為主。吸附過程中,NB和VB的Freundlich等溫吸附方程中的n均大于1,表明它們對Cr(Ⅵ)的吸附均為優勢吸附,吸附過程都較為容易[24]。
2.9 吸附動力學
在pH=2、攪拌轉速120 r/min、溫度25 ℃條件下,向錐形瓶中加入Cr(Ⅵ)初始質量濃度為50 mg/L的模擬廢水50 mL,分別投加14 g/L NB和VB,吸附動力學試驗結果如圖8所示。

圖8 NB和VB對Cr(Ⅵ)的吸附動力學曲線
由圖8看出:NB和VB對Cr(Ⅵ)的吸附量隨吸附時間延長而增大,且NB的吸附量大于VB的吸附量;曲線斜率隨吸附時間延長而變小,表明2種吸附劑對Cr(Ⅵ)的吸附速率減小;NB在吸附30 min時達飽和吸附量的87.5%,120 min后吸附速率基本為0;VB在吸附30 min時達飽和吸附量的75.6%,120 min后吸附速率基本為0。對Cr(Ⅵ)的吸附分為2個階段:前30 min,NB和VB含有大量吸附位點,吸附速率很快;隨吸附進行,吸附位點逐漸被Cr(Ⅵ)占據,受表面性質及傳質阻力的影響,吸附速率逐漸減慢,在120 min后達到飽和。
為更加具體考察NB和VB對Cr(Ⅵ)的吸附動力學,對試驗數據進行3種動力學模型擬合,所得動力學模型參數見表3。

表3 3種吸附動力學模型參數
由表3看出:NB和VB吸附Cr(Ⅵ)動力學過程均符合3種動力學方程,但相較而言更符合擬二級動力學模型(R2>0.99),表明物理吸附和化學吸附共同對2種吸附劑吸附Cr(Ⅵ)做出貢獻。準二級動力學方程指出,吸附過程大致包括液膜擴散、表面吸附和顆粒內擴散3個階段[24]。顆粒內擴散模型中,擬合方程不經過原點,表明吸附過程中顆粒內擴散不是唯一的控制步驟,還包括液膜擴散、表面吸附2個階段的共同作用。
3 結論
甘蔗渣在真空條件下炭化及在氮氣環境中炭化后,結構形態發生較大變化,形成蜂窩狀結構及多層片狀結構,形成大量孔隙,比表面積增大,官能團增多,可用于從廢水中吸附Cr(Ⅵ)。適宜條件下,NB、VB對Cr(Ⅵ)的吸附率分別達99.1%和94.5%,最大吸附量為5.319和4.805 mg/g。VB及NB的吸附等溫線符合Langmuir等溫吸附模型,吸附以單層吸附為主;吸附動力學行為符合準二級動力學模型,2種吸附劑在吸附Cr(Ⅵ)過程中,均有慢速吸附和快速吸附2個過程。

