殼聚糖載銅改性及吸附Cr(Ⅵ)的試驗研究
張 宇,李 倩,任歡杰
(植物抗癌活性物質(zhì)提純及應用湖北省級重點實驗室,湖北第二師范學院,湖北 武漢 430205)
電鍍廠、制革廠、電池廠等排放的工業(yè)污水中含有大量Cr(Ⅵ)。Cr(Ⅵ)是毒性相對較高的重金屬離子,需要去除達標后排放。吸附法處理含鉻廢水成本低,回收容易,二次污染小,用于廢水處理的吸附工藝和新型吸附材料[1-5]已有很多。
殼聚糖的主要官能團為C2—NH2、C3—OH和C6—OH。C2—NH2基團上的氮原子具有孤對電子,能進入金屬離子的空軌道,形成配位鍵,可用于吸附處理含重金屬廢水,但實際應用效果并不佳。近年來,有關殼聚糖的改性研究受到廣泛關注,希望通過改性優(yōu)化其性能,提高其對重金屬離子的吸附效果[6-12]。目前,有關殼聚糖載銅改性并用于吸附鉻離子的研究尚未見有報道,為此試驗研究了以乙酸銅為改性劑,對殼聚糖進行改性,并考察改性后的殼聚糖對鉻的吸附性能,以確定較優(yōu)改性條件及改性機制,為殼聚糖的實際應用提供參考依據(jù)。
1 試驗部分
1.1 試驗材料與儀器
主要材料:殼聚糖、乙酸銅,均為分析純。
主要儀器:722E型分光光度計,SK2-4-12管式電阻爐,BRUKER-TENSOR 27紅外光譜儀。
1.2 試驗方法
1.2.1乙酸銅對殼聚糖的改性
取一定質(zhì)量殼聚糖、乙酸溶液,加入到超純水中,攪拌,使其充分溶解,配制成殼聚糖-乙酸溶液。加入一定量乙酸銅,控制溫度,對殼聚糖進行改性處理,一定時間后停止攪拌,冷卻,于105 ℃烘箱中烘干3 h,得到一系列改性殼聚糖固體粉末樣品,記作CuCTS。
1.2.2改性殼聚糖對鉻的吸附
將一系列改性殼聚糖樣品分別取0.05 g置于圓底燒瓶中,加入Cr(Ⅵ)質(zhì)量濃度為50 mg/L溶液50 mL,放在35 ℃恒溫水浴中加熱,同時攪拌,1 h后取出冷卻,抽濾得濾液。測定濾液中剩余的Cr(Ⅵ)質(zhì)量濃度,計算Cr(Ⅵ)吸附率。
式中:ρ0—吸附前溶液中Cr(Ⅵ)質(zhì)量濃度,mg/L;ρ—吸附后溶液中Cr(Ⅵ)質(zhì)量濃度,mg/L;r—Cr(Ⅵ)吸附率,%。
1.3 分析方法
采用二苯碳酰二肼分光光度法(GB7467—1987)[13]測定溶液中的鉻。
1.3.1殼聚糖的溶解性
稱取一定質(zhì)量改性前后的殼聚糖分別于250 mL錐形瓶中,分別加入水、1 mol/L乙酸溶液和1 mol/L鹽酸溶液,放進30 ℃恒溫水蕩器中,振蕩一定時間后取出產(chǎn)品,靜置,觀察并記錄殼聚糖的溶解情況。
1.3.2紅外光譜表征
取少量改性前后的殼聚糖用瑪瑙研缽研細,加入一定質(zhì)量KBr粉末,m(殼聚糖)∶m(KBr)=1∶100,混合均勻后繼續(xù)研磨,用壓片器壓成透明薄片狀,在400~4 000 cm-1波長下進行測試表征。
2 試驗結(jié)果與討論
2.1 改性溫度對改性殼聚糖吸附鉻的影響
控制殼聚糖-乙酸溶液質(zhì)量濃度20 g/L,乙酸銅質(zhì)量0.5 g,改性時間1 h,改性溫度對殼聚糖吸附鉻的影響試驗結(jié)果如圖1所示。

圖1 改性溫度對改性殼聚糖吸附Cr(Ⅵ)的影響
由圖1看出:隨改性溫度升高,改性殼聚糖對Cr(Ⅵ)吸附率逐漸升高;但溫度達85 ℃時,Cr(Ⅵ)吸附率變化幅度趨于平緩。這可能是因為:一方面,高溫下分子運動加劇,Cr(Ⅵ)擴散到殼聚糖表面的速率加快,使得鉻吸附率提高;另外,溫度升高,分子運動加劇,殼聚糖與乙酸銅配合反應生成的螯合環(huán)遭到破壞,殼聚糖表面引入的羧基基團減少,吸附Cr(Ⅵ)的量也會減少。
2.2 改性時間對殼聚糖吸附鉻的影響
殼聚糖-乙酸溶液質(zhì)量濃度20 g/L,乙酸銅質(zhì)量0.5 g,改性溫度45 ℃,改性時間對改性殼聚糖吸附鉻的影響試驗結(jié)果如圖2所示。可以看出:隨改性時間延長,改性殼聚糖對鉻的吸附率逐漸升高;改性0.5 h,改性殼聚糖對鉻的吸附率趨于穩(wěn)定。這表明改性殼聚糖與Cr(Ⅵ)之間的配合反應速度很快,短時間內(nèi)就能形成穩(wěn)定螯合物。綜合考慮,確定殼聚糖改性時間以0.5 h為宜。
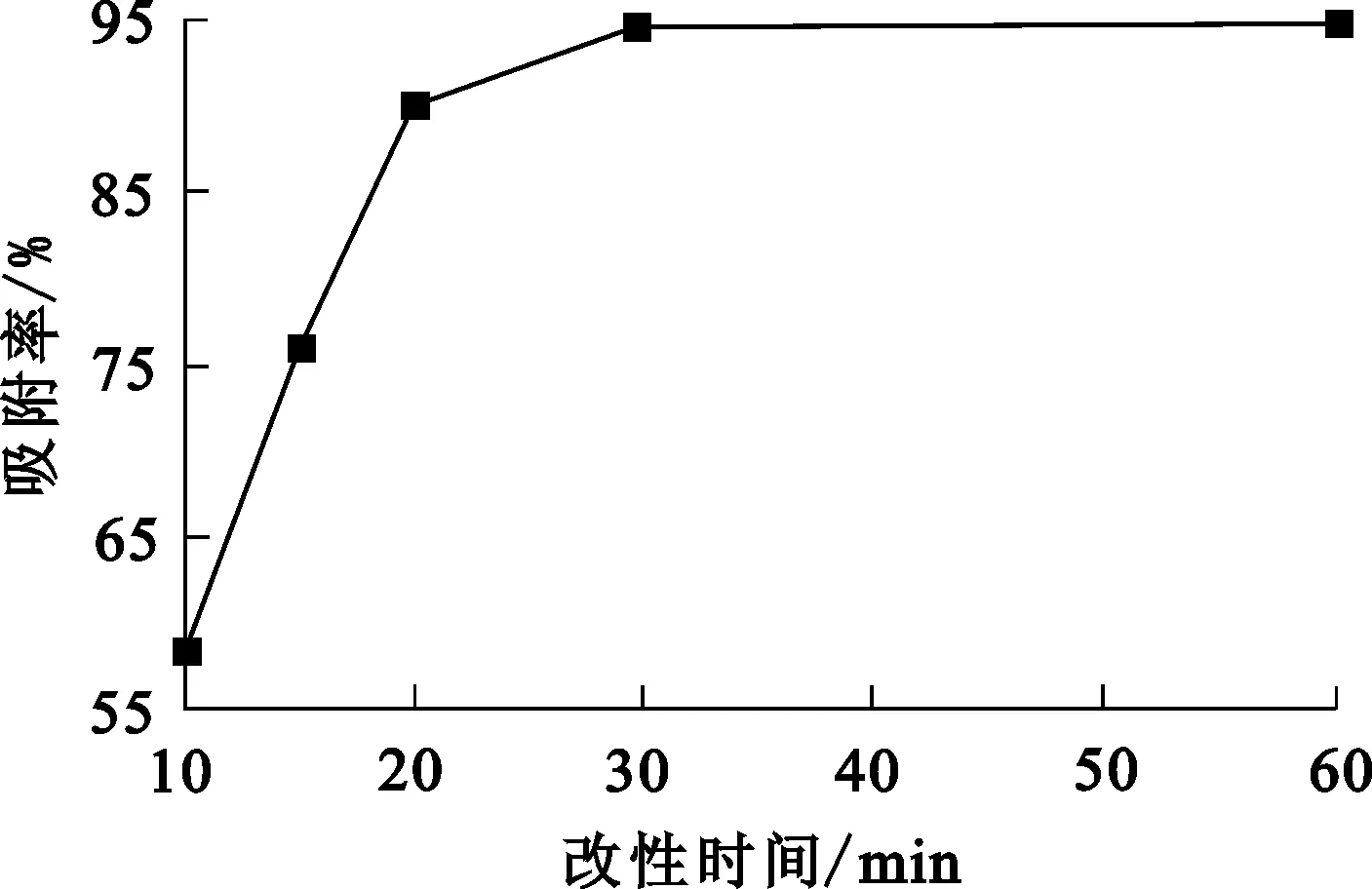
圖2 改性時間對改性殼聚糖吸附Cr(Ⅵ)的影響
2.3 殼聚糖-乙酸溶液質(zhì)量濃度對改性殼聚糖吸附Cr(Ⅵ)的影響
控制乙酸銅質(zhì)量為0.5 g,改性溫度45 ℃,改性時間1 h,殼聚糖-乙酸溶液質(zhì)量濃度對殼聚糖吸附Cr(Ⅵ)的影響試驗結(jié)果如圖3所示。
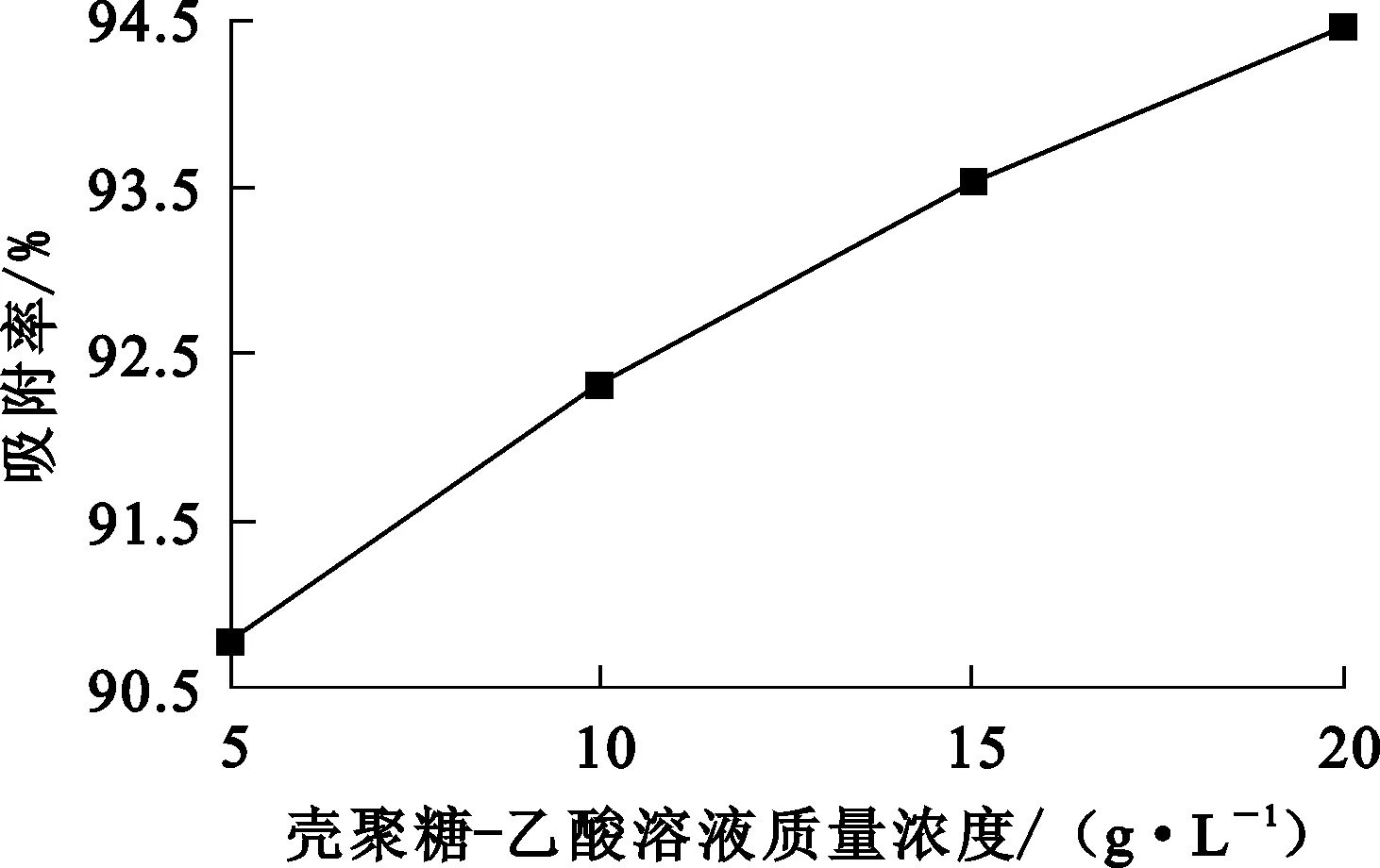
圖3 殼聚糖-乙酸溶液質(zhì)量濃度對Cr(Ⅵ)吸附率的影響
由圖3看出,隨殼聚糖溶液質(zhì)量濃度提高,改性殼聚糖對Cr(Ⅵ)吸附率逐漸增大。這表明:殼聚糖含量越多,體系中用于吸附Cr(Ⅵ)的官能團也越多,更有利于對Cr(Ⅵ)的吸附;但殼聚糖質(zhì)量濃度過高,體系變得更黏稠,不利于實際反應發(fā)生。綜合考慮,確定殼聚糖質(zhì)量濃度以控制在20 g/L以內(nèi)較為適宜。
2.4 乙酸銅用量對改性殼聚糖吸附Cr(Ⅵ)的影響
控制殼聚糖-乙酸溶液質(zhì)量濃度20 g/L,溫度45 ℃,改性時間1 h,改性劑乙酸銅用量對改性殼聚糖吸附Cr(Ⅵ)的影響試驗結(jié)果如圖4所示。
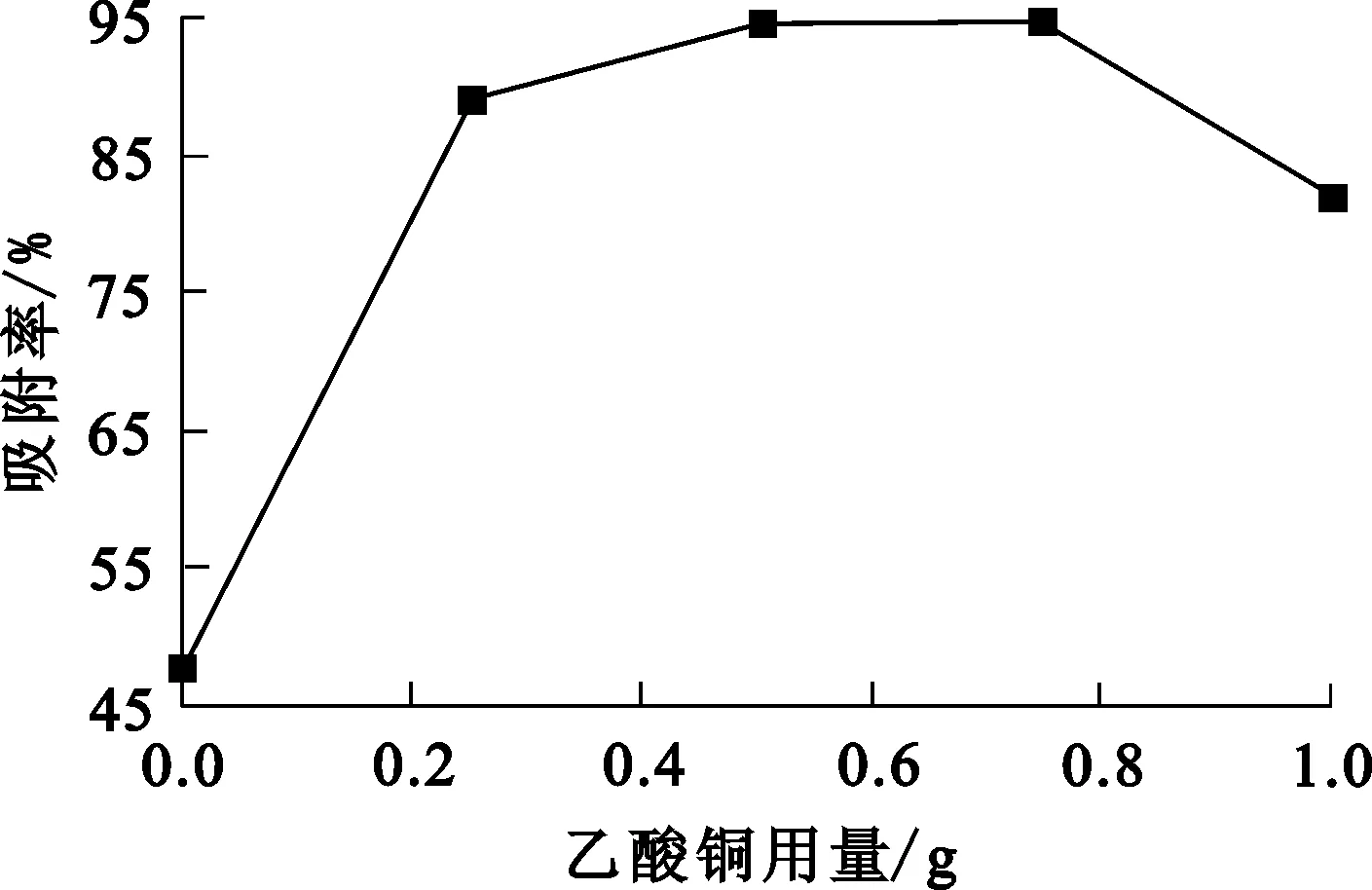
圖4 乙酸銅用量對改性殼聚糖吸附Cr(Ⅵ)的影響
由圖4看出:隨糖-銅配比增大,鉻吸附率提高,表明適當?shù)臍ぞ厶秦撦d適量銅更有利于吸附Cr(Ⅵ);但負載的銅過多對吸附Cr(Ⅵ)反而不利。這可能是乙酸銅改性過程中,殼聚糖上引入羧基基團,這些基團會吸附殼聚糖表面的電子,使殼聚糖表面帶負電荷,有利于吸附帶正電荷的Cr(Ⅵ),并且與Cr(Ⅵ)配位使殼聚糖堿性基團—OH減少;同時,Cr(Ⅵ)是較強的電子接收體,殼聚糖與其螯合后更易與表面帶負電荷的物質(zhì)結(jié)合,有利于吸附,但乙酸銅引入過多會導致殼聚糖空間位阻增大,對吸附Cr(Ⅵ)不利,使吸附率下降。此外,乙酸銅用量為零,即未改性殼聚糖吸附鉻試驗中得到鉻的吸附率僅為47.83%,可以看出改性后對殼聚糖吸附鉻的效果提高較多。
2.5 改性殼聚糖的表征
2.5.1改性殼聚糖的溶解性
改性殼聚糖溶解性試驗結(jié)果見表1。CTS在酸性溶液中溶解,而CuCTS不溶于酸,更有利于處理酸性廢水。

表1 CTS和CuCTS在不同溶劑中的溶解性
2.5.2紅外光譜表征
圖5、6分別為乙酸銅用量為0.5、2.0 g時CuCTS的紅外光譜。可以看出:CuCTS在686 cm-1處出現(xiàn)銅的伸縮振動吸收峰,這與乙酸銅的紅外光譜相比發(fā)生藍移,說明乙酸銅和殼聚糖發(fā)生了交聯(lián)作用。

圖5 乙酸銅用量為0.5 g時CuCTS的紅外光譜
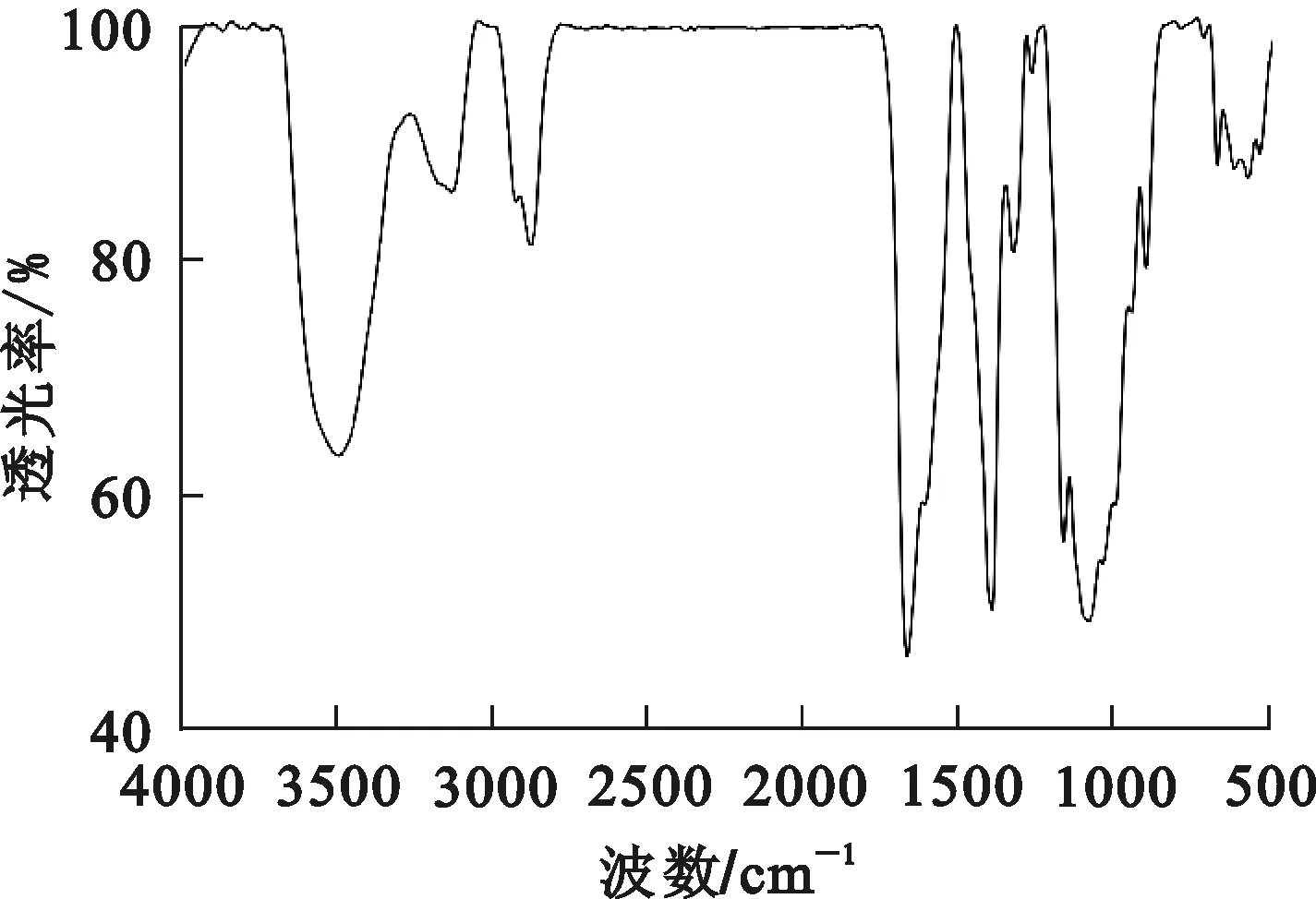
圖6 乙酸銅用量為2 g時CuCTS的紅外光譜
殼聚糖-銅配合物形成后,原殼聚糖中的—NH2、—OH伸縮振動峰重疊導致多重吸收峰發(fā)生分裂,形成1個羥基吸收峰和1個氨基吸收峰,對應曲線中3 471和3 130 cm-1處、3 496和3 134 cm-1處,并且隨乙酸銅用量增加,吸收波數(shù)增大,表明殼聚糖與乙酸銅發(fā)生反應,殼聚糖中參與配位的氨基、羥基增多,分子內(nèi)氫鍵削弱更加明顯[14,17]。
乙酸銅用量較大時,2 870 cm-1處出現(xiàn)—CH鍵的伸縮振動峰,1 616和1 402 cm-1處、1 662和1 394 cm-1處的2個強峰對應COO—的不對稱和對稱伸縮振動峰,表明有羧酸鹽引入;1 402和1 394 cm-1處也可能為C—N鍵的伸縮振動峰,此峰強度有所增大,可能是殼聚糖和銅的配合使C—N鍵強度發(fā)生變化所致;此外,C—O鍵的伸縮振動由1 060 cm-1移動至1 087 cm-1處,為殼聚糖結(jié)構(gòu)中仲醇的—OH參與的和Cu的配位,C—O鍵發(fā)生彎曲,產(chǎn)生較強的彎曲振動吸收,隨乙酸銅用量增大,此峰強度增強。這都表明:隨體系中銅量增加,殼聚糖表面羧基增多,羥基減少。試驗中,pH在3~4左右,此時Cr(Ⅵ)多以負電荷形式存在,羧基基團的增加更有利于吸附帶負電荷的鉻離子,即通過改性形成了對吸附Cr(Ⅵ)更有利的條件。
3 結(jié)論
利用乙酸銅對殼聚糖進行改性,并將改性后殼聚糖用于從含Cr(Ⅵ)廢水中吸附去除Cr(Ⅵ)是可行的。在75 ℃條件下,殼聚糖對Cr(Ⅵ)的吸附能力最佳;殼聚糖改性時間對其吸附Cr(Ⅵ)的性能影響不大;乙酸銅用量過多反而降低改性殼聚糖對Cr(Ⅵ)的吸附。改性后殼聚糖在酸性溶液中不易溶解,表明改性對殼聚糖表面官能團有明顯影響,有利于用于酸性溶液中Cr(Ⅵ)的吸附去除。

