Cr2O3 在NaCl-KCl-NaF 熔鹽體系中的溶解特性研究
張宏博,張士憲,李慧蓉,馬 濤,曹玉鵬,李 欣,李孟星,王 叢,李運剛
(華北理工大學冶金與能源學院,河北 唐山 063009)
近些年,隨著電子、航空等產業的快速發展,針對金屬鉻的需求日益增加[1]。 金屬鉻作為非常重要的戰略資源,具有硬度高、抗腐蝕、抗高溫等特征[2]。制取金屬鉻主要有電解法和鋁熱法[3],鋁熱法采用金屬鋁作為還原劑、Cr2O3作為原料, 所制得的金屬鉻純度較低,還含有鋁、硅等其他元素。 熔鹽電解法制備金屬鉻因其具有污染小、無析氫反應、高電流效率及高電導率等優勢得到廣泛應用[4]。 Cr2O3具有抗高溫氧化性和化學穩定性等特點[5],但它對增加材料的抗彎強度、硬度、致密度具有重要影響。當Cr2O3質量分數達到5%時, 材料的致密度達到100%,抗彎強度和硬度也達到最大[6]。
本課題經研究發現,NaCl-KCl-NaF 熔鹽體系具有熔點低的優點。但迄今為止,還未見NaCl-KCl-NaF-Cr2O3熔鹽體系物理化學性質的相關報道。 對熔鹽體系進行深入系統研究, 可以為電沉積工藝提供最優化的工藝參數和理論依據, 而且通過對溶解度的研究還可以推測出熔鹽體系的化學反應與結構。 因此,筆者分別研究了時間、溫度以及NaF 含量對Cr2O3在NaCl-KCl-NaF 熔鹽體系中溶解度的影響,并確定其溶解機理。
1 實驗方案
1.1實驗試劑及處理
實驗采用的NaCl、KCl、NaF 和Cr2O3均為 分析純試劑, 按比例稱量后用電熱恒溫干燥箱8 h 烘干脫水,以避免試劑吸附水對實驗結果造成影響,之后混合均勻放入石墨坩堝內備用。
1.2 實驗設備
實驗裝置如圖1 所示。 實驗采用井式電阻加熱爐加熱,DWK-702 型精密溫度控制儀控溫, 鎳鉻-鎳硅熱電偶測溫;熔鹽采用電子分析天平稱量,DHG-101-1 型電熱恒溫干燥箱烘干,采用瑪瑙研缽研磨,坩堝為高純石墨坩堝;檢測設備為ZSX PrimusⅡ型X 射線熒光光譜儀與D/MAX2500PC 型X 射線衍射儀。
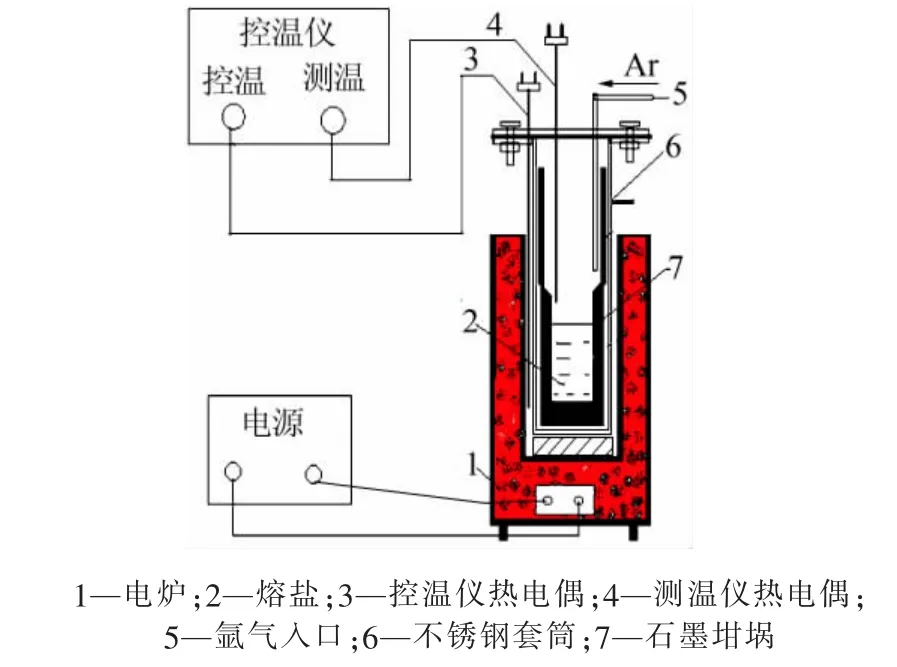
圖1 實驗裝置示意圖
1.3 實驗方法
溶解度的測定方法主要包括目測法、 鋼彈法以及等溫飽和法,本實驗采用等溫飽和法來測定Cr2O3在NaCl-KCl-NaF 熔鹽體系中的溶解度。首先,稱取一定比例的熔鹽放入研缽內混合均勻, 裝入高純石墨坩堝,為了減少熔鹽的揮發,坩堝加蓋后置于加熱爐內,并通入氬氣保護。當溫度到達預設值后開始計時,為了使Cr2O3在熔鹽體系中充分溶解,每隔0.5 h攪拌1 次。之后根據實驗方案,定時用小瓷舟取出上層清液,冷卻后研磨成粉末,用壓樣機壓樣后,使用X 射線熒光光譜儀檢測Cr2O3的含量,即可得NaCl-KCl-NaF 熔鹽體系中Cr2O3的溶解度。
2 實驗結果與討論
2.1 Cr2O3 溶解飽和時間的確定
測定Cr2O3的溶解度, 首先需要確定其溶解飽和時間。選取熔鹽組分物質的量比[n(NaCl):n(KCl):n(NaF),下同]為2∶2∶1,Cr2O3質量分數為3.75%。 按比例稱量原料,將熔鹽混合均勻后放入高純石墨坩堝,再將坩堝放入加熱爐內加熱升溫。設定加熱爐溫度為700 ℃,同時通入氬氣保護。 升溫至700 ℃并穩定后開始計時,分別選取0.5、1、1.5、2、3、4、5、6 h 共8 個時間段,到達預定的時間后,用小瓷舟迅速取出部分上層清液,在空氣中急冷,將冷卻后的樣品研成粉末,再用X 射線熒光光譜檢測。 在此基礎上,繼續升溫至730 ℃,溫度恒定后開始計時,分別選取20、40、60、80、100、120 min 共6 個時間段, 按照上述步驟重復操作,即可得到Cr2O3在NaCl-KCl-NaF 熔鹽體系中的溶解飽和時間。
2.1.1 700 ℃下Cr2O3溶解飽和時間的確定
在700 ℃的實驗條件下, 測定Cr2O3在NaCl-KCl-NaF 熔鹽體系中的溶解量(本次實驗中Cr2O3的溶解量全部用質量分數表示)與溶解時間的關系,結果見表1。
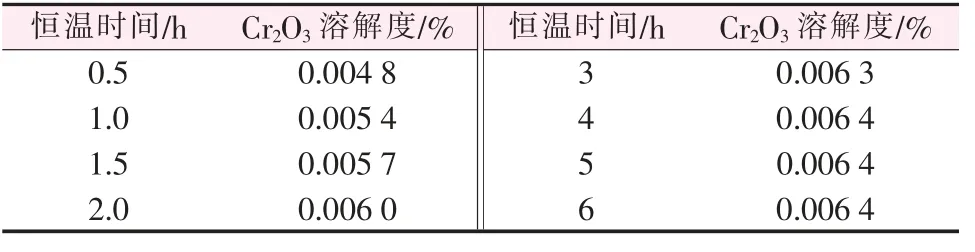
表1 不同恒溫時間下Cr2O3 的溶解量(700 ℃)
根據表1 中的數據作圖,得到700 ℃時Cr2O3在NaCl-KCl-NaF 熔融鹽體系中的溶解量隨時間的變化曲線,如圖2 所示。 由圖2 可以看出,曲線在4 h 以后趨于平衡,為了使熔鹽充分溶解,又要減少熔鹽的揮發,實驗選取5 h 為Cr2O3的溶解飽和時間。
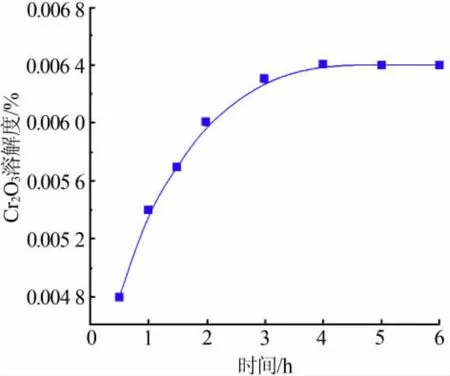
圖2 700 ℃下Cr2O3 溶解度的時間曲線
2.1.2 700 ℃下升高30 ℃后Cr2O3重新達到溶解飽和的時間
同一熔鹽體系中, 在700 ℃的基礎上保溫5 h后升溫至730 ℃, 即研究溫度升高30 ℃的條件下,Cr2O3在NaCl-KCl-NaF 熔鹽體系中的溶解量與溶解時間的關系。 到達730 ℃之后,每隔20 min 取樣一次,之后研磨檢測,實驗結果如表2 所示。
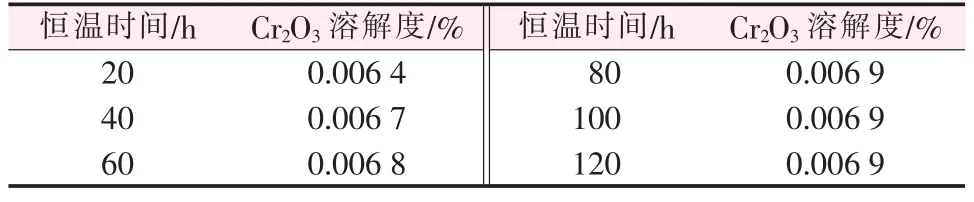
表2 不同恒溫時間下Cr2O3 的溶解量(730 ℃)
根據表2 中的數據作圖,得到730 ℃時Cr2O3在NaCl-KCl-NaF 熔融鹽體系中的溶解量隨時間的變化曲線,如圖3 所示。由圖3 可以看出,曲線在80 min以后趨于平衡, 所以實驗選取80 min 為Cr2O3的溶解飽和時間。

圖3 730 ℃下Cr2O3 溶解度的時間曲線
2.2 溫度對Cr2O3 溶解度的影響
在n(NaCl)∶n(KCl)∶n(NaF)=2∶2∶1、w(Cr2O3)=3.75%的條件下, 將熔鹽混合均勻后放入高純石墨坩堝,再將坩堝放入加熱爐內加熱升溫。設定加熱爐溫度為700 ℃,同時通入氬氣保護,溶解飽和時間為5 h。 之后溫度升高30 ℃,再保溫80 min,重復此操作,溫度分別為700、730、760、790、820 ℃,到達預定的時間后,用小瓷舟迅速取出部分上層清液,在空氣中急冷,將冷卻后的樣品研成粉末,再用X 射線熒光光譜檢測,實驗結果見表3。
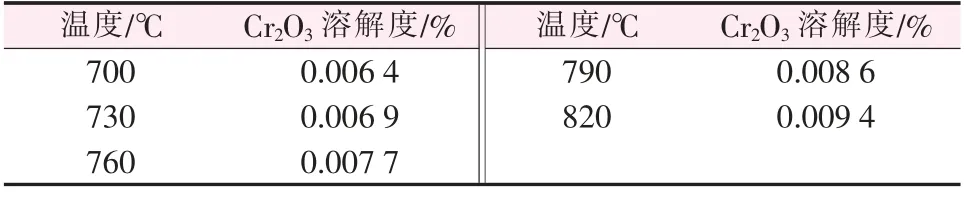
表3 不同溫度下Cr2O3 溶解度
根據表3 中的數據作圖, 得到Cr2O3在NaCl-KCl-NaF 熔融鹽體系中的溶解度隨溫度的變化曲線,如圖4 所示。 由圖4 可以看出,在700~820 ℃時,Cr2O3的溶解度隨著溫度的升高而增大,且近似于線性。 為了體現規律性,對實驗數據進行線性擬合:
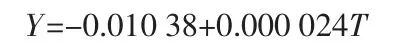
式中,Y為Cr2O3的溶解度,%;T為溫度,℃;相關系數R2=0.977 74。
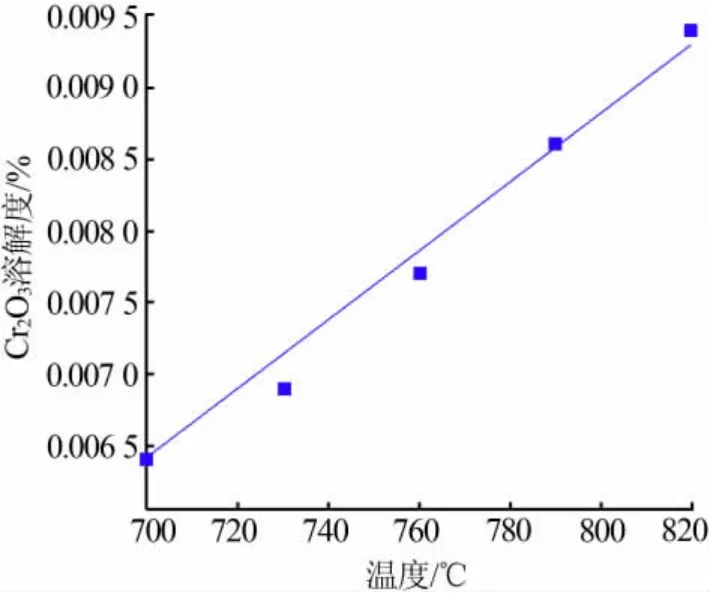
圖4 Cr2O3 的溶解度隨溫度的變化規律
2.3 NaF 含量對Cr2O3 溶解度的影響
選取熔鹽溫度為700℃、Cr2O3質量分數為3.75%、恒溫時間為5 h,n(NaCl)∶n(KCl)=1∶1,此時取NaF的物質的量分數為10%~50%,步長值為10%。 到達預定時間,用小瓷舟取樣,并在空氣中迅速冷卻,冷卻后放入研缽中,研磨成粉末,用X 射線熒光光譜檢測, 即得出Cr2O3的溶解度隨NaF 含量的變化規律,實驗結果見表4。
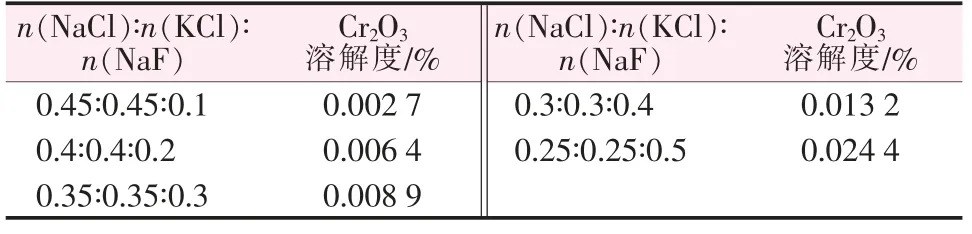
表4 NaF 含量對Cr2O3 溶解度的影響
根據表4 中的數據作圖, 得到Cr2O3在NaCl-KCl-NaF 熔融鹽體系中的溶解度隨NaF 含量的變化曲線,如圖5 所示。由圖5 可以看出,Cr2O3的溶解度隨著NaF 含量的升高而增大,且近似于曲線。 為了體現規律性,對實驗數據進行曲線擬合:

式中,XNaF為NaF 的物質的量分數,%;相關系數R2=0.954 74。
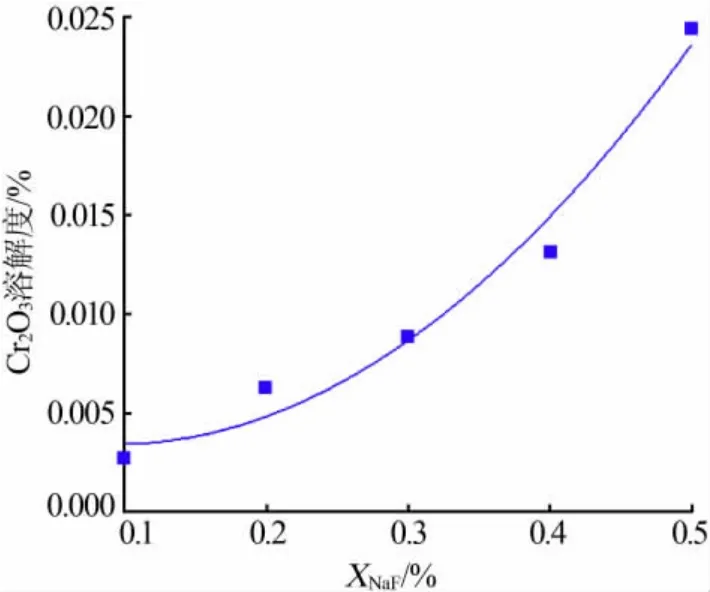
圖5 NaF 含量對Cr2O3 溶解度的影響
3 Cr2O3 在NaCl-KCl-NaF 中的溶解機理
3.1 Cr2O3 與NaCl、KCl、NaF 之間的反應熱力學分析
利用HSC5.0 熱力學軟件計算Cr2O3與NaCl、KCl 和NaF 之間的反應熱,結果見表5。
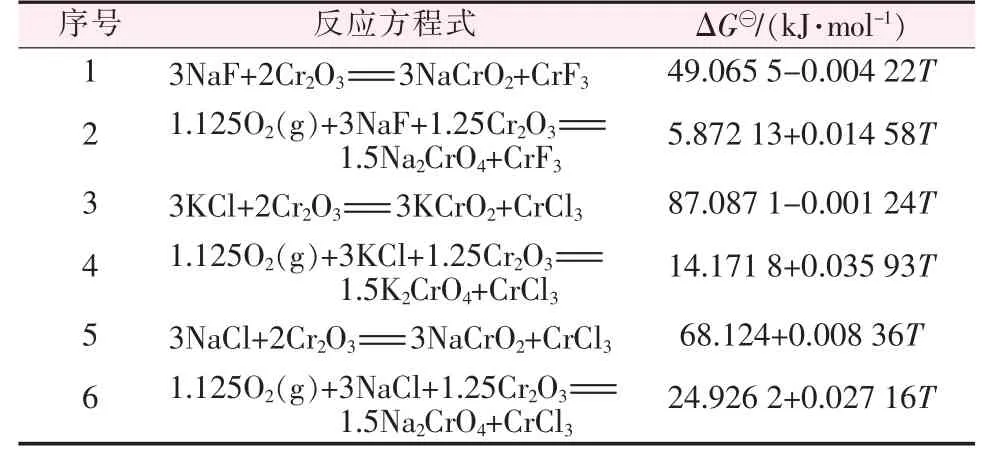
表5 反應吉布斯自由能
根據熱力學原理, 可以利用反應吉布斯自由能的正負判斷反應進行的方向。在本次實驗中,如果在600~1 000 ℃時反應的吉布斯自由能小于零,則證明反應可以發生。 標準吉布斯自由能與溫度的關系如圖6 所示。
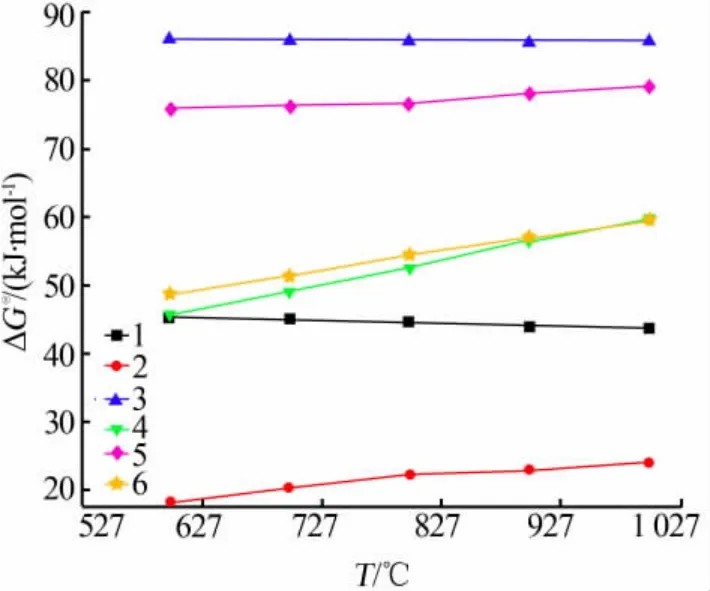
圖6 ΔG?與T 的關系
一般情況下可用ΔG?來判斷反應進行的方向。從圖6 可以看出, 在實驗條件下600~1 000 ℃時各個反應的ΔG?都大于0,說明反應無法正向進行。
3.2 熔鹽的X 射線衍射分析
熔鹽體系的固態相結構對推斷該熔鹽在熔融狀態下的結構提供了重要的理論依據。 為了進一步檢測熔鹽成分,選取n(NaCl)∶n(KCl)∶n(NaF)=2∶2∶1、w(Cr2O3)=3.75%的熔鹽在700 ℃的條件下保溫5 h,使Cr2O3達到飽和溶解時間。 再將熔鹽隨爐冷卻后取出,取上、下層熔鹽研磨后進行X射線衍射分析,結果見圖7。 由圖7a 可以看出,冷卻后在該熔鹽的上層只存在NaCl、KCl 和NaF 這3 種物質, 這是由于Cr2O3溶解度很低,無法檢測出;由圖7b 可以看出, 冷卻后熔鹽體系的下層存在NaCl、KCl、NaF 和Cr2O3這4 種物質,沒有新物質生成。這說明Cr2O3進入到熔鹽中是靠物理溶解來完成的, 并與熱力學軟件計算的結果一致。
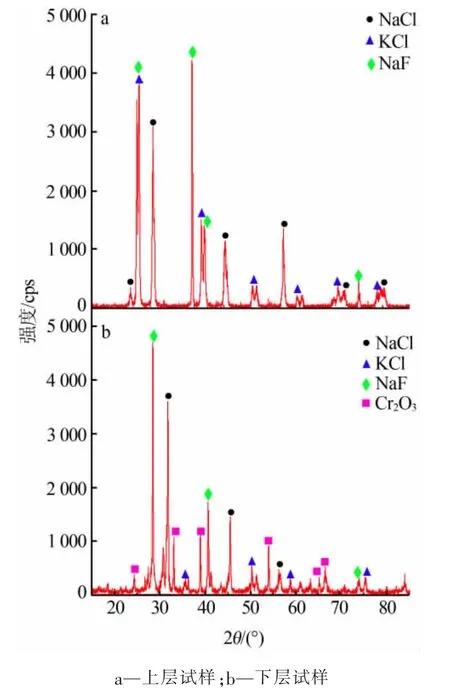
圖7 熔鹽的XRD 譜圖
4 結論
通過對Cr2O3在NaCl-KCl-NaF 熔鹽體系中溶解度的研究,可以得出結論:1)700 ℃時,Cr2O3在該熔鹽體系中的溶解飽和時間為5 h 左右, 繼續升高溫度30 ℃,達到再飽和需要80 min 左右;2)在研究的條件范圍內,Cr2O3在該熔鹽體系中的溶解度隨溫度的升高而增大,隨NaF 含量的增加而增大,其溶解機理為物理溶解,溶解量很小。

