多重熒光定量PCR測定登革熱Ⅰ~Ⅳ型方法的建立與初步評價
費云霞 張祥波 何韜 張雨婷 高依丹 高嶺 王潔 陳公英


[摘要] 目的 探討多重熒光定量PCR測定登革熱Ⅰ~Ⅳ型方法的建立與初步評價。 方法 針對登革熱Ⅰ~Ⅳ型使用自建的引物探針對反應條件及溫度進行調整,且對陽性樣本進行不同濃度的稀釋,檢測自建多重熒光定量PCR在登革熱Ⅰ~Ⅳ型測定中的重復性、靈敏性及特異性。 結果 6份登革熱陽性樣本通過自建的檢測方法來進行檢測,全部能夠顯示明顯的S曲線擴增,且與原有確證方法相比,不同型別的結果一致。其他10份病毒陽性樣本及陰性樣本全部沒有顯示擴增曲線,提示自建的檢測方法特異性良好。分別檢測登革熱Ⅰ~Ⅳ型,變異系數(CV%)值水平范圍:0.51~5.51,提示重復性較好。使用自建的多重熒光定量PCR對登革熱不同型別進行檢測的平均用時與ELISA法相比無顯著差異(t=1.561,P>0.05)。通過自建的多重熒光定量PCR測定通過儀器來完成核酸的自動提取,在儀器當中加樣、上機之后不需要另外的操作,充分降低了發生污染的風險。 結論 本次研究設計建立的登革熱Ⅰ~Ⅳ型多重熒光定量PCR檢測方法,在重復性、靈敏性及特異性方面均較為理想;且相比ELISA法在加樣后無需另外手動操作,更加簡易方便。
[關鍵詞] 登革熱;熒光定量PCR;血清型;病毒載量
[中圖分類號] R512.8? ? ? ? ? [文獻標識碼] A? ? ? ? ? [文章編號] 1673-9701(2019)34-0008-06
Establishment and preliminary evaluation of multiplex quantitative PCR for determination of dengue fever type Ⅰ-Ⅳ
FEI Yunxia1? ?ZHANG Xiangbo2? ?HE Tao2? ?ZHANG Yuting1? ?GAO Yidan3? ?GAO Ling3? ?WANG Jie3
CHEN Gongying3
1.Zhejiang University of Traditional Chinese Medicine, Hangzhou? ?310053, China; 2.Hangzhou Normal University, Hangzhou? ?310053, China; 3.Department of Infectious Diseases and Liver Diseases, Affiliated Hospital of Hangzhou Normal University, Hangzhou? ?310053, China
[Abstract] Objective To establish and evaluate the method of multiplex quantitative PCR for the determination of dengue fever type Ⅰ-Ⅳ. Methods For the dengue type Ⅰ-Ⅳ, the self-built primer probe was used to adjust the reaction conditions and temperature, and the positive samples were diluted at different concentrations. The repeatability, sensitivity and specificity of self-built multiplex quantitative PCR in the determination of dengue type Ⅰ-Ⅳ. Results Six dengue-positive samples were tested by self-built detection methods, all of which showed significant S-curve amplification, and the results of the different types were consistent compared with the original confirmation method. The other 10 virus-positive samples and negative samples did not show amplification curves, suggesting that the self-built detection method was specific. The dengue type Ⅰ-Ⅳ type was detected separately, and the coefficient of variation(CV%) value range was 0.51-5.51, indicating good repeatability. The mean time to test different types of dengue using self-built multiplex quantitative PCR was not significantly different from ELISA(t=1.561, P>0.05). Through the self-built multiplex quantitative PCR assay, the automatic extraction of nucleic acid was completed by the instrument, and no additional operation was required after the sample was loaded in the instrument and the machine was taken on, which completely reduced the risk of contamination. Conclusion The dengue type Ⅰ~Ⅳ multiplex quantitative PCR method established in this study is ideal in terms of repeatability, sensitivity and specificity. Compared with ELISA, no additional manual operation is required after the sample is added. It is easy and convenient.
[Key words] Dengue fever; Real-time PCR; Serotype; Viral load
登革熱病毒在臨床中歸屬于黃病毒科,依據不同的表面抗原,臨床中將其分為4個不同的血清型別,分別為DEN-Ⅰ~DEN-Ⅳ[1]。最近幾年,隨著氣候及環境的變化,同時旅游業及城市化的飛速發展等,均為登革熱病毒的擴散及傳播提供更加便利、快捷的條件,導致登革熱病毒的流行區域持續增大。目前臨床中診斷登革熱病毒的金標準方法就是病毒分離,但登革熱病毒需要1 d才能在細胞中生長,且通過分離病毒進行診斷時其靈敏性較低[2]。臨床中最常用的一種登革病毒抗體檢測方法就是血清學檢測,尤其是檢測特異性抗體[3]。但抗體只能在發病后的1 d才可以檢測到[4]。實時定量PCR是在普通PCR基礎上發展而得,包括兩種:探針類及非探針類,探針類增加了識別特異性探針這一步驟,因此具有很高的檢測特異性[5]。國內已經有相關研究開始著手使用熒光定量PCR對登革熱病毒進行檢測。本實驗進一步研究不同分型登革熱病毒的熒光定量PCR檢測方法,且對該檢測方法的臨床檢測效能進行評價,現報道如下。
1 資料與方法
1.1儀器與試劑
登革熱盲樣、諾如病毒、乙腦病毒、流感病毒等全部由本地疾控中心提供;健康者血清由本地血站提供;引物探針:由伯樂生命醫學產品(上海)有限公司合成,熒光定量PCR儀:型號:AB7500,購自Applied Biosystems;核酸提取儀器和配套試劑盒:購自上海西寶生物,熒光定量PCR試劑盒,型號:RR064A,購自上海酶聯科研;登革熱病毒通用型試劑盒購自上海酶聯科研;登革熱分型引物探針由本地疾控中心提供。ELISA特異性檢測IgM抗體試劑盒:購自上海紀寧生物;流感病毒試劑盒:購自上海紀寧生物,諾如試劑盒:購自上海紀寧生物。BHK-21細胞:含胎牛血清(濃度為8%)的DMEM培養液進行傳代培養,溫度:37℃,CO2:5%的條件下進行培養。
1.2方法
1.2.1 標準品的制備? 將登革熱陽性樣本、登革熱病毒通用型試劑盒的陽性對照品,分別進行四個不同梯度的稀釋:10倍、100倍、1000倍、10000倍。
1.2.2 核酸PCR擴增? 詳見說明書;PCR反應體系參數:12.5 μL Buffer,0.5 μL逆轉錄酶,0.5Ixl Taq酶,上游引物、下游引物共0.5 μL,探針0.5 μL,0.5 μL模板,加清水補足到25 μL。參數條件:42℃、10 min,60℃、34 s,95℃、2 min,95℃、5 s,40個循環。評估標準:擴增曲線呈S型,且CT值≤35判定陽性[6]。
1.2.3 登革混合感染Ⅰ型病毒及Ⅱ型病毒的樣本制備和檢測? 將BHK-21細胞接種到12孔細胞培養板中進行培養到單層,并將制備好的登革Ⅰ型病毒懸液及Ⅱ型病毒懸液根據10倍的梯度進行等比稀釋,接種至12孔(規格:0.2 mL/孔)細胞培養板當中并進行搖勻:15 min/次,在37℃的環境下進行1.5 h的孵育,再加入低熔點瓊脂(2%):1 mL,跟2×DMEM培養基混合物進行1:1的覆蓋,等到凝固之后,放置到培養箱當中繼續進行培養,在6 d之后使用結晶紫實施染色,計算空斑數水平。
C6/36細胞根據2.5×105/孔轉移至6孔細胞培養板當中,溫度:28℃,CO2:5%進行24 h的培養后,接種病毒,共分成:感染登革Ⅰ型病毒組、感染登革Ⅱ型病毒組、混合感染登革Ⅰ型病毒及Ⅱ型病毒組。每組依據感染復數MOI=1(2.5×105 PFU/孔)來接種病毒,培養箱內溫度:37℃,CO2:5%進行1.5 h的孵育后,將病毒懸液的上清層吸出,使用RPIM1640培養液進行兩次清洗,再加入FBS(2%):2 mL的RPIM1640培養液分別進行不同時間段的培養:36 h、48 h、60 h、72 h、84 h、96 h、120 h,吸取病毒上清,冷凍保存待用。在取樣之后,在各個培養孔內加入維持液:100 μL,補齊到2 mL,重復實驗3次。依據RNA提取試劑盒當中的操作說明書來提取并收集病毒上清中的RNA,用本次實驗當中所建立的多重熒光定量PCR來檢測C6/36混合感染登革Ⅰ型病毒和登革Ⅱ型病毒之后的不同時間病毒拷貝數水平。
1.3 觀察指標
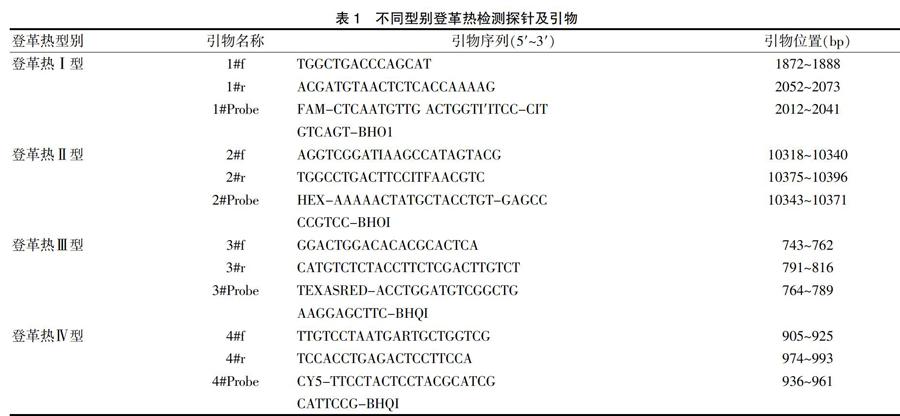
1.3.1 觀察評估多重熒光定量PCR測定的特異性? ? 共選取16份樣本進行特異性檢測,其中,登革熱盲樣:7份,確證Ⅰ型2份,Ⅱ型1份,Ⅲ型1份,Ⅳ型1份,陰性樣本2份;DEN-Ⅰ陽性標本1份:通過ELISA進行IgM抗體特異性檢測,且通過核酸檢測驗證;乙腦陽性2份;流感陽性2份,諾如陽性2份,健康者血清2份。對上述的16份樣本通過登革熱不同型別探針和引物試劑盒(表1)、諾如試劑盒、流感試劑盒和登革熱通用型進行分別檢測,沒有雙重或多重病毒感染,最多感染1種病毒。使用自建的方法來檢測所有樣本,以評估其特異性。
1.3.2 觀察評估多重熒光定量PCR測定的靈敏性? 通過試劑盒陽性對照品來對登革熱陽性4個不同樣本型別定量,將濃度調整至:1×101 copies/mL、1×102 copies/mL、1×103 copies/mL、1×104 copies/mL、1×105 copies/mL、1×106 copies/mL。用自建的引物探針分別檢測不同梯度濃度。
1.3.3 觀察評估多重熒光定量PCR測定的重復性? 取1.3.2中所得的不同梯度濃度核酸,1次/d,共進行3次重復平行檢測,依據所得CT值來確定變異系數。
1.3.4 與ELISA方法相比,觀察評估多重熒光定量PCR測定的使用性能? 選取隨機樣本,使用兩種不同的檢測方法來進行平行檢測,比較操作簡便性及檢測耗時。
1.3.5 病毒復制動態? C6/36混合感染登革Ⅰ型病毒及登革Ⅱ型病毒之后的病毒復制動態檢測。
1.4統計學方法
使用SPSS22.0統計學軟件進行分析,計數資料以%表示,采用χ2檢驗;計量資料以(x±s)表示,采用t檢驗;P<0.05為差異有統計學意義。
2 結果
2.1 特異性
6份登革熱陽性樣本通過自建的檢測方法來進行檢測,全部能夠顯示明顯的S曲線擴增,并且與原有確證方法相比,不同型別的結果一致。其他10份病毒陽性樣本及陰性樣本全部沒有顯示擴增曲線,提示自建的檢測方法特異性良好。
2.2 靈敏性
以DEN-Ⅰ為例,在1×103 copies/mL濃度核酸能夠明顯顯示擴增曲線;在1×102 copies/mL濃度核酸沒有顯示明顯的擴增曲線。因此,DEN-Ⅰ的檢測濃度限制范圍為1×103 copies/mL;DEN-Ⅱ的檢測濃度限制范圍為1×102 copies/mL;DEN-Ⅲ的檢測濃度限制范圍為1×102 copies/mL;DEN-Ⅳ的檢測濃度限制范圍為1×102? copies/mL。
2.3 重復性
分別檢測登革熱Ⅰ~Ⅳ型,每個不同的型別梯度濃度分別為102 copies/mL、103 copies/mL、104 copies/mL、105 copies/mL、106 copies/mL,變異系數(CV%)值水平范圍:0.51~5.51,提示重復性較好,見表2。
2.4 與ELISA方法相比,多重熒光定量PCR測定的使用性能
使用自建的多重熒光定量PCR對登革熱不同型別進行檢測的平均用時為(2.7±0.3)h;而使用ELISA法進行檢測的平均用時為(2.6±0.1)h,檢測時間方面無顯著差異(t=1.561,P>0.05)。通過自建的多重熒光定量PCR測定通過儀器來完成核酸的自動提取,在儀器當中加樣、上機后不需要另外的操作,充分降低發生污染的風險:使用ELISA法檢測時加樣之后,需要每隔一定時間來進行手動操作,增加污染樣本的風險,多重熒光定量PCR檢測相比ELISA法更加簡易方便。
2.5 C6/36混合感染登革Ⅰ型病毒及登革Ⅱ型病毒之后的病毒復制動態檢測
三次重復檢測的最大變異系數值水平為14.3%(<15%),認為重復性好,結果完全可行。通過t配對檢驗:登革Ⅰ型病毒和登革Ⅱ型病毒混合感染C6/36細胞之后,登革Ⅰ型病毒的拷貝數水平與單獨感染時拷貝水平相比并未出現顯著的差異:36 h時間點:登革Ⅰ型病毒單獨感染的拷貝數為(4.7±0.2)copies/μL、混合感染的拷貝數為(4.6±0.3)copies/μL(t=1.021,P>0.05);48 h時間點:登革Ⅰ型病毒單獨感染的拷貝數為(5.1±0.3)copies/μL、混合感染的拷貝數為(4.9±0.4)copies/μL(t=1.164,P>0.05);60 h時間點:登革Ⅰ型病毒單獨感染的拷貝數為(5.8±0.4)copies/μL、混合感染的拷貝數為(5.7±0.4)copies/μL(t=0.492,P>0.05);72 h時間點:登革Ⅰ型病毒單獨感染的拷貝數為(5.9±0.6)copies/μL、混合感染的拷貝數為(5.8±0.4)copies/μL(t=1.021,P>0.05);84 h時間點:登革Ⅰ型病毒單獨感染的拷貝數為(6.1±0.3)copies/μL、混合感染的拷貝數為(6.2±0.2)copies/μL(t=0.946,P>0.05);96 h時間點:登革Ⅰ型病毒單獨感染的拷貝數為(6.6±0.2)copies/μL、混合感染的拷貝數為(6.5±0.3)copies/μL(t=0.361,P>0.05);120 h時間點:登革Ⅰ型病毒單獨感染的拷貝數為(6.5±0.3)copies/μL、混合感染的拷貝數為(6.6±0.4)copies/μL(t=0.746,P>0.05)。通過t配對檢驗,在36~60 h時,登革Ⅱ型病毒混合感染C6/36細胞之后,登革Ⅱ型病毒拷貝數水平跟單獨感染C6/36細胞時的拷貝數水平相比并未出現顯著的差異:36 h時間點:登革Ⅱ型病毒單獨感染的拷貝數為(3.8±0.3)copies/μL、混合感染的拷貝數為(3.7±0.2)copies/μL(t=1.932,P>0.05);48 h時間點:登革Ⅱ型病毒單獨感染的拷貝數為(4.4±0.3)copies/μL、混合感染的拷貝數為(4.3±0.2)copies/μL(t=1.987,P>0.05);60 h時間點:登革Ⅱ型病毒單獨感染的拷貝數為(4.7±0.6)copies/μL、混合感染的拷貝數為(4.6±0.5)copies/μL(t=1.036,P>0.05)。72 h時,混合感染時登革Ⅱ型病毒的拷貝數水平與單獨感染的病毒拷貝數水平相比顯著降低,登革Ⅱ型病毒單獨感染的拷貝數為(6.1±0.4)copies/μL、混合感染的拷貝數為(5.2±0.3)copies/μL(t=16.962,P<0.05);同樣在84~120 h時,混合感染登革Ⅱ型病毒的拷貝數水平與單獨感染的病毒拷貝數水平相比顯著降低,84 h時間點:登革Ⅱ型病毒單獨感染的拷貝數為(6.6±0.2)copies/μL、混合感染的拷貝數為(5.3±0.4)copies/μL(t=19.061,P<0.05),96 h時間點:登革Ⅱ型病毒單獨感染的拷貝數為(7.0±0.3)copies/μL、混合感染的拷貝數為(5.7±0.3)copies/μL(t=18.375,P<0.05);120 h時間點:登革Ⅱ型病毒單獨感染的拷貝數為(7.2±0.4)copies/μL、混合感染的拷貝數為(5.8±0.5)copies/μL(t=17.942,P<0.05),見圖2。
3討論
多重熒光定量PCR檢測自從問世以來,在臨床中得到了十分迅猛的發展,在臨床多個相關領域,如食物中毒及腫瘤篩查等當中被應用[7-8]。在溫度、反應體系及探針等各個方面均不同[9-10]。檢測登革熱的多重PCR溫度及探針條件也不斷得到優化。相關研究指出,在單管反應中將2種探針進行混合,可以在短時間內快速地診斷大概具體型別[11]。未來臨床中對登革熱早期診斷的試劑主要特點為:方便操作、高度專一、更加敏感及時間更短[12-13]。目前臨床中傳統普遍使用的熒光定量PCR法對登革熱病毒進行檢測時,靈敏性好且專一[14]。但是傳統的檢查方式需要分兩步來進行檢測操作[15]。
熒光定量PCR充分地將常規PCR技術、光學技術及光共振能量傳遞現象進行充分地結合,進而更好地實現對核酸的精準定量。其在PCR指數擴增的過程中通過連續性地檢測熒光信號強度,完成對特異性產物量的實時測定,并以此來推斷目的基因的基礎初始量。TaqMan探針屬于寡核苷酸單鏈之一,熒光基團(FAM)連接主要在探針5′的末端,但淬滅基團(TAMRA)主要在3′的末端,5′端熒光基團所發射的熒光因與3′端淬滅劑相互接近時被淬滅。當靶序列與探針相互配對之后,會通過聚合酶的作用來進行延伸反應,聚合酶5′→3′外切酶的活性會切斷探針,游離出熒光基團,使得淬滅基團不再發揮其原有的淬滅效果,進而發射出熒光信號,一分子產物的生成同時會伴隨出現一分子熒光信號。隨著不斷增加的擴增循環數,釋放出的熒光基團也繼續積累。因此,TaqMan探針所檢測到的是最終積累后的熒光量。其優點主要是與探針雜交、PCR反應的靈敏性進行充分地結合;產生熒光的過程屬于不可逆的反應,生成信號之后并不會自動淬滅;其主要是對反應起始濃度水平進行測定,并不是對最終產物濃度進行測定,因此,其結果更加準確,擁有更好的重復性。目前,這一方法的主要作用就是臨床中對病毒載量的測定,即病毒數量,反映病毒繁殖能力、水平,是臨床確認感染情況、臨床診斷、指導治療、療效反應和預后評估的一個重要參考指標,在病毒感染的臨床定量監測過程中具有十分重要的作用。
本次研究通過一步法來檢測登革熱病毒的不同4個血清型別,檢測限高為102 copies/mL。本研究與衛生部所推薦的登革熱的診斷標準:RT-PCR引物系統相結合,對PCR反應體系進行更進一步的優化,通過4套針來分別針對登革熱病毒的不同4個型別的探針及引物,從而建立多重單管熒光定量PCR檢測方法。這一檢測方法有效地實現通過1個反應管,進行1次平行檢測能夠將登革熱病毒的4個不同型別進行檢測[16-17]。再與陽性對照品相比,實現病毒的精確定量[18]。與此同時,還可以監測這一檢測方法的穩定性[19-20]。
綜上所述,本次研究設計建立的登革熱Ⅰ~Ⅳ型多重熒光定量PCR檢測方法,在重復性、靈敏性及特異性方面均較為理想;且相比ELISA法在加樣后無需另外手動操作,更加簡易方便。
[參考文獻]
[1] 孫愛娟,林立豐,蘭策介,等.登革1型和2型病毒混合感染樣本的一步法實時熒光定量PCR檢測方法的建立[J].寄生蟲與醫學昆蟲學報,2018,9(1):23-27.
[2] 高鑫,朱武洋,盧學新.實時熒光定量PCR在病毒檢測中的應用[J].中國人獸共患病學報,2018,34(7):84-91.
[3] Jerusalinsky L,Oliveira MM,Pereira RF,et al. Preliminary evaluation of the conservation status of callicebus coimbrai Kobayashi & Langguth,1999 in the Brazilian state of sergipe[J]. Primate Conservation,2017,35(15):25-32.
[4] 李要星,楊爽,李娜,等.國產酶聯免疫試劑檢測登革熱效能評價[J].中國病原生物學雜志,2017,4(5):434-436.
[5] Cucuzza LS,Biolatti B,Divari S,et al. Development and application of a screening method of absolute quantitative PCR to detect the abuse of sex steroid hormone admi-nistration in male bovines[J]. Journal of Agricultural & Food Chemistry,2017,65(23):4866-4874.
[6] 胡挺松,張海林,劉永華,等.云南省登革4型病毒全基因組序列特征研究[J].中國人獸共患病學報,2017,33(10):859-867.
[7] Min KK,Lee S,Kim BJ,et al. A preliminary analysis of the diet composition of overwintering Bean geese (Anser fabalis) and greater white-fronted geese(A. albifrons) in Korea using PCR on fecal samples[J]. Animal Cells and Systems,2017,21(2):141-145.
[8] 劉遠,蔣力云,景欽隆,等.2001-2016年廣州市登革3型病毒E基因序列及系統進化樹分析[J].中國人獸共患病學報,2018,34(5):487-491.
[9] Naveca FG,Nascimento VAD,Souza VCD,et al. Multiplexed reverse transcription real-time polymerase chain reaction for simultaneous detection of Mayaro,Oropouche,and Oropouche-like viruses[J]. Memorias Do Instituto Oswaldo Cruz,2017,112(7):510-513.
[10] 高博,鄭暉,李樞,等.登革熱病毒(DENV)包膜蛋白特異性人源抗體篩選與鑒定[J].中國人獸共患病學報,2018, 34(10):62-68.
[11] Undurraga EA,Edillo FE,Erasmo JNV,et al. Disease burden of dengue in the Philippines:Adjusting for underreporting by comparing active and passive dengue surveillance in Punta Princesa,Cebu city[J]. American Journal of Tropical Medicine & Hygiene,2017,96(4):887-898.
[12] 杜燕華,李懿,王若琳,等.2017年河南省登革熱疑似病例的實驗室診斷與分子溯源[J].中華預防醫學雜志,2018,52(11):1164-1167.
[13] Bischof GF,Magnani DM,Ricciardi M,et al. Use of a recombinant gamma-2 herpesvirus vaccine vector against dengue virus in rhesus monkeys[J]. Journal of Virology,2017,91(16):JVI.00525-17.
[14] 徐勝平,劉琪琦,張嚴峻,等.9種發熱伴出疹病原體基因芯片檢測方法的建立[J].軍事醫學,2017,41(2):135-140.
[15] Cherupanakkal C,Ramachadrappa V,Kadhiravan T,et al. A study on gene expression profile of endogenous antioxidant enzymes:CAT,MnSOD and GPx in dengue patients[J]. Indian Journal of Clinical Biochemistry,2017, 32(4):1-9.
[16] 張培,李春緣,陳迪嘉,等.Ⅰ型登革病毒感染后不同病程病毒核酸及其IgM抗體的變化規律[J].第三軍醫大學學報,2017,39(4):328-332.
[17] 師永霞,黃鸝,廖蕓,等.2009-2015年廣州口岸輸入性登革熱的流行病學分析[J].現代預防醫學,2017,44(6):965-967.
[18] Tan KK,Azizan NS,Yaacob CN,et al. Operational utility of the reverse-transcription recombinase polymerase amplification for detection of dengue virus[J]. Bmc Infectious Diseases, 2018,18(1):169.
[19] 呂榜軍,梁忠福.2016年柳州市蚊類種群分布和蚊蟲病毒攜帶情況調查分析[J].現代預防醫學,2017,44(17):47-51.
[20] 胡挺松,張海林,劉永華,等.云南中緬邊境登革1型病毒全基因組序列特征研究[J].中國人獸共患病學報,2017, 33(6):473-480.
(收稿日期:2019-08-06)

