高效液相色譜-串聯質譜法測定人血清中萬古霉素的濃度
苗娜 張占英 劉紀松
萬古霉素(vancomycin)為三環糖肽類抗菌藥物,是目前治療耐甲氧西林金黃色葡萄球菌(methicillin-resistant Staphylococcus aureus,MRSA)感染的一線用藥[1-2]。Ye等[3]采用系統評價和Meta分析的方法評價了萬古霉素治療藥物監測(therapeutic drug monitoring,TDM)的必要性。結果顯示,萬古霉素TDM能顯著增加臨床有效率〔優勢比(odds ratio,OR)=2.62,95% 可信區間(95%confidence interval,95%CI)=1.34~5.11〕和降低腎毒性發生率(OR=0.25,95%CI=0.13~0.48)。因此,有必要開展萬古霉素TDM。本實驗旨在建立快速、準確、靈敏的高效液相色譜-串聯質譜法(high performance liquid chromatography-tandem mass spectrum,HPLC-MS/MS)測定人血清中萬古霉素的濃度。
1 材料與方法
1.1 藥品與儀器 萬古霉素標準品(純度:98%,批號:130360-201302,中國食品藥品檢定研究院提供);萬古霉素雜質C標準品(純度:95%,美國Standardpharm Chemical Technology公司提供;質控品,杭州佰勤醫療器械有限公司提供)。Waters Xevo TQ-S質譜儀(美國Waters公司產品);Waters Acquity UPLCI -Class液相系統(美國Waters公司產品);MassLynx V4.1數據采集系統;MS3旋渦混勻器(德國IKA公司產品);TGL-16離心機(湖南湘儀離心機儀器有限公司產品);BY-320A離心機(北京白洋醫療器械有限公司產品)。
1.2 測定條件
1.2.1 色譜條件 色譜柱:Acquity UPLC-C18 1.7 μm IVD 2.1 mm×50.0 mm,流動相A:含0.1%甲酸的水溶液,流動相B:含0.1%甲酸的甲醇溶液,流速0.5 mL/min,柱溫為 45 ℃,進樣量 2 μL。梯度洗脫程序(A:B):95:5(0~0.6 min),50:50(0.6~1.5 min),5:95(1.6~2.1 min),95:5(2.1~2.5 min)。
1.2.2 質譜條件 電噴霧離子源(electrospray ionization,ESI),正離子多反應監測(multiple-reaction monitoring,MRM)模式;毛細管電壓:3 kV;錐孔電壓:35 V;偏轉電壓:30 V;霧化氣溫度:500 ℃;霧化氣流量:1 000 L/Hr;反吹氣:150 L/Hr;碰撞氣流量:0.15 mL/min;各化合物監測條件:m/z 725.6→144.1(萬古霉素)和m/z 1 145.0→100.2(萬古霉素雜質C);碰撞能量:12 V(萬古霉素)和43 V(萬古霉素雜質C)。
1.3 溶液配制與樣品處理
1.3.1 萬古霉素溶液配制 取50 mg萬古霉素標準品于5 mL容量瓶,用50%甲醇水溶液溶解并定容,配置成濃度為10 g/L的萬古霉素儲備液。用空白血清依次稀釋萬古霉素儲備液,得到濃度分別為60.00、30.00、15.00、6.00、3.00和1.50 mg/L的萬古霉素血清標準溶液。另用空白血清依次稀釋萬古霉素儲備液,分裝每管100 μL,得到濃度分別為45.00、20.00和5.00 mg/L的萬古霉素血清質控品,置于-80 ℃冰箱保存。
1.3.2 內標溶液配制 取10 mg萬古霉素雜質C標準品于10 mL容量瓶,用50%甲醇水溶解并定容,配置成濃度為1.0 g/L的萬古霉素雜質C儲備液。取40 μL萬古霉素雜質C儲備液,加入20 mL乙腈,得到萬古霉素內標工作液,置于-80 ℃冰箱保存。
1.3.3 血清樣品處理 血清樣本在室溫下解凍,吸取 100 μL至 1.5 mL的 EP管中,加入 300 μL內標工作溶液,渦旋混勻5 min,于4 ℃以11 000 r/min(離心半徑5.5 cm)離心5 min,吸取上清液50 μL至1.5 mL潔凈聚丙烯塑料管中,加入450 μL純化水,渦旋混勻5 min,于4 ℃以11 000 r/min(離心半徑5.5 cm)離心5 min,吸取上清液100 μL于96深孔板中,進樣分析。
1.4 方法學考察
1.4.1 專屬性 分別取6份不同空白血清、萬古霉素血清標準品和血清質控品,按“血清樣品處理”項方法處理,進樣HPLC-MS/MS分析。
1.4.2 標準曲線與定量下限 分別取萬古霉素血清標準品,按“血清樣品處理”項方法處理,最低濃度標準品平行10個樣本,其余濃度標準品各平行3個樣本,進行HPLC-MS/MS分析。以待測物濃度為橫坐標(X),以待測物與內標峰面積比值為縱坐標(Y),用加權最小二乘法(Y=1/X)進行回歸計算。
1.4.3 精密度 分別取5.00、20.00和45.00 mg/L的萬古霉素血清質控品,按“血清樣品處理”項方法處理,每種濃度設6個平行樣本,在不同天數內連續制備并測定3批標本,進行HPLC-MS/MS分析,計算日內精密度和日間精密度。
1.4.4 回收率 同時分別取萬古霉素血清質控品,按“血清樣品處理”項方法處理,每種濃度平行6個樣本,進行HPLC-MS/MS分析,樣品實測濃度與理論濃度的比值即為回收率。
1.4.5 攜帶污染 分別取60 mg/L的萬古霉素血清標準品和空白血清各6個樣本,按“血清樣品處理”項方法處理,最高濃度萬古霉素血清標準品與空白血清間隔進樣,進行HPLC-MS/MS分析。空白血清中待測物峰面積與定量下限待測物峰面積相比計算待測物攜帶污染率,空白血清中內標峰面積與定量下限內標峰面積相比計算內標攜帶污染率。
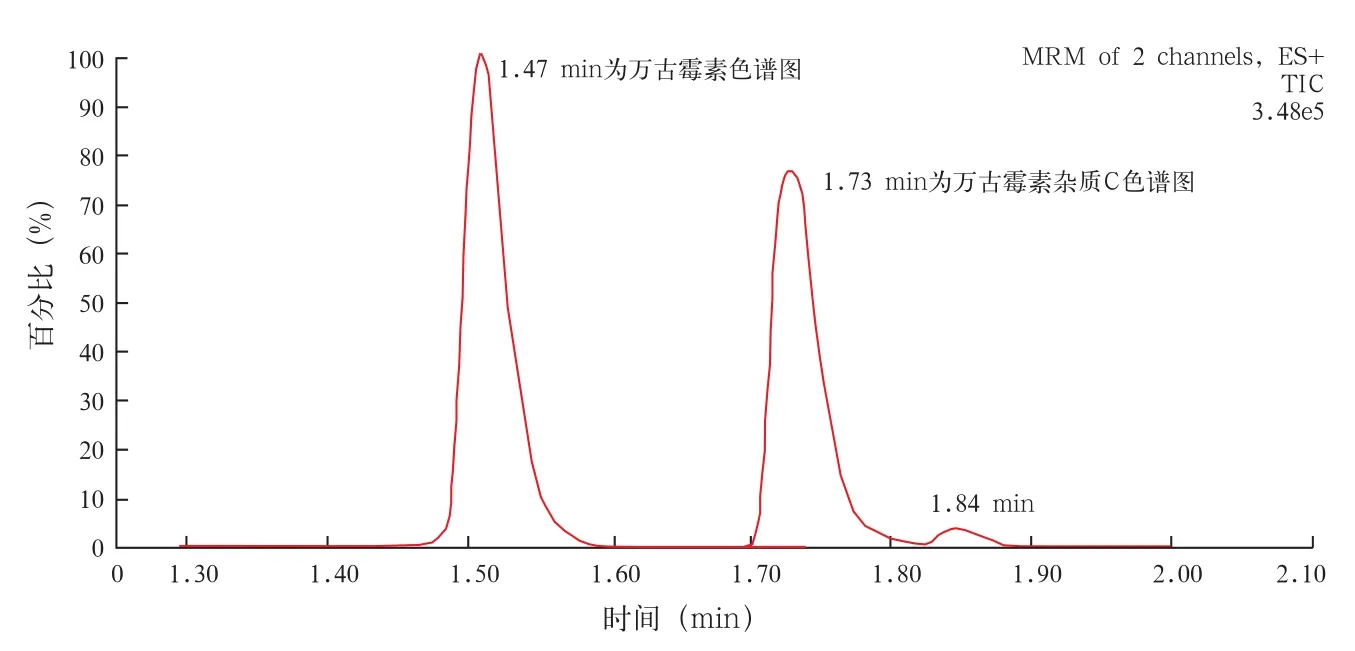
圖1 人血清中萬古霉素的色譜圖
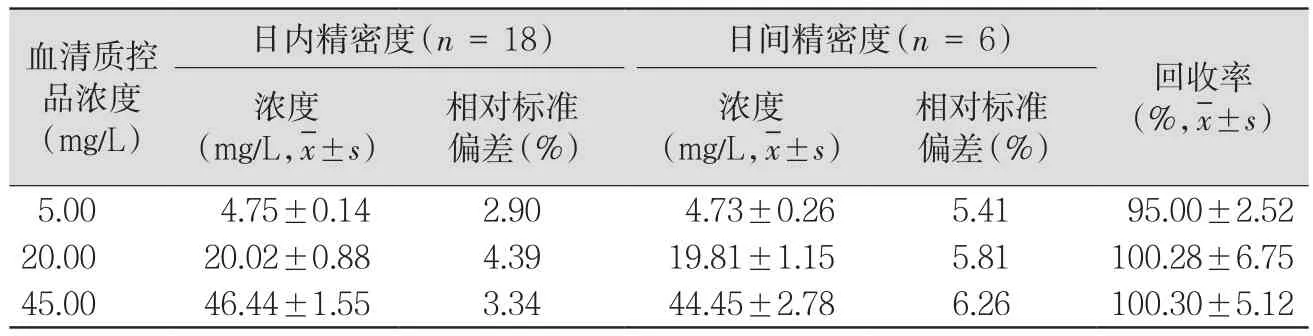
表1 人血清中萬古霉素的精密度及回收率
1.4.6 穩定性 分別取20.00 mg/L和45.00 mg/L的萬古霉素血清質控品各5份,分別考察血清樣本在室溫下放置12 h和24 h、經3次反復凍融、-80 ℃冰箱保存30 d的穩定性。
2 結果
2.1 方法學評價
2.1.1 專屬性 萬古霉素及內標的保留時間為1.47 min和1.73 min。見圖1。
2.1.2 標準曲線與定量下限 求得直線回歸方程A=2.12×10-1C+2.29×10-3(r=0.999 2)。萬古霉素的血清濃度在1.5~60.0 mg/L內線性關系良好,定量下限為1.5 mg/L。
2.1.3 精密度與回收率 萬古霉素高、中、低3個濃度的日內標準偏差和日間標準偏差均小于10%,回收率均達到80%以上。見表1。
2.1.4 攜帶污染 空白樣本萬古霉素峰面積殘留小于定量下限萬古霉素峰面積的20%,每個空白樣本萬古霉素雜質C內標峰面積殘留小于定量下限內標峰面積的5%。
2.1.5 穩定性 萬古霉素在室溫放置12 h和24 h、經3次反復凍融、-80 ℃冰箱保存30 d的穩定性良好,精密度均小于15%。
2.2 方法學應用 測定本院住院接受萬古霉素治療至少4個劑量以上的5例患者穩態血藥谷濃度(下一劑量前0.5 h非輸液側采靜脈血2 mL)。萬古霉素血藥谷濃度應控制在10~20 mg/L,對復雜性感染(包括由MRSA引起的心內膜炎、骨髓炎、腦膜炎、醫院獲得性肺炎等),萬古霉素血藥谷濃度應達到15~20 mg/L,以保證達到治療目標和提高臨床有效率[4]。5例患者萬古霉素血藥谷濃度分別為 10.98、10.07、4.16、14.43和13.62 mg/L。
3 討論
本試驗在血清蛋白沉淀劑方面比較了乙腈和甲醇沉淀蛋白對萬古霉素峰形和響應的影響,結果顯示,甲醇沉淀蛋白后采用等比純水稀釋會發生高濃度離子抑制現象,故選定乙腈作為蛋白沉淀劑用純水稀釋后進樣,這與胡偉等[5]研究結果較為一致。萬古霉素的內標選擇萬古霉素醫藥中間體雜質C,內標專屬性強于用其他抗菌藥物作為內標,大大降低了檢測的假陽性率[6]。本研究建立了一種靈敏度高、簡便快速和選擇性好的HPLC-MS/MS分析方法,極大簡化了操作流程,適用于萬古霉素的大批量血藥濃度監測。從臨床樣本萬古霉素血藥濃度監測的結果看,萬古霉素的谷濃度存在顯著的個體差異,因此基于谷濃度調整萬古霉素給藥方案具有顯著的臨床意義。

