耐碳青霉烯粘質沙雷菌耐藥基因及分子流行病學研究
袁 園, 陳繼中, 潘亞萍, 徐元宏, 王中新
粘質沙雷菌(Serratiamarcescens,SM)是兼性厭氧革蘭陰性桿菌,屬腸桿菌科沙雷菌屬,是一種廣泛分布于自然界和醫院環境中的條件致病菌。該菌可在人體抵抗力下降、外科手術、輸血、創傷、侵入性操作等條件下導致包括肺部感染、泌尿系感染、血流感染及創口感染等,并有可能導致院內感染的爆發流行。碳青霉烯類抗生素是一類對超廣譜β-內酰胺酶和頭孢菌素酶穩定的超廣譜、抗菌活性極強的非典型β-內酰胺抗生素。因其具有高滲透性、低毒性、快速殺菌效果而被臨床廣泛使用。根據2015~2017年中國細菌耐藥監測網(CHINET)細菌耐藥性監測報告[1-3]可知,碳青霉烯類耐藥粘質沙雷菌的臨床分離率和耐藥率都在逐步上升,產碳青霉烯酶是其主要的耐藥機制[4]。該研究主要針對碳青霉烯耐藥粘質沙雷菌的耐藥表型和碳青霉烯酶基因的攜帶情況進行探究,同時分析耐藥菌的同源性,為臨床抗感染治療和院內感染防控提供參考。
1 材料與方法
1.1菌株來源收集2014年1月~2017年12月安徽醫科大學第一附屬醫院檢驗科微生物室分離的對碳青霉烯類抗生素耐藥(亞胺培南、厄他培南、美羅培南中任一藥物耐藥)的粘質沙雷菌,剔除同一患者相同部位重復分離株后,共獲得67株作為實驗樣本。質控菌株為肺炎克雷伯菌(ATCC BAA-1705、ATCC BAA-1706)和大腸埃希菌(ATCC 25922)。
1.2主要儀器與試劑
1.2.1主要儀器 Vitek-2 Compact全自動微生物鑒定分析儀、MALDI-TOF-MS基質輔助激光解吸電離飛行時間質譜儀、麥氏比濁儀(法國梅里埃生物公司);Biometra基因擴增儀(德國Biometra公司);電泳儀(上海天能科技公司);紫外線凝膠成像系統(美國Bio-Rad公司);高速低溫離心機(德國Eppendorf公司);NanoDrop one微量紫外-可見分光光度計(美國賽默飛公司)。
1.2.2主要試劑 儀器配套GN鑒定卡和GN13藥敏卡(法國梅里埃生物公司);Muller-Hinton瓊脂、藥敏紙片(英國Oxoid公司);血平板和MH平板(合肥天達診斷試劑公司);亞胺培南西司他丁鈉(杭州默沙東制藥公司);瓊脂糖(法國BIOWEST公司);細菌蛋白抽提液(美國賽默飛公司);6×Loading buffer、Premix Taq(日本TaKaRa公司);酚紅粉末、ZnSO4·7H2O、NaOH、HCl、50×TAE、引物、核酸染料、DNA Marker DL2000(上海生工生物公司)。
1.3細菌鑒定與藥敏試驗
1.3.1細菌鑒定 采用Vitek-2 Compact全自動微生物鑒定分析儀進行,使用MALDI-TOF-MS質譜儀進行細菌鑒定的復核,以確保入選菌株的準確性。
1.3.2藥敏試驗 采用2017年美國臨床和實驗室標準化協會(clinical and laboratory standards institute,CLSI)推薦的最低抑菌濃度(minimum inhibitory concentration,MIC)法或紙片擴散法(kirby-bauer,K-B法)進行并判讀結果[5],MIC范圍不能滿足CLSI折點判斷要求的藥物,采用紙片擴散法測定。
1.4碳青霉烯酶表型篩選
1.4.1改良碳青霉烯類滅活試驗(modified carbapenem inactivation method,mCIM) 按CLSI 2017推薦的方法進行,用1 μl接種環挑取血平板上培養過夜的菌落,加入2 ml/管的胰蛋白胨大豆肉湯(TSB)中,渦旋震蕩混勻10~15 s。每管中加入1片10 μg美羅培南紙片后,放入(35±2) ℃的CO2培養箱中,孵育4 h±15 min。在完成TSB-美羅培南紙片菌懸液孵育前后,立即用生理鹽水制備大腸埃希菌ATCC 25922的0.5麥氏濃度標準菌液。將菌液在15 min內完成MHA瓊脂平板的涂布,干燥3~10 min。將美羅培南紙片用10 μl接種環取出,并注意貼壁擠壓,擠去多余水分后貼在MHA平板上。倒置放入(35±2) ℃的CO2培養箱中,培養18~24 h,測量抑菌圈直徑。結果判讀:① 碳青霉烯酶陽性:抑菌圈6~15 mm或16~18 mm但圈內有散在菌落;② 碳青霉烯酶陰性:抑菌圈≥19 mm,不論圈內有無菌落;③ 中性結果:抑菌圈16~18 mm,需檢查ATCC 25922純度,檢查美羅培南質控,重復mCIM,或檢測碳青霉烯酶基因。陽性和陰性質控菌株,分別使用肺炎克雷伯ATCC BAA-1705/ATCC BAA-1706,同時加做空白對照。
1.4.2Carba NP試驗 按CLSI 2015推薦的方法進行,配制A液:在50 ml容器中,分別加入16.6 ml實驗室試劑用水、2 ml的0.5%酚紅溶液、180 μl的10 mmol/L硫酸鋅溶液,用0.1 mol/L的NaOH溶液或10%的HCl溶液調整pH值至7.8±0.1,4~8 ℃避光保存,2周內有效。配制B液:稱取亞胺培南西司他丁鈉藥粉(以亞胺培南有效成分計),每毫升A液加入6 mg亞胺培南,4~8 ℃儲存,3 d內有效。待測菌株、質控菌株、空白對照各取兩只微量離心管分別標記為A、B,每管加入100 μl細菌蛋白抽提液。菌株在血平板上培養過夜,用1 μl接種環取1環加入各管中(空白對照不加),旋渦振蕩器振搖混勻。A管中加入100 μl A液,B管中加入100 μl B液,再次震蕩混勻,放入(35±2) ℃培養箱中,孵育2 h后觀察結果。結果判讀,碳青霉烯酶陽性:A管紅色、B管黃色/橙色;碳青霉烯酶陰性:A管紅色、B管紅色;無效結果:A、B兩管皆為黃色/橙色。質控菌株同1.4.1。
1.4.3改良Hodge試驗(modified hodge test,MHT) 按CLSI 2012推薦的方法進行,美羅培南抑菌圈邊緣與待測菌株或質控菌株劃線交叉處,出現增強性(矢狀)生長為產碳青霉烯酶陽性,反之為陰性。質控菌株同1.4.1。
1.5引物合成耐藥基因引物和腸桿菌科細菌基因重復序列(Enterobacterialrepetitive intergenic consensus,ERIC)引物由生工生物工程(上海)有限公司合成,序列及參考文獻見表1。

表1 PCR引物序列及擴增片段長度
1.6提取細菌DNA模板取血平板上培養過夜的菌落,用滅菌水調至成2.0麥氏濃度的菌懸液。取1 ml置于1.5 ml微量離心管中,100 ℃金屬浴10 min,然后立即冰浴10 min。使用高速低溫離心機12 000 r/min離心5 min,取上清液。使用NanoDrop one微量紫外-可見分光光度計檢測模板濃度和純度,確保A260/A280比值在1.8~2.0,-20 ℃冷凍保存。
1.7PCR擴增耐藥基因與測序PCR反應體系總體積設置50 μl,其中包含:Premix Taq試劑25 μl,引物F(10 μmol/L)1 μl,引物R(10 μmol/L)1 μl,待測菌株DNA模板4 μl,雙蒸水19 μl。PCR反應溫度程序:95 ℃預變性5 min;95 ℃變性30 s、55 ℃退火30 s、72 ℃延伸1 min,共35個循環;72 ℃延伸8 min,4 ℃保存待電泳。不同的碳青霉烯酶基因,其PCR反應條件略有差異,主要是退火溫度和延伸時間不同,通過預實驗摸索確定。配制1.2%的瓊脂糖凝膠,對PCR擴增產物進行電泳,紫外線凝膠成像系統觀察結果并保存圖片。委托生工生物工程(上海)有限公司進行PCR擴增產物測序,基因序列經NCBI網站BLAST程序進行比對,以確定是否為目的基因及其分型。
1.8ERIC-PCR同源性分析PCR反應體系設置和1.7相同,PCR擴增條件:95 ℃預變性5 min;95 ℃變性1 min、35 ℃退火1 min、72 ℃延伸3 min,進行20個循環;95 ℃變性1 min、42 ℃退火1 min、72 ℃延伸3 min,進行30個循環;72 ℃最終延伸10 min,并結合實際略做修改[10]。配制1.8%瓊脂糖凝膠,將擴增產物在電壓100 V的條件下電泳100 min,紫外線凝膠成像系統觀察結果并保存圖片。基因型判斷依據:同一基因型,電泳條帶應完全相同;同一基因的亞型,電泳條帶相差1~2條;不同基因型,條帶相差3條以上[8]。
1.9統計學處理采用WHONET 5.6軟件對K-B法的抑菌圈直徑,自動化儀器的MIC藥敏結果和樣本種類進行統計分析。
2 結果
2.1樣本來源基本情況患者年齡14~100(60±20.95)歲,其中男50例(74.63%)、女17例(25.37%)。樣本種類以痰液最多,共51份,占76.12%;尿液7份、分泌物3份、血液2份,胸腹水、腦脊液、導管、留置針各1份。分離自ICU 28株、干部二科ICU 12株、神經外科8株,此三科室占71.64%;其他科室也有分離,見表2。

表2 67株耐碳青霉烯粘質沙雷菌的病區分布
2.2藥敏試驗結果及分析此次分離的67株耐碳青霉烯粘質沙雷菌,呈多重耐藥特征。其中對頭孢噻肟、頭孢曲松100%耐藥;對亞胺培南、美羅培南、厄他培南、氨曲南耐藥率分別為94.03%、95.52%、98.51%、97.01%;對環丙沙星、慶大霉素、妥布霉素、哌拉西林/他唑巴坦、頭孢他啶、頭孢吡肟、左氧氟沙星耐藥率較高,均大于60%;對阿米卡星和復方新諾明耐藥率分別為5.97%和7.46%,見表3。
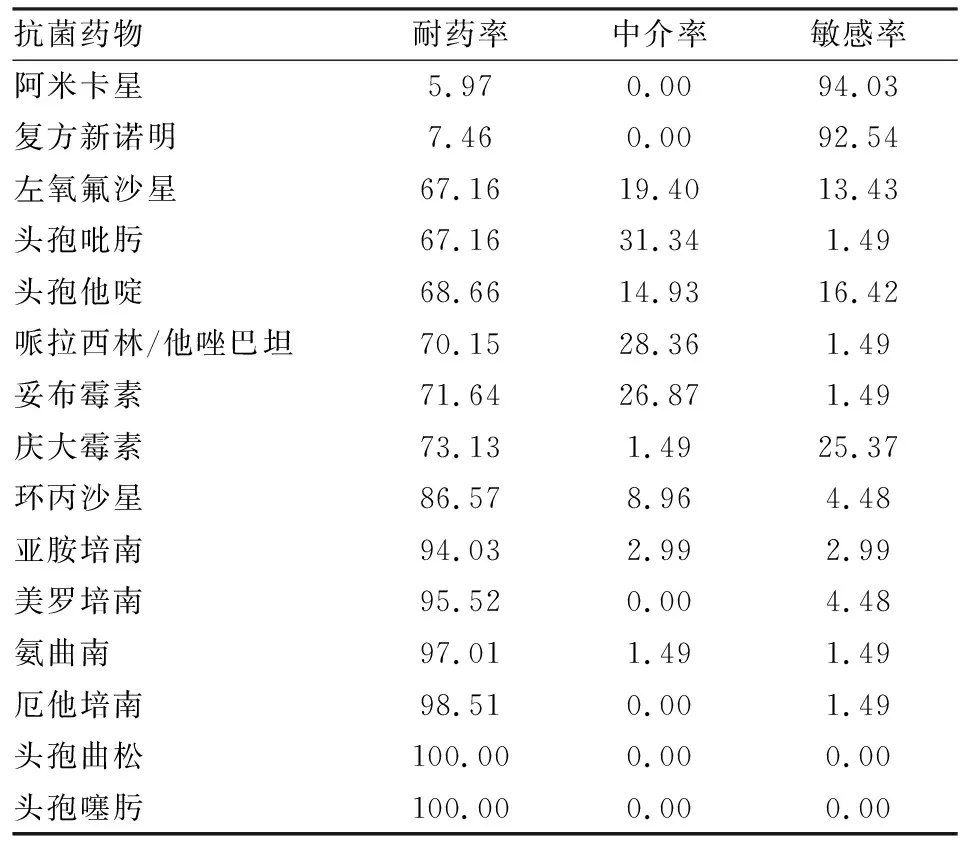
表3 67株耐碳青霉烯粘質沙雷菌對常見藥物耐藥情況(%)
2.3碳青霉烯酶表型檢測結果
2.3.1mCIM mCIM結果顯示67株待測菌株中,陽性62株,陰性5株(陰性樣本號:15、16、17、24、56),陽性率92.54%,部分結果解析如圖1所示。
2.3.2Carba NP試驗 Carba NP試驗結果顯示67株待測菌株中,陽性60株,陰性7株(陰性樣本號:15、16、17、21、24、27、56),陽性率89.55%,部分結果解析如圖2所示。

圖1 部分mCIM試驗結果
陽性對照:肺炎克雷伯菌 ATCC BAA-1705;陰性對照:肺炎克雷伯菌 ATCC BAA-1706

圖2 部分Carba NP試驗結果
陽性對照:肺炎克雷伯菌 ATCC BAA-1705;陰性對照:肺炎克雷伯菌 ATCC BAA-1706
2.3.3MHT結果 67株待測菌株中,陽性61株,陰性6株(陰性樣本號:15、16、17、24、27、56),陽性率91.04%,部分結果解析如圖3所示。

圖3 部分MHT試驗結果
陽性對照:肺炎克雷伯菌 ATCC BAA-1705;陰性對照:肺炎克雷伯菌 ATCC BAA-1706
2.4耐藥基因PCR擴增結果67株碳青霉烯耐藥粘質沙雷菌中,41株檢出碳青霉烯酶基因,檢出率為61.19%,其中檢出含blaKPC基因32株,含blaOXA-23組基因7株,含blaOXA-51組基因7株,含blaGES基因3株,含blaOXA-58組基因1株,其中有8株細菌同時含有多種耐藥基因。耐藥基因blaIMI、blaNMC、blaSME-IRS、blaNDM、blaVIM、blaIMP、blaOXA-48、blaOXA-24組均未檢出。基因分布情況見表4,部分陽性基因擴增電泳見圖4。

表4 67株耐碳青霉烯粘質沙雷菌的耐藥基因分布(%)

圖4 部分blaKPC陽性基因電泳圖
M:DL2000 DNA Maker;1~8、13~15:陽性樣本,在882 bp處出現條帶;9~12:陰性樣本;16:陰性對照;17:陽性對照
2.5ERIC-PCR基因分型67株耐碳青霉烯的粘質沙雷菌可分為8個型別(以A~H表示),其中A型50株為最多,B型5株,C型5株,D型3株,E型、F型、G型、H型各1株。見圖5。

圖5 部分菌株的ERIC-PCR基因分析圖譜
M:Maker;1、2、3、4、5、7、8、9、10、11、13、14、15:A型;6:B型;12:E型;16:F型;17:G型
3 討論
粘質沙雷菌占腸桿菌科沙雷菌屬的90%,因其在自然界中的廣泛分布且毒力較低,而一度被認為是無害的非致病菌。然而,近年來該菌在臨床感染患者中的分離率逐步升高,隨著臨床對碳青霉烯類抗菌藥物的廣泛應用,耐碳青霉烯類的粘質沙雷菌檢出率也在同步升高。根據2015、2016、2017年CHINET全國細菌耐藥監測報告[1-3]可知,沙雷菌屬的臨床分離率分別為1.08%、1.16%、1.22%,對亞胺培南、美羅培南和厄他培南的耐藥率分別由2016年的4.2%、4.1%和3.8%上升到2017年的5.5%、4.6%和5.3%,分離率和耐藥率都呈現出穩步提高的趨勢。2015年該院粘質沙雷菌對亞胺培南和美羅培南的耐藥率分別為13.7%和17.6%[11],顯著高于全國平均水平,耐藥情況更加嚴重。
該研究中67株細菌標本類型以痰液為主,說明粘質沙雷菌在各種因素所導致的人體免疫力降低時,主要引起呼吸系統感染。分離科室以ICU為主,說明患者嚴重基礎疾病、接受大手術、使用呼吸機、氣管切開、侵入性檢查以及大劑量、長時間的使用相關抗生素可能是引起粘質沙雷菌感染的高危因素,這與田磊 等[12]研究一致。
藥敏結果顯示,67株耐碳青霉烯粘質沙雷菌呈多重耐藥特征,其中對頭孢噻肟、頭孢曲松100%耐藥;對亞胺培南、美羅培南、厄他培南、氨曲南耐藥率大于90%;對環丙沙星、慶大霉素、妥布霉素、哌拉西林/他唑巴坦、頭孢他啶、頭孢吡肟、左氧氟沙星耐藥率較高,均大于60%;僅對阿米卡星和復方新諾明保持高度敏感,耐藥率分別為5.97%和7.46%。提示在此類細菌感染嚴重,可選抗生素有限的情況下,阿米卡星或復方新諾明可以作為首選藥物進行治療。與全國數據相比[13],本研究67株細菌對哌拉西林/他唑巴坦、頭孢他啶、頭孢吡肟、厄他培南、環丙沙星的耐藥率顯著高于全國平均水平,頭孢噻肟、亞胺培南、美羅培南、慶大霉素藥敏結果和全國數據相對一致,而阿米卡星和復方新諾明耐藥率則顯著低于全國水平。這可能與不同醫院所收治患者的病情、病種、年齡、醫院的診療水平以及臨床醫師的用藥習慣不同有關。
粘質沙雷菌對碳青霉烯類抗菌藥物的耐藥機制復雜,最主要的是攜帶碳青霉烯酶基因,并產生能直接滅活碳青霉烯類藥物的碳青霉烯酶[14]。按照Ambler分子結構不同,可將碳青霉烯酶分為A、B、D三類:A類在體外可以被克拉維酸和他唑巴坦抑制水解活性,主要包括KPC、SME、NmcA/IMI、GES、PER等;B類因為可以被EDTA等金屬離子螯合劑抑制而又稱為金屬酶,主要包括NDM、VIM、IPM、SPM、GIM、SIM;D類又稱OXA酶,不能被酶抑制劑和EDTA所抑制,對碳青霉烯類藥物的水解活性較弱,主要包括OXA-23組、OXA-24組、OXA-51組、OXA-58組等;碳青霉烯酶基因可借助移動基因元件,如質粒、整合子、轉座子等進行細菌間的傳播。
該研究從67株碳青霉烯耐藥粘質沙雷菌中,檢出blaKPC、blaGES、blaOXA-23組、blaOXA-51組、blaOXA-58組基因,其中以blaKPC型(32株)最多,占47.76%。值得關注的是,有8株細菌同時攜帶多種基因,以blaOXA-23+blaOXA-51型最多(4株),blaKPC+blaOXA-23(2株)、blaGES+blaOXA-51(1株)次之,仍有1株同時包含blaKPC+blaOXA-51+blaOXA-58三種基因型,呈現出多基因聯合共存現象,可見本院耐碳青霉烯粘質沙雷菌耐藥情況相當嚴重。
MHT、Carba NP、mCIM分別是CLSI 2009、2015、2017年陸續推薦的用于檢測對一種或幾種碳青霉烯類抗生素不敏感腸桿菌科細菌的表型檢測方法,分別有各自的優勢和局限性[5]。本研究中MHT、Carba NP、mCIM三種表型試驗對67株耐碳青霉烯粘質沙雷菌的陽性率分別為91.04%、89.55%、92.54%。本研究中所有blaKPC基因陽性菌株的MHT、Carba NP試驗、mCIM試驗都是陽性,說明三種表型試驗對于KPC酶敏感性較高。3株blaGES基因陽性菌株中2株表型試驗全陰,僅1株mCIM試驗陽性,推測對于GES酶而言mCIM試驗敏感性相對更高。7株blaOXA-23基因陽性菌株中4株表型試驗全陽性,2株表型試驗全陰,1株Carba NP試驗陰性,MHT和mCIM試驗陽性。在blaOXA-51基因陽性的7株細菌中,2株與表型試驗完全符合,4株與表型試驗完全不符,1株Carba NP試驗陰性,MHT和mCIM試驗陽性。僅有的1株blaOXA-58基因陽性菌株三種表型試驗均為陰性。OXA類酶表型試驗整體陽性率不高,符合該類酶對碳青霉烯類藥物水解活性弱的特點。另外有26株細菌三種表型試驗均為陽性,而基因檢測全陰性,可能是產生了其他碳青霉烯酶,或者因為藥物相關外膜孔蛋白缺失或下調,伴/不伴有β內酰胺酶(ESBLs、AmpC等)的表達[15],這將是未來進一步的研究方向。
ERIC是腸桿菌科細菌所特有的,針對該序列設計引物進行PCR擴增,可以得到一系列大小不同的DNA片段,電泳后形成條帶數量、位置、亮度不同的DNA指紋圖譜,從而可在分子水平對細菌進行鑒定和同源性分析。該研究中67株耐碳青霉烯的粘質沙雷菌經ERIC-PCR分析,可分為8個型別(以A~H表示),其中A型(50株)為主要流行株,提示該院可能存在A型克隆株的流行。因細菌耐藥基因可借助質粒等可移動基因元件進行交叉傳播,造成院內感染的暴發流行,所以必須引起重視,加強手衛生消毒,減少患者不必要的床位更換和科室間轉診。
綜上所述,該院耐碳青霉烯類粘質沙雷菌檢出率高,耐藥情況嚴重,耐藥機制復雜,耐藥基因聯合共存,同種克隆集中趨勢明顯,有引起院內感染大規模流行的可能,給臨床治療帶來嚴峻挑戰。應引起高度重視,加強細菌耐藥性監測,科學合理使用抗菌藥物,做好院內感染防控工作,以求最大限度減少此類耐藥菌的出現和傳播。

