葡萄酒釀造過程中不同工藝參數對生物胺含量的影響
王 瑞,董 榮,喬 丹,李 倩,張 軻,張珍珍
(新疆農業大學食品科學與藥學學院,新疆烏魯木齊830052)
新疆光熱資源豐富,晝夜溫差大,十分適宜釀酒葡萄的生長,新疆與美國加州和法國波爾多并稱為“世界上適宜葡萄栽培的三大黃金地區”,新疆的葡萄酒產業現已成為十分具有發展潛力的朝陽產業[1]。葡萄酒發酵過程中會產生甲醇、生物胺、雜醇油等發酵副產物,而這些發酵副產物會嚴重影響葡萄酒的品質和質量安全,危害人體健康[2-3]。生物胺是氨基酸脫羧或醛類物質由氨基酸轉氨酶轉氨作用而形成,其廣泛存在于發酵食品中[4]。雖然生物胺在人體代謝過程中發揮著重要的作用,但它同時也會引起頭痛、心悸等過敏反應[5-6]。生物胺在人體細胞中會被某些酶促代謝降解,但酒精會抑制這些酶的活性,使得脫毒效率降低。其中,組胺和酪胺被認為是對人體危害最大的生物胺,一些國家已經對葡萄酒中組胺含量做出了限定標準[7-9],例如:澳大利亞、瑞士限量范圍為≤10 mg/L,比利時為≤5~6 mg/L,法國為≤8 mg/L。腐胺和尸胺等雖然不能直接導致中毒,但它們能與其余幾種生物胺協同作用,增強中毒癥狀。目前,生物胺的檢測方法有多種多樣,主要有生物傳感器、毛細管電泳、薄層色譜以及高效液相色譜法等[10]。本實驗以新疆地產的釀酒葡萄為試材,以釀造過程工藝參數為切入點,分析在葡萄酒釀造、貯存過程中各因素對生物胺產生積累的影響,闡明葡萄酒生產及貯存過程中生物胺形成的關鍵控制點。為控制新疆地產葡萄酒中生物胺的含量,消除葡萄酒潛在安全隱患,促進新疆傳統葡萄酒行業得到健康發展提供理論依據。
1 材料與方法
1.1 材料與試劑
2017年新疆瑪納斯地產赤霞珠葡萄(Cabernet Sauvignon);丙酮、甲醇、色胺、苯乙胺、酪胺、組胺、腐胺、尸胺、亞精胺、精胺、丹磺酰氯(均為色譜純),美國Sigma公司;氯化鈉、乙醚、氯仿、正丁醇(均為分析純),南京化學試劑股份有限公司;酵母Ⅰ(L2323)、酵母Ⅱ(B0213)、酵母Ⅲ(RC212),乳酸菌Ⅰ、乳酸菌Ⅱ、乳酸菌Ⅲ,法國Lallemand公司。
1.2 儀器與設備
1200 Series高效液相色譜儀(high performance liquid chromatograph,HPLC),美國 Agilent公司;CT-6020A酸度計,深圳市柯迪達電子有限公司;PL303電子天平,梅特勒-托利多儀器(上海)有限公司;D2155W離心機,美國Sigma公司;HS120210漩渦儀,美國Heathrow Vortexer公司;0.22 μm孔徑有機相濾膜,上海安普科學儀器有限公司。
1.3 試驗方法
1.3.1 葡萄酒傳統釀造工藝流程
原料→分選→除梗破碎→添加SO2→活化酵母→添加酵母→22~25℃酒精發酵→皮渣分離→10 d后澄清→取樣→-40℃冷藏
1.3.2 樣品前處理
向10 mL的葡萄酒樣品中添加NaCl至飽和,待樣品飽和后,取上清液5 mL置于離心管中。將其pH值調節為12后,加入5 mL正丁醇∶氯仿(1∶1,v/v)萃取并振蕩,在3600 r/min的條件下離心10 min,吸取上層清液。重復萃取過程2次后量取3 mL萃取液,加入0.3 mL HCl(1 mol/L),振蕩混合后氮氣吹干,加入1 mL HCl(0.1 mol/L)溶解,樣品待衍生。
1.3.3 生物胺標準溶液的配制
用0.1 mol/L的HCl將各生物胺標準品溶解,配制成濃度為100 mg/L的標準貯備液,液體保存于4℃條件下。將8種生物胺單組分標準貯備液各取1 mL,共同置于10 mL的容量瓶中,用0.1 mol/L HCl定容,配成生物胺混合標準溶液。最后分別移取0.10 mL、0.25 mL、0.50 mL、1.00 mL、1.50 mL、2.50 mL、5.00 mL上述溶液于10 mL容量瓶后定容,配制成質量濃度為1.00 mg/L、2.50 mg/L、5.00 mg/L、10.0 mg/L、15.0 mg/L、25.0 mg/L、50.0 mg/L的標準溶液。
1.3.4 標準品及樣品的衍生
取上述生物胺標準溶液0.5 mL,加入1 mL丹磺酰氯,1.5 mL飽和碳酸氫鈉,60℃下避光反應30 min,再加入100 μL谷氨酸鈉溶液混合均勻,60℃條件下反應15 min。反應結束后,各加入1 mL超純水,混勻,40℃下氮氣吹去丙酮。最后加入乙醚進行萃取,并重復萃取2次,合并乙醚萃取液,40℃條件下氮氣吹干后,用1 mL色譜純甲醇進行溶解,后將試樣過0.22 μm濾膜,濾液待檢測。樣品衍生過程同上。
1.3.5 高效液相色譜條件
色譜條件:流動相A為甲醇,B為超純水,梯度洗脫,C18色譜柱,柱溫30 ℃,進樣量為20 μL,檢測波長254 nm,流速1.5 mL/min,洗脫程序見表1。
2 結果與分析
2.1 不同類型及接種量酵母對葡萄酒中生物胺含量的影響(圖1)
在葡萄酒的釀造過程中酵母菌起著至關重要的作用,這其中不僅有野生酵母的參與,商業酵母更是廣泛應用于釀造生產中[11]。本研究依照傳統釀造工藝,研究比較3種不同商業酵母及接種量對葡萄酒中生物胺含量的影響,結果見圖1。由圖1可以看出,當接種不同類型酵母時,葡萄酒中生物胺含量存在明顯差異,其中,當接種酵母Ⅰ時,葡萄酒中尸胺和亞精胺含量顯著高于接種其他兩種酵母的葡萄酒,在1%水平下差異極顯著。而精胺、色胺和組胺含量則明顯低于接種酵母Ⅱ和酵母Ⅲ,說明酵母對葡萄酒中生物胺的形成有一定的影響,且生物胺的形成較為復雜。當酵母類型相同,接種量不同時,葡萄酒中的生物胺含量也有差異。酵母接種量為400 mg/L時,除苯乙胺外,生物胺含量略高于接種量為200 mg/L酵母,但差異較小。說明酵母接種量對生物胺含量的影響小于酵母類型對生物胺含量的影響。

表1 梯度洗脫程序
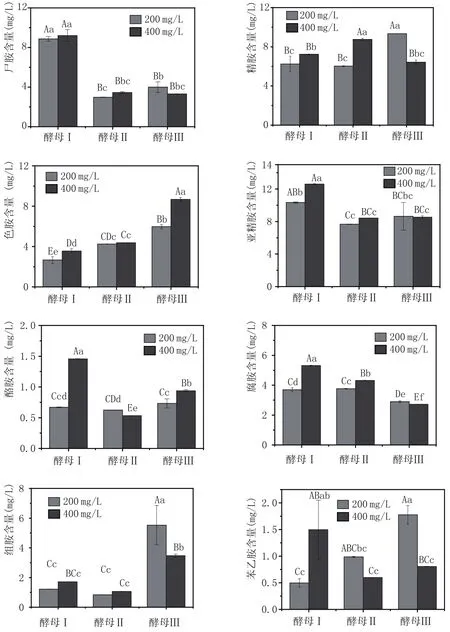
圖1 接種不同類型及接種量的酵母對葡萄酒中生物胺含量的影響
2.2 不同的發酵溫度對葡萄酒中生物胺含量的影響(圖2)
發酵溫度影響著葡萄酒中微生物的生長繁殖,本部分主要研究了當發酵溫度分別為18℃、22℃和26℃時對葡萄酒中生物胺含量的影響,結果見圖2。由圖2可知,葡萄酒中苯乙胺、色胺和精胺含量在發酵溫度為22℃時較高。而腐胺、尸胺、組胺、酪胺和亞精胺含量則隨著發酵溫度的升高而減少,且不同發酵溫度條件下,各生物胺含量在1%條件下差異不顯著,說明葡萄酒釀造過程中發酵溫度對生物胺含量的影響較小,不是影響生物胺含量的關鍵因素。
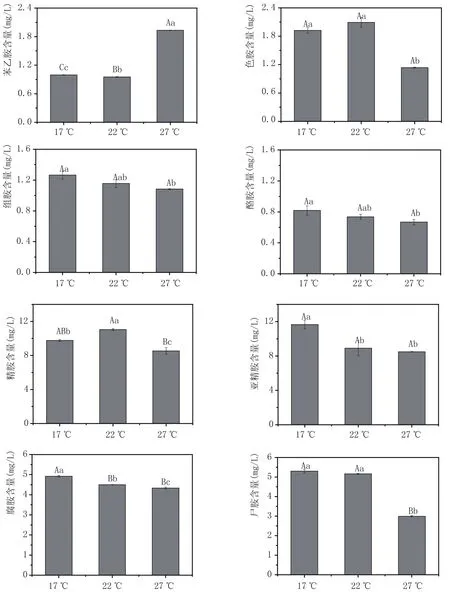
圖2 不同的發酵溫度對葡萄酒中生物胺含量的影響
2.3 不同類型乳酸菌及接種量對葡萄酒中生物胺含量的影響(圖3)
乳酸菌是進行MLF的主要微生物,具有一定的氨基酸脫羧酶活性,有研究認為,乳酸菌會影響葡萄酒中的生物胺含量[12-14]。本研究主要對比了在相同發酵條件下,不同類型乳酸菌及接種量對葡萄酒中生物胺含量影響,結果見圖3。由圖3可以看出,乳酸菌類型對葡萄酒中生物胺含量有一定影響,當接種同類型的乳酸菌時,乳酸菌接種量越大,葡萄酒中生物胺含量越高。當接種10 mg/L乳酸菌時,葡萄酒中生物胺含量顯著低于接種20 mg/L乳酸菌時的生物胺含量。同時,當接種同等量不同類型的乳酸菌,接種乳酸菌Ⅲ時,葡萄酒中生物胺含量較高。因為本研究采用的是相同基質的葡萄酒為樣品,所以造成以上差異的原因可能是乳酸菌中氨基酸脫羧酶活性的差異。
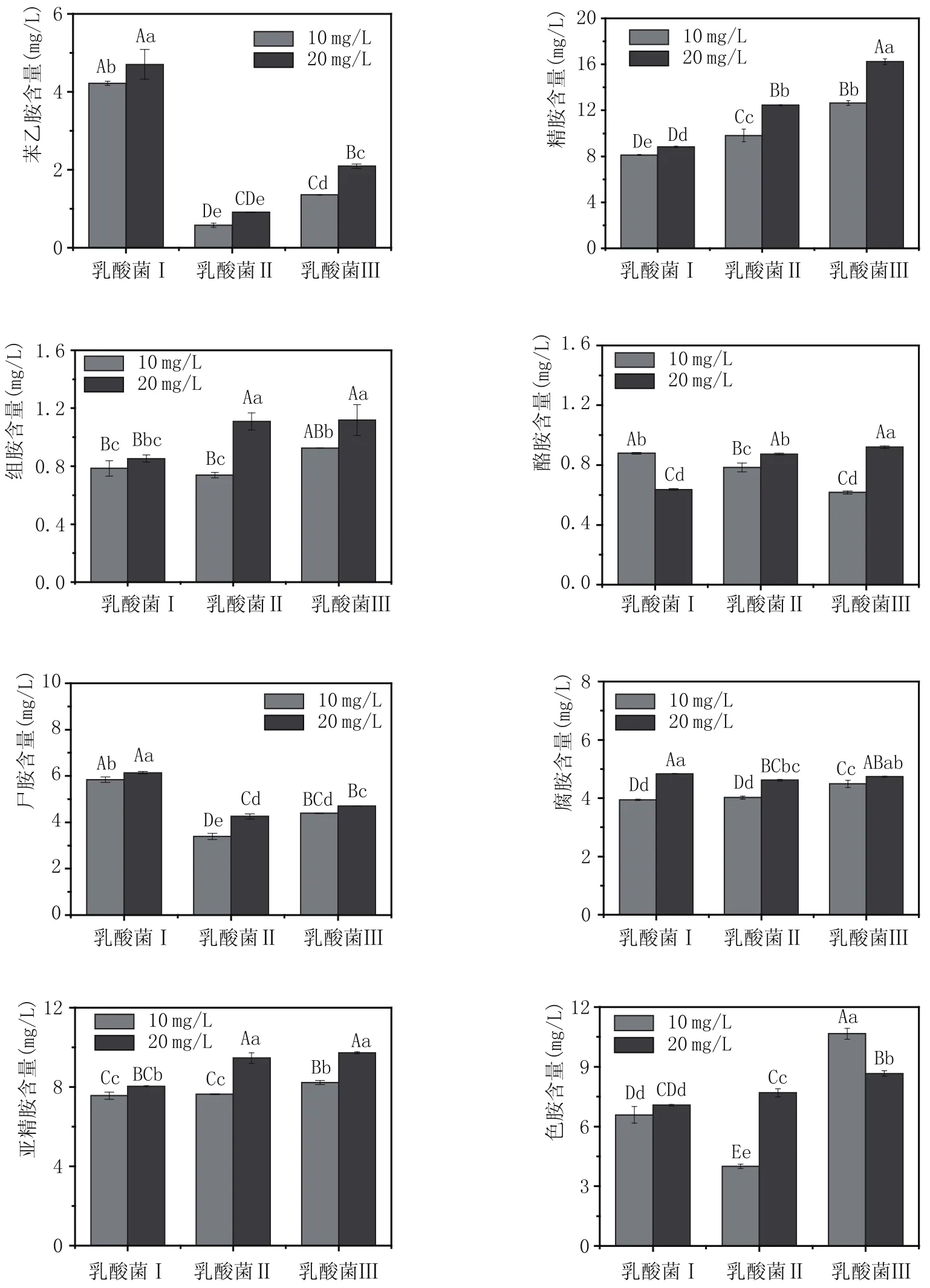
圖3 不同類型乳酸菌及接種量對葡萄酒中生物胺含量的影響
2.4 氨基酸脫羧酶對葡萄酒中生物胺含量的影響
輔酶5’磷酸吡哆醛是氨基酸脫羧酶的輔酶,能夠增加氨基酸脫羧酶的活性[15]。為了進一步證明氨基酸脫羧酶活性對生物胺的影響,本實驗以其中一個傳統發酵工藝為空白對照組,另一個為處理樣,即添加能提高氨基酸脫羧酶活力的輔酶5’磷酸吡哆醛0.05 g/L,結果見表2。由表2可看出,與空白對照組相比較,添加輔酶5’磷酸吡哆醛的葡萄酒中,生物胺含量有所提高,生物胺總含量由27.165 mg/L上升至29.061 mg/L,其中尸胺和腐胺含量上升的趨勢最為明顯,可以說明,氨基酸脫羧酶活性是影響生物胺含量的關鍵因素之一。
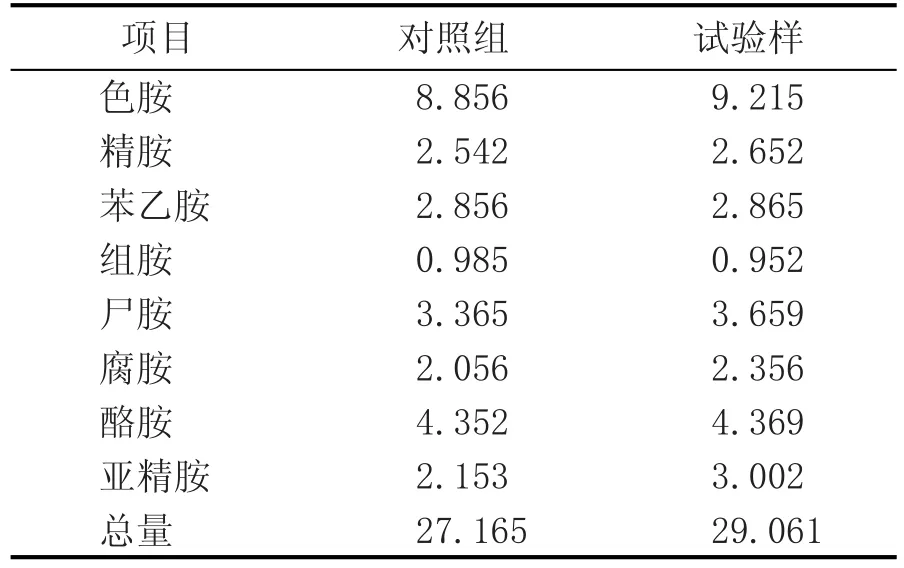
表2 氨基酸脫羧酶對葡萄酒中生物胺含量的影響 (mg/L)
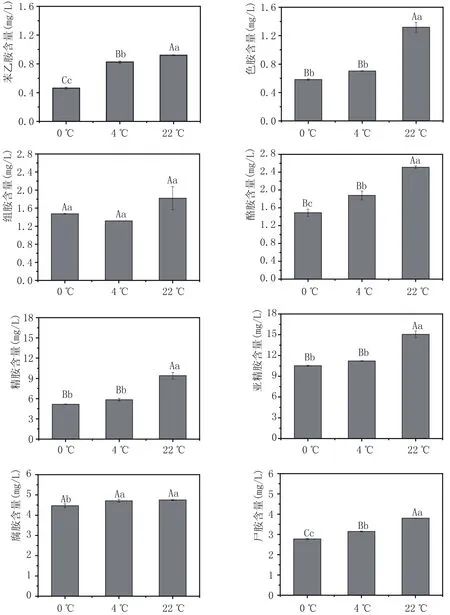
圖4 不同貯藏溫度對葡萄酒中生物胺含量的影響
2.5 不同貯藏溫度對葡萄酒中生物胺含量的影響(圖4)
由圖4可以看出,發酵結束后,隨著貯藏溫度的上升,葡萄酒中的8種生物胺含量也隨之增加。其中,在貯藏溫度為0℃和4℃時,葡萄酒中的精胺、亞精胺和色胺含量在5%和1%水平上均沒有顯著性差異,但當貯藏溫度為22℃時,這3種生物胺的含量顯著上升。說明貯藏溫度在0℃和4℃時,溫度對葡萄酒中這3種生物胺含量影響較小,但當貯藏溫度上升到22℃時,溫度對其含量的影響較大。苯乙胺和尸胺的含量則在3個貯藏溫度條件下的差異均極顯著,而組胺和腐胺含量則在3種貯藏溫度下在5%和1%水平下均無顯著差異。說明貯藏溫度對葡萄酒中生物胺含量有一定的影響,在葡萄酒貯藏時,應避免貯藏溫度過高,盡可能在低溫條件下貯藏。
3 結論
本實驗首先通過不同工藝參數(包括酵母類型及接種量、酒精發酵溫度、乳酸菌類型及接種量、氨基酸脫羧酶活性和貯藏溫度等)的釀酒試驗,其次利用高效液相色譜法對葡萄酒中生物胺含量檢測分析。結果表明,氨基酸脫羧酶的活性是影響生物胺含量的重要因素,接種不同類型酵母菌或乳酸菌時,對葡萄酒中的生物胺含量有一定的影響,但其接種量對生物胺含量的影響較小。在葡萄酒生產過程中可以通過生產工藝的調控,降低葡萄酒中的生物胺含量,以此保障和提升葡萄酒的食品安全性能。

