小曲酒新工藝澳洲高粱發酵酒醅秋季雜醇油升高原因的研究
李長軍,楊生智,曹亞龍,姚賢澤,程 祥,萬賢平
(勁牌有限公司,湖北大冶435100)
小曲酒新工藝就是采用機械化、自動化的生產模式實現了原酒高效穩定的批量生產,相對于所有工序都是靠人工控制的傳統工藝,其特點為工藝物料全程不沾地,不與人接觸,配糟、谷殼用量少,原酒的出酒率和優級率都有了大幅提升。新工藝產酒雖然在甲醇、正丙醇、雜醇油等缺陷成分含量上均低于傳統工藝酒,但是對于雜醇油含量,由于其自身的理化性質以及生成因素的復雜性,在生產過程中仍然難以控制。
雜醇油是指乙醇以外的具有3個碳鏈的一元醇類,這些醇類包括正丙醇、異丁醇、正丁醇、仲丁醇、戊醇、異戊醇、活性戊醇、正己醇、β-苯乙醇等,是白酒中的一類高沸點微量物質,對人體有毒害作用,能使神經系統充血,使人感覺頭痛,其毒性隨分子量增大而加劇。雜醇油在人體內的氧化速度比乙醇慢,在人體內停留時間長,而且雜醇油也是造成白酒苦味、澀味、出現白色渾濁的原因之一[1]。
與傳統的固態發酵法生產白酒一樣,小曲酒新工藝澳洲高粱發酵工藝也存在雜醇油含量過高的問題,特別是受夏季高溫影響,秋季生產發酵酒醅雜醇油含量升高尤為嚴重,而且不同生產工藝,雜醇油生成規律與原因也各不相同,因此開展本實驗,研究小曲酒新工藝澳洲高粱發酵酒醅秋季雜醇油升高的原因,為小曲新工藝度夏生產控制雜醇油含量提供理論依據。
1 材料與方法
1.1 材料、試劑和儀器
實驗材料:九江港進口澳洲高粱(粳高粱)、國產谷殼、山泉水。
設備:毛鋪健康酒業有限公司楓林酒廠車間生產設備。
1.2 實驗方法
根據生產經驗,夏季過后各車間每年10月份前后發酵酒醅雜醇油含量開始上升。雜醇油主要是在發酵前期隨著酵母的大量增殖而產生[2]。所以7月份開始對五車間從發酵第1天到發酵第7天取同批次酒醅樣跟蹤檢測,檢測酒醅中的水分、還原糖、酸度、氨基酸態氮、酵母數,檢測方法如下。
水分檢測:首先用電子分析天平稱干燥的稱量瓶重量m1,將電子分析天平置零后,向稱量瓶中加入酒醅樣品約20 g(20~20.5 g),重量記為m2,然后將稱量瓶置于電熱恒溫鼓風干燥箱,135℃干燥105 min至恒重,重量記為m3,根據以下公式計算酒醅樣水分。
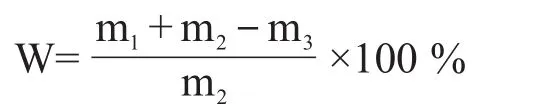
酸度檢測:準確稱取酒醅樣品20 g于潔凈的250 mL燒杯中,加入200 mL純凈水浸泡15 min,每隔5 min攪拌1次,然后吸取上清液10 mL于150 mL三角瓶中,加入2~3滴酚酞指示劑,用0.1 mol/L NaOH溶液滴定,酸度計算公式如下。
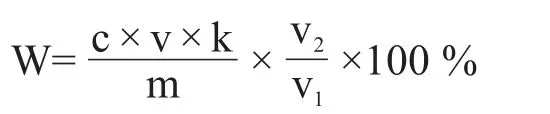
式中:W——酸度(以乳酸計)含量,g/100 g或%;
c——標準氫氧化鈉溶液的濃度,mol/mL;
v——滴定消耗標準氫氧化鈉溶液體積,mL;
k——換算為乳酸的系數,即1 mol氫氧化鈉相當于乳酸的質量;
m——酒醅樣重量,g;
v1——滴定吸取的樣液體積,mL;
v2——浸泡樣品純凈水體積,mL。
還原糖檢測:準確稱取25 g酒醅樣于250 mL三角瓶中,加入250 mL純凈水浸泡30 min,每隔10 min攪拌1次,準確吸取1 mL上清液于150 mL三角瓶中,加入5 mL斐林試劑甲液和5 mL斐林試劑乙液,在電爐上加熱沸騰10 s后,用1 g/L標準葡萄糖溶液滴定至溶液呈無色或淺黃色,記錄消耗體積。同樣方法準確吸取1 mL水做空白滴定,記錄消耗標準葡萄糖溶液體積。酒醅還原糖計算公式如下。
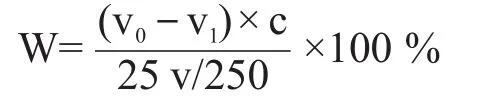
式中:W——還原糖(以葡萄糖計)含量;
v0——空白試驗葡萄糖標準溶液的消耗量,mL;
v1——試樣測定量葡萄糖標準溶液的消耗量,mL;
c——標準葡萄糖溶液的質量濃度,g/L;
25——稱取酒醅的質量,g;
250——酒醅浸出液的體積,mL;
v——所取酒醅浸出液的體積,mL。
絕干氨基酸態氮檢測:準確稱取樣品20 g于200 mL燒杯中,加入60 mL純凈水浸泡30 min,每隔15 min攪拌1次。然后將樣品定容到100 mL后過濾得澄清溶液。準確吸取過濾后的澄清溶液20 mL于100 mL燒杯中,用0.05 mol/L的NaOH溶液滴定至pH8.20,然后加入10 mL甲醛溶液,再用0.05 mol/L的NaOH溶液滴定至pH9.20,記錄消耗標準溶液體積。空白加20 mL純凈水于100 mL燒杯中按同樣方法滴定,記錄消耗標準溶液體積。酒醅氨基酸態氮計算公式如下:
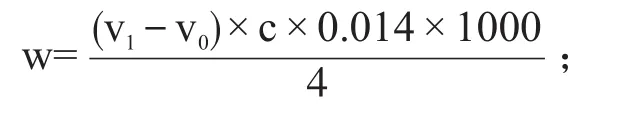
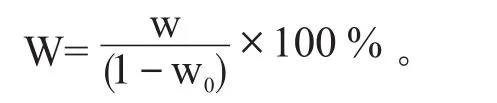
式中:W——絕干氨基酸態氮含量,g/100 g或%;
w——氨基酸態氮含量,g/100 g或%;
w0——酒醅水分,%;
v0——對照消耗標準溶液體積,mL;
v1——樣液消耗標準溶液體積,mL;
c——NaOH溶液濃度,mol/L。
酵母數檢測:稱取10 g樣品于裝有100 mL無菌水的250 mL三角瓶中,于30℃,150 r/min恒溫搖床中振蕩15 min,準確吸取1 mL菌液于裝有9 mL無菌水的試管中稀釋105倍,然后準確吸取1 mL稀釋菌液于3 M霉菌酵母菌測試片中心,用配套壓板壓好后置于30℃恒溫培養箱中培養48 h后統計菌落數。酵母數等于菌落數×106個/g。
GC分析條件:氣相色譜儀:Focus 8890,色譜柱:INNOWax 30 m×0.53 mm×1μm。升溫順序為:40℃保持5 min,以6℃/min升至70℃,以10℃/min升至220℃,保持5 min。進樣口溫度250℃,檢測器溫度280℃。
2 結果與分析
2.1 雜醇油含量變化(表1、圖1)
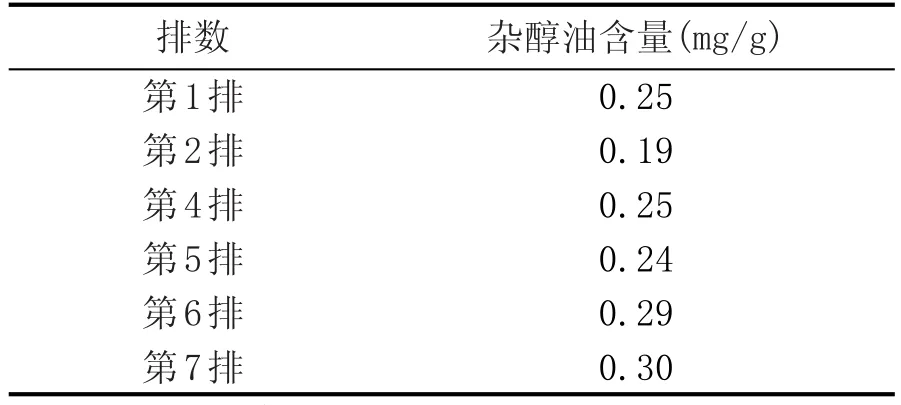
表1 度夏前后五車間酒醅中雜醇油含量變化
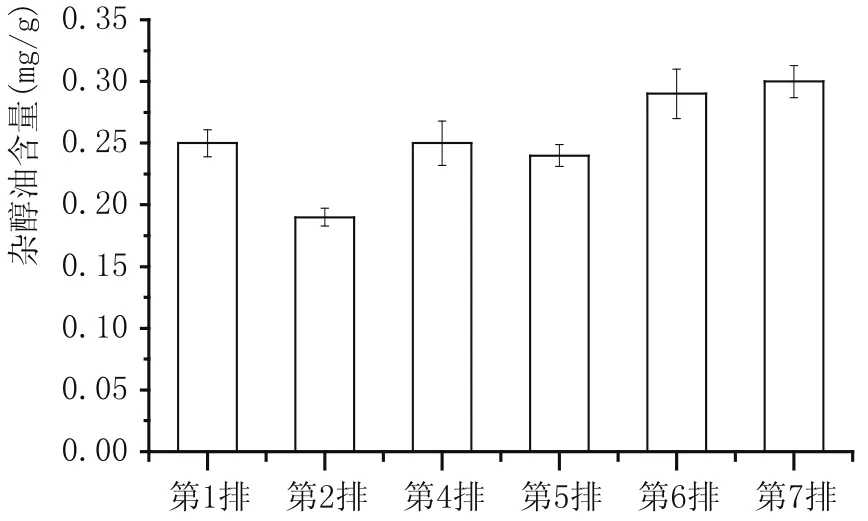
圖1 度夏前后五車間酒醅中雜醇油含量變化
本次檢測主要關注度夏前后原酒雜醇油含量的變化,由表1和圖1可看出,隨著度夏生產時間的延長,續糟生產排數的增加,不同排次發酵酒醅原酒雜醇油升高明顯,從第2排到第7排持續升高。
2.2 度夏生產酒醅中各成分變化差異對比
2.2.1 水分(圖2)
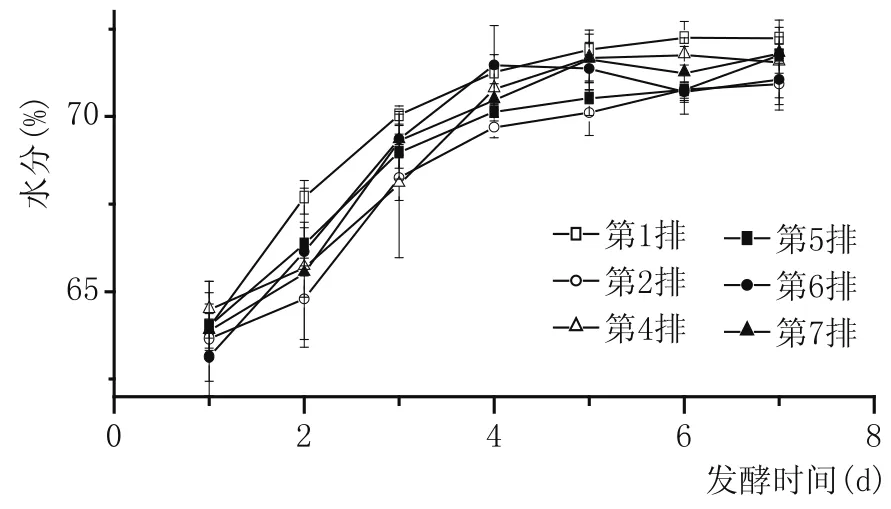
圖2 五車間酒醅水分變化
由圖2可以看出,隨著度夏生產時間的延長,續糟生產排數的增加,不同排次發酵酒醅水分是逐漸升高的,特別是入池醅水分也有較為明顯的升高。水分是營養物質傳輸的媒介,較高的入池醅水分會導致酒醅中酵母代謝更旺盛,生長繁殖速率更快。
2.2.2 還原糖含量(圖3)
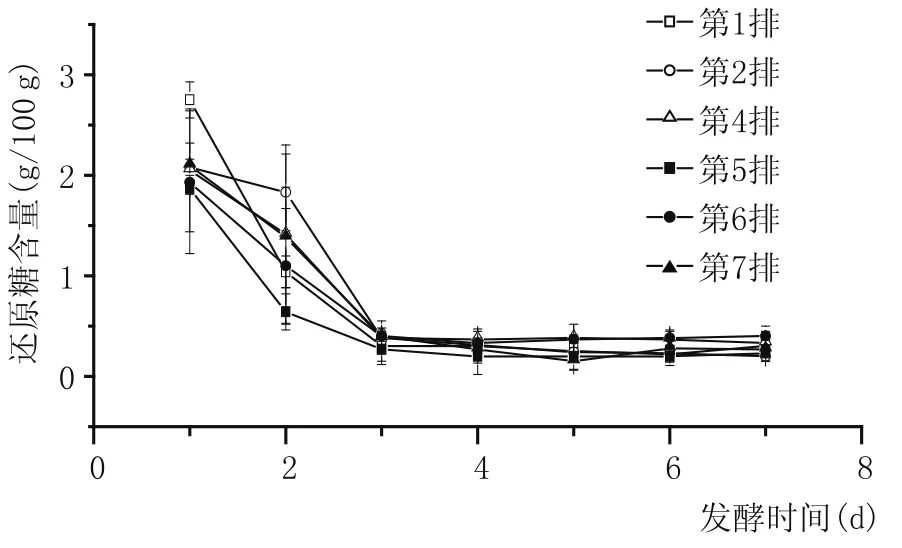
圖3 五車間酒醅還原糖含量變化
由圖3可以看出,隨著度夏生產時間的延長,續糟生產排數的增加,不同排次酒醅還原糖含量下降速度逐漸變快,說明度夏生產期間發酵前期微生物生產繁殖快,代謝旺盛,消耗還原糖速率比夏季生產前快,原因可能是入池水分較高,夏季的高氣溫使入池溫度和發酵溫度偏高。
2.2.3 酸度(圖4)
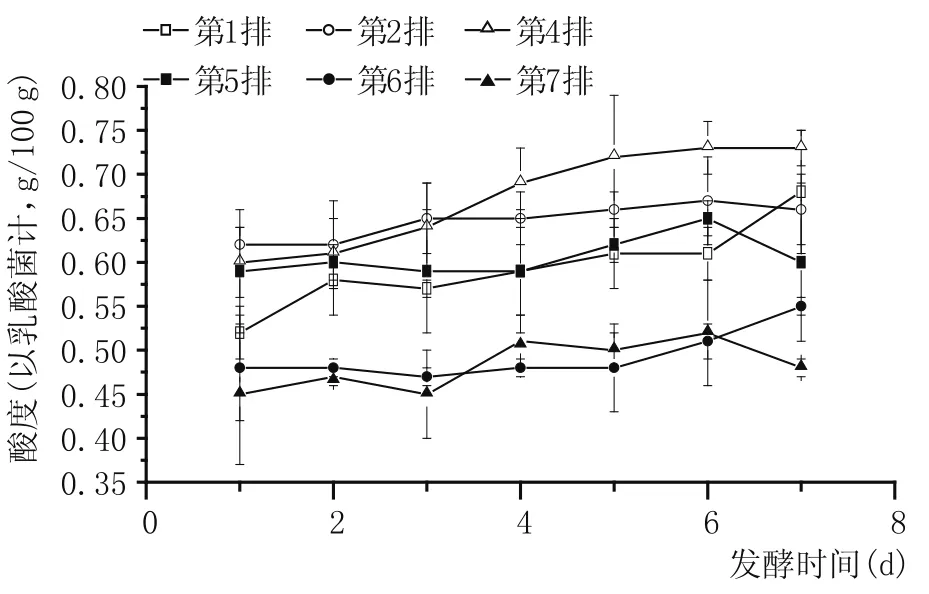
圖4 五車間酒醅酸度變化
由圖4可以看出,隨著度夏生產時間的延長,續糟生產排數的增加,不同排次發酵酒醅酸度是有所下降的。較低的酸度適合酵母的生長繁殖,進一步加快了酒醅中酵母代謝速率和生長繁殖速率。度夏后酸度下降很有可能是夏季高溫導致環境和酒醅中乳酸菌含量下降而引起。
2.2.4 絕干氨基酸態氮含量(圖5)
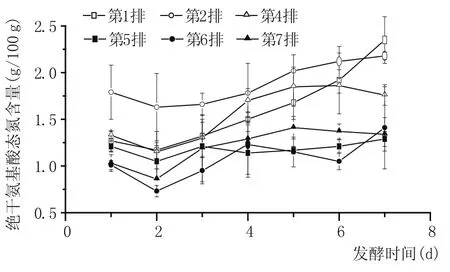
圖5 五車間酒醅絕干氨基酸態氮含量變化
由圖5可以看出,隨著度夏生產時間的延長,續糟生產排數的增加,不同排次酒醅中的絕干氨基酸態氮含量是逐漸降低的,特別是夏季生產后期,酒醅絕干氨基酸態氮含量基本降為夏季生產前一半,說明夏季生產期間微生物對酒醅中的氨基酸存在持續的過度消耗。
2.2.5 酵母數變化(圖6)
由圖6可以看出,隨著度夏生產時間的延長,續糟生產排數的增加,不同排次酵母數增長速度變快,酵母增殖時間延長,最大酵母數長期處于較高的水平(>108個/g),說明夏季生產期間生產條件過于適合酵母的生長繁殖。
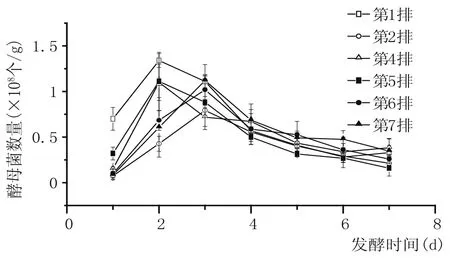
圖6 五車間酒醅酵母數變化
2.3 秋季雜醇油含量升高原因分析
小曲酒新工藝澳洲高粱發酵酒醅秋季雜醇油升高并不是一個單因素影響的結果,而是多個因素相互影響、綜合效應導致的。
釀酒酵母酒精發酵過程中,高級醇形成主要有兩條途徑,一種是酵母以糖為基質的合成代謝途徑,即Harrsi途徑。另一種是以氨基酸為基質的分解代謝途徑,又稱Ehrlich代謝途徑。酵母在正常發酵時,75%的高級醇代謝來自Harrsi途徑,只有25%的高級醇代謝來自Ehrlich途徑[3]。在釀酒酵母線粒體中能催化α-酮異戊酸合成纈氨酸、催化α-酮-3-甲基戊酸合成異亮氨酸,細胞質中能催化α-酮異己酸合成亮氨酸,而這3種α-酮酸又可催化生成相應的高級醇,即異丁醇、活性戊醇和異戊醇[3]。
由圖2至圖6分析度夏生產酒醅中各成分變化差異對比可知,隨著度夏生產時間的延長,續糟生產排數的增加,酒醅中酵母數生長增殖速度變快,最大酵母數增大,酵母生長繁殖速度過快,導致酒醅中氨基酸態氮消耗過快,使酒醅中氨基酸濃度降低,加劇酵母以糖為基質的合成代謝途徑合成氨基酸;而且長期較高水平的酵母數逐排過度消耗配糟中氨基酸,使配糟中氨基酸態氮逐排降低,導致下一排發酵酒醅發酵前期酵母生長繁殖所需氨基酸不足,進一步加劇了酵母以糖為基質的合成代謝途徑合成氨基酸。而酵母通過以糖為基質的合成代謝途徑合成氨基酸,使合成氨基酸的前體物質α-酮酸含量升高,而α-酮酸同樣比較容易生成相應的高級醇,從而也會導致雜醇油含量的升高。
3 結論
隨著度夏生產時間的延長,續糟生產排數的增加,夏季氣溫升高,發酵酒醅水分的升高和酸度的下降都利于酵母的生長繁殖,使夏季生產期間發酵酒醅酵母生長繁殖速度過快,生長繁殖時間延長,最大酵母數長期處于較高水平。過快的酵母生長繁殖速度和長期較高水平酵母數逐排過度消耗配糟中氨基酸,導致配糟中氨基酸態氮逐排降低,使秋季生產時發酵酒醅中發酵前期的酵母生長繁殖所需的氨基酸不足,加劇了酵母以糖為基質的合成代謝途徑合成氨基酸,從而導致秋季生產酒醅中雜醇油含量的升高。

