HCG日血清雌激素水平對不同年齡段女性活產率的預測價值
董萌,邱佳慧,譚季春
(中國醫科大學附屬盛京醫院生殖醫學中心,沈陽 110072)
雌激素由卵巢顆粒細胞分泌,在促進卵母細胞成熟及子宮內膜種植過程中起著重要作用[1]。自Chenette等[2]在1990年第1次報道了雌激素水平對臨床妊娠率的影響后,高雌激素水平對妊娠結局的影響始終爭論不一。一些研究者認為雌激素水平對妊娠率有積極的影響[3-4],另一些研究者認為高雌激素水平可降低妊娠率[5-6],大部分研究者認為高雌激素對妊娠結局并沒有影響[7-11]。不同的結論可能是因為研究方法的選取、患者納入與排除標準、促排卵方案選擇、移植胚胎發育天數、移植胚胎數以及雌激素分組標準不同造成的[11]。然而,雌激素水平是否可預測活產,尚缺乏高質量的研究。
很多因素影響體外受精-胚胎移植(IVF-ET)的成功率,如患者的年齡、優化的促排卵方案、胚胎質量及子宮內膜因素等。隨著年齡的增長,卵母細胞及胚胎質量降低,非整倍體率增加[12]。年齡作為生育力評估的重要因素,可作為影響妊娠結局的獨立因素[13],本研究根據HCG不同雌二醇(E2)水平將患者分為3組,同時又以不同的年齡段分為3個亞組,比較E2水平對活產率的影響,旨在探討HCG日血清E2水平是否可預測活產率并分析影響活產率的相關因素。
資料與方法
一、研究對象與分組
1.研究對象:本文通過回顧性研究,選取2013年1月至2016年12月在中國醫科大學附屬盛京醫院生殖中心行IVF/ICSI-ET助孕治療的不育夫婦為研究對象,共4 200個周期。納入標準:(1)第一次移植;(2)年齡<40歲。排除標準:(1)供卵移植患者;(2)供精移植患者;(3)患有影響胚胎著床的相關疾病:子宮內膜異位癥、子宮纖維化、先天子宮畸形等;(4)患有影響妊娠過程的相關疾病:糖尿病、高血壓、免疫系統疾病;(5)既往不良孕產史:胎兒生長受限、前置胎盤、胎盤早剝、先兆子癇;(6)胚胎植入前行遺傳學診斷篩查;(7)患者臨床與實驗室觀察指標數據不全或丟失;(8)失訪患者。
2.分組:根據HCG日血清E2水平將患者分為3組,A組:E2≤9 175 pmol/L;B組:9 175 pmol/L
二、研究方法
1.促排卵方案:(1)長方案:在前一個周期的黃體中期開始每天使用短效促性腺激素釋放激素激動劑(GnRH-a,達菲林,益普生,法國)0.05~0.1 mg降調節,達到降調節標準后,即子宮內膜厚度≤5 mm、雙側卵巢卵泡直徑<10 mm、LH<5 U/L、E2<183.5 pmol/L,開始使用促性腺激素(Gn,果納芬,默克雪蘭諾,瑞士)促排卵。(2)短方案:于同次月經第2天開始給予GnRH-a 0.05 mg進行垂體降調節,于月經第3天開始使用Gn促排卵,同時檢測卵泡生長情況以及雌激素水平。(3)拮抗劑方案:月經周期第2或第3天開始使用Gn,月經第8天給予拮抗劑(GnRH-ant,思則凱,默克雪蘭諾,法國)0.25 mg,直至HCG注射日。(4)Gn方案:月經周期第2或第3天開始使用Gn,直至HCG注射日。(5)微刺激方案:月經第3~5天給予克羅米芬(高特,塞浦路斯)促排卵。
當主導卵泡中有1個直徑達18 mm或3個達到17 mm時,肌肉注射HCG 5 000~10 000 U,36 h后經陰道超聲下取卵。
2.IVF、胚胎體外培養及移植:本中心使用美國SAGE公司生產的Quinns系列培養液。收集到的卵母細胞放置于培養液(Quinn’s advantage fertilization)中培養4~6 h后進行體外人工授精,受精后16~18 h觀察受精情況,將受精卵移入卵裂培養液(Quinn’s advantage cleavage medium)中,放置于37℃、5%CO2培養箱中再培養48 h,選擇最好的1~3枚胚胎經超聲引導下行宮腔內移植并將剩余胚胎冷凍保存。
3.優質胚胎評價標準:胚胎卵裂球數目第2天達到4個,第3天達到8個,胚胎卵裂球大小均勻,形狀規則,透明帶完整,胞質均勻清晰,沒有顆粒現象,碎片在0~10%。
4.黃體支持及妊娠的診斷:移植后給予黃體酮注射液(浙江仙琚)80 mg每日肌肉注射,移植后14 d抽血檢測血β-HCG,大于5 U者于移植后35 d行超聲檢查,發現孕囊和胎心搏動者確定為臨床妊娠。
5.觀察指標:所有患者的臨床與實驗室數據均來自中國醫科大學附屬盛京醫院臨床生殖醫學數據庫。本研究收集與分析的指標包括:患者年齡、體重指數(BMI)、不孕年限、Gn用量、基礎FSH、HCG日E2水平、子宮內膜厚度、移植胚胎數、促排卵方案、受精方式、獲卵數、受精數及優質胚胎數。
三、統計分析
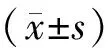
結 果
一、A、B、C三組患者的一般資料分析
本研究共納入4 200個IVF/ICSI治療周期。其中A組1 467周期(A1組363周期,A2組668周期,A3組436周期),B組1 293周期(B1組439周期,B2組604周期,B3組250周期),C組1 440周期(C1組452周期,C2組673周期,C3組315周期)。A、B、C三組之間年齡、BMI、Gn用量、血清基礎FSH、促排卵方案、受精方式、HCG日E2、獲卵數、移植胚胎數、受精率及優質胚胎率比較均存在統計學差異(P<0.05);不孕年限、子宮內膜厚度比較無顯著性差異(P>0.05)。
二、年齡<30歲3亞組患者一般資料、促排卵情況及妊娠結局比較
一般臨床資料分析顯示,A1組BMI顯著高于B1、C1兩組,HCG日E2、獲卵數顯著低于B1、C1兩組;C1組Gn用量顯著低于A1與B1組;促排卵方案比例比較,C1組短方案比例最高,A1組拮抗劑與微刺激方案比例顯著高于B1、C1組;受精方式比較顯示,A1組IVF受精方式比例顯著高于C1組,C1組IVF+ICSI受精方式比例顯著高于其余兩組;A1組優質胚胎率顯著高于B1、C1組(P<0.05)。3組患者的年齡、不孕年限、血清基礎FSH、子宮內膜厚度、移植胚胎數、受精率比較均無顯著性差異(P>0.05)(表1)。
統計結果顯示,A1、B1、C1三組中,B1組的活產率、臨床妊娠率及種植率顯著高于其他兩組(P<0.05);而生化妊娠率、胚胎停育率、流產率、異位妊娠發生率組間比較無顯著性差異(P>0.05)(表2)。
三、30~<35歲3亞組患者一般資料、促排卵情況及妊娠結局比較
一般臨床資料分析顯示,A2組BMI、基礎FSH顯著高于B2、C2兩組,C2組的HCG日E2、獲卵數顯著高于A2、B2兩組,B2組Gn用量顯著高于C2組(P<0.05);促排卵方案比較,B2組長方案比例顯著高于A2組,A2組短方案比例顯著低于其余兩組,微刺激方案比例顯著高于其余兩組,C2組拮抗劑方案比例最低,顯著低于其余兩組(P<0.05);受精方式比較顯示,C2組IVF+ICSI受精方式比例顯著高于其余兩組(P<0.05);A2組受精率、優質胚胎率顯著高于B2、C2兩組(P<0.05)。而3組之間年齡、不孕年限、子宮內膜厚度、移植胚胎數比較均無顯著性差異(P>0.05)(表3)。
妊娠結局的統計結果顯示:B2組活產率顯著高于C2組(P<0.05);而臨床妊娠率、生化妊娠率、胚胎停育率、流產率、異位妊娠發生率和種植率3組間無顯著性差異(P>0.05)(表4)。
表1 年齡<30歲患者一般資料及促排卵情況比較[(-±s),n(%)]
注:與A1組比較,*P<0.05;與C1組比較,#P<0.05

表2 年齡<30歲患者妊娠結局比較(%)
注:與B1組比較,*P<0.05
四、35~<40歲3亞組患者一般資料、促排卵情況及妊娠結局比較
一般臨床資料分析顯示,A3組年齡顯著高于C3組(P<0.05);A3組Gn用量、HCG日E2、移植胚胎數、獲卵數顯著低于B3、C3兩組,基礎FSH顯著高于B3、C3兩組(P<0.05);促排卵方案比較,C3組長方案比例顯著高于其余兩組,而Gn方案比例顯著低于其余兩組(P<0.05);A3組短方案比例顯著低于其余兩組,而微刺激方案比例顯著高于其余兩組,拮抗劑方案比例顯著高于C3組(P<0.05);受精方式比較顯示,C3組IVF+ICSI受精方式比例顯著高于A3、B3兩組;A3組受精率、優質胚胎率顯著高于B3、C3兩組(P<0.05);而3組之間BMI、不孕年限、內膜厚度等無顯著性差異(P>0.05)(表5)。
A3、B3、C3三組之間臨床妊娠、生化妊娠率,胎停、流產、異位妊娠發生率、種植率、活產率均無顯著性差異(P>0.05)(表6)。
表3 30~<35歲患者一般資料及促排卵情況比較 [(-±s),n(%)]
注:與A2組比較,*P<0.05;與C2組比較,#P<0.05

表4 30~<35歲患者妊娠結局比較(%)
注:與B2組比較,*P<0.05
表5 35~<40歲患者一般資料及促排卵情況比較 [(-±s),n(%)]
注:與A3組比較,*P<0.05,與C3組比較,#P<0.05

表6 35~<40歲患者妊娠結局比較(%)
五、ROC曲線與邏輯回歸分析模型評估E2水平與活產率相關性
年齡<30歲、30~<35歲及35~<40歲3亞組ROC曲線下面積分別為0.497(95%CI:0.465-0.529)、0.505(95%CI:0.475-0.535)及0.516(95%CI:0.470-0.561)。結果顯示E2水平不能預測活產率,兩者之前沒有顯著相關性。
患者年齡<30歲時,促排卵方案和優質胚胎率作為獨立預測因素與活產率顯著相關(表7)。當年齡30~<35歲時,促排卵方案和優質胚胎率作為獨立預測因素與活產率顯著相關(表8)。當年齡35~<40歲時,獲卵數、移植胚胎數及優質胚胎率作為獨立預測因素與活產率顯著相關(表9)。進一步驗證了HCG日雌激素水平與活產率沒有顯著相關性。

表7 年齡<30歲的Logistic回歸模型

表8 30~<35歲的Logistic回歸模型

表9 35~<40歲的Logistic回歸模型
討 論
對血清雌激素水平的密切觀察是評估促排卵臨床反應性的主要指標[14],但HCG日雌激素水平對活產率預測價值仍不清楚。目前為止,并沒有高質量的研究表明HCG日血清雌激素水平是否對活產率有明確的影響。本研究的目的是探討血清雌激素水平是否可作為預測活產率的指標。
本研究共納入了2013年1月至2016年12月在中國醫科大學附屬盛京醫院生殖中心行IVF/ICSI治療的不孕不育夫婦共4 200個周期,以保證有足夠的樣本量更加客觀地闡釋結果。在不同的研究中對于高雌激素臨界值的定義并沒有統一的標準,Imudia等[15]研究中,HCG日高雌激素臨界值定義為12 662 pmol/L,Wu等[16]研究定義為19 124 pmol/L,Imudia等[17]研究定義為10 977 pmol/L,Pereira 等[18]研究定義為11 264 pmol/L,Wang等[19]研究定義為13 788 pmol/L。高雌激素臨界值的不同定義有可能是因為選擇的納入標準、促排卵方案和試劑盒等的不同所造成的[19]。為使得結論更加客觀,本研究中按照雌激素水平將患者平均分為3組:低雌激素組:E2≤9 175 pmol/L,中雌激素組:9 175 pmol/L
Steiner等[13]的研究報道女性生育力隨著年齡增長顯著降低,與30~31歲女性相比,34~35歲女性生育力降低14%,36~37歲女性降低19%,38~39歲女性降低30%,40~41歲女性降低53%,42~44歲女性降低59%。由于年齡是決定ART成功率的重要因素,因此,為了避免年齡造成的選擇性偏倚,本研究將患者按照年齡分成了不同的亞組。
有研究發現,對于年齡小于38歲的女性,E2最佳范圍是11 010~14 680 pmol/L,且研究結果顯示HCG注射日E2水平與活產率并無相關性[20]。本研究發現當患者年齡小于35歲時,雌激素水平在9 175~16 515 pmol/L時,活產率最高,與以往的研究結果一致。Basir等[21]研究結果顯示卵巢高反應患者活產率降低,認為卵巢高反應患者的雌激素水平過高,子宮內膜腺體和間質細胞之間發育不同步,內膜環境不利于胚胎著床,導致子宮內膜容受性下降,另外高反應患者子宮內膜血流的變化也會影響子宮內膜的容受性。本研究中年齡<30歲,E2>16 515 pmol/L組患者為卵巢高反應患者(平均獲卵數達到15枚),其活產率明顯低于同年齡段卵巢正常反應人群,這與Basir等[21]的研究結果一致。
為了進一步研究高雌激素是否對活產率有影響,ROC曲線和Logistic回歸分析模型被用于評估雌激素水平是否可預測活產,結果顯示兩者之間并沒有顯著相關性。本研究也進一步證實了IVF中決定成功率關鍵因素為最優化的促排卵方案提供最優質的胚胎[1]。本研究發現,隨著雌激素水平增加,優質胚胎比率降低,因此高雌激素可能影響胚胎質量從而造成活產率的降低。這與Zavy等[11]的研究結果一致,他們的研究認為決定活產的主要因素為胚胎質量、年齡和移植胚胎數目,調整胚胎質量后,高雌激素水平對于活產率并無影響。然而Kyrou等[10]研究認為在拮抗劑方案中,高雌激素并不影響妊娠結局,但是可提高胚胎質量,這也許是因為雌激素臨界值及促排卵方案的不同造成的。
Arce等[22]研究也認為雌激素水平與活產率無顯著相關性,卵泡中期HCG水平可作為陽性預測因素,而年齡和卵泡中期孕激素水平是陰性預測因素。本研究通過Logistic回歸分析發現,當年齡小于35歲時,促排卵方案與優質胚胎率與活產率顯著性相關;當年齡35~<40歲時,獲卵數、移植胚胎數與優質胚胎率與活產率顯著性相關。
綜上所述,本研究結果提示,HCG日雌激素水平并不能預測活產率,優化的促排卵方案和優質胚胎率可作為影響妊娠結局的獨立因素。

