BK通道抑制劑對人臍帶華通膠來源的間充質干細胞的增殖、凋亡及細胞因子的影響
宋阿會 佟琰 劉英莉
間充質干細胞(MSC)是一類具有多向分化和自我更新能力的細胞,大量研究證明了間充質干細胞在各種疾病治療中的作用,尤其是可以通過自分泌和旁分泌等作用參與免疫疾病的調控[1-2]。MSCs能夠通過分泌細胞因子(如TGF-β、PGE2等)抑制T細胞增殖,促進Th1細胞向Th2細胞轉化,影響B細胞成熟和抗體產生等,參與機體的固有免疫和適應性免疫,也能夠促使髓樣細胞分化,從而發揮抗炎和免疫負調控的作用[3]。最近研究表明,人臍帶華通膠來源的間充質干細胞 (Human umbilical cord Wharton's jelly derived mesenchymal stem cells,WJMSC)與BMSC具有類似的形態和細胞表型[4],但WJ-MSC表達的HLA-ABC分子較少,免疫原性更低,且來源于丟棄的臍帶,不受倫理限制,更有希望應用于各種疾病的治療[5]。
大電導鈣依賴性鉀(BK通道)分布于神經元、各脈管系統、腎小球、腎小管等細胞膜上[6-8],參與血壓調控,神經遞質釋放,維持鉀離子平衡等生理活動[9]。BK通道是由α亞基單獨或聯合不同類型的β亞基組成的G蛋白偶聯的跨膜蛋白,包含感應膜電位的電壓敏感性跨膜域(Voltage sensing domain,VSD),結合鈣離子的胞質內域(Cytosolic domain),以及負責鉀離子內流的門孔通道功能域(Pore gate domain,PGD)[8]。研究發現,BK通道也參與各種炎癥的調節作用,如哮喘疾病中BK通道激活劑能夠減輕氣道反應[10];同樣,BK同道還參與IL-1b誘導的單核細胞和內皮細胞的黏附[11],有望成為炎癥治療的靶點。此外,有研究已經在BMSC上發現了BK通道的表達和活性,且發現BK通道活性能夠影響BMSC的增殖和分化能力[12]。但是,目前尚無研究證實BK通道活性對WJ-MSC的細胞活性和凋亡的影響,以及是否影響WJ-MSC分泌細胞因子。本研究嘗試探索BK通道抑制劑預處理WJ-MSC后對其細胞活性和凋亡的影響,并通過檢測預處理后其炎癥因子(IL6,IL10)的表達,探究BK通道抑制劑是否影響WJMSC的旁分泌作用,明確BK通道抑制劑對WJMSC的免疫特性的影響。
1 材料和方法
1.1 主要試劑和耗材
αMEM培養基(Hyclone,美國),胎牛血清(Bioind,以色列),青霉素和鏈霉素(Gibco,美國),0.25%胰蛋白酶(Gibco,美國),CCK-8檢測試劑盒(Rainbio,上海睿安生物科技有限公司),Annexin-V-FITC/PI試劑盒(BD,美國),Elisa檢測試劑盒(Bioligand,美國),PBS溶液(Hyclone,美國),Hanks溶液(Gibco,美國),Paxilline(Alomone,美國),電轉液、電泳液(生工生物工程有限公司,中國),BKα抗體(Alomone,美國),GAPDH抗體(Proteintech,美國),RIPA(碧云天,中國),蛋白磷酸酶抑制劑混合物(索萊寶,中國)。
超凈工作臺、細胞培養箱(Thermo,美國);多功能酶標儀(BioTek,美國),流式細胞分析儀(Beckman,美國),電泳儀(Bio-Rad公司,美國);超敏化學發光成像系統(GE公司,美國)。
1.2 細胞培養和預處理
1.2.1 原代細胞的分離培養
經孕產婦知情同意,取其剖宮產分娩時舍棄的新鮮臍帶組織(標本來源于上海市第一婦嬰保健院),裝入事先預冷的含有1%青霉素和鏈霉素的PBS溶液中。將臍帶組織以PBS洗滌數次,去除血液后移至Hank's溶液中,去除兩條臍靜脈和一條臍動脈,剝離外皮,暴露中間的膠凍樣的華通膠,剪成小段。將剪成段的華通膠移入空培養皿中,晾干,將其剪至1 mm3大小,用勺子將其鋪至T75培養瓶底部,反轉培養瓶,在組織塊對側加入10 mL含有10%胎牛血清和1%雙抗的αMEM培養基,于37℃培養箱中過夜。8~16 h后,將培養瓶反轉使培養基漫過組織塊,繼續培養約2周。至組織塊周圍有細胞爬出時,去除組織塊,用0.25%胰蛋白酶消化約30~60 sec,中止消化后1 000 r/min離心5 min,重懸后接種至新培養皿中,每3天換一次液。取第3~7代細胞用于后續實驗。
1.2.2 WJ-MSC預處理
取第3~7代WJ-MSC細胞,以106個/孔接種至6孔板,待其生長至80%融合時加入不同濃度的Paxilline(0μM、0.1μM、1μM、10μM)孵育24 h,取上清或細胞用于后續檢測。
1.3 Western-b lot檢測BK通道的表達
取第3~7代WJ-MSC細胞,以106個/孔接種至6孔板,待其生長至80%融合時去除上清,加入RIPA和蛋白酶磷酸酶抑制劑混合物配置的裂解液,裂解細胞,用BCA法定量各組蛋白濃度后,加入適量5×loading buffer,100℃煮10 min。配置8%的SDSPAGE膠,將3個不同來源的臍帶華通膠間充質干細胞所提取的蛋白樣品在上樣前100℃煮5 min,以80 V恒壓電泳至染料達膠底部,220 mA恒流轉膜2 h,膜在5%脫脂牛奶中室溫封閉2 h,加入一抗,4℃過夜孵育8~16 h,TBST洗3次,二抗室溫孵育1 h,TBST洗3次后顯色。Image J軟件分析灰度值。
1.4 瓊脂糖凝膠電泳檢測編碼BK通道的KCNMA1基因表達
采用TRIzol法提取第3~7代細胞總RNA,利用Prime Script RT Master Mix (Takara036A)將RNA逆轉錄為cDNA,采用PCR法擴增KCNMA1基因,所得產物在1.5%的瓊脂糖膠中進行電泳。KCNMA1基因正向引物序列為:5’-GGCAGCAGTCTTAGAATGAGTAG-3’;反向引物序列為:5’-AAAGCCCACCACATGCGTT-3’。
1.5 CCK-8法檢測細胞活性
細胞預處理后,各孔加入10μL CCK-8,37℃孵育4 h后,用微孔酶標儀檢測各孔在450 nm處的吸光度值。
1.6 Annexin-V-FITC/PI檢測細胞凋亡
細胞預處理后,用0.25%胰蛋白酶消化各孔細胞,取一組空白組作為空白對照,其余各孔細胞消化后1 000 r/min離心5 min,棄上清,用100μL Annexin Buffer重懸后加入4μL AnnexinV,避光孵育10 min,加入4μL PI后立即上機檢測。
1.7 Elisa法檢測細胞因子
取細胞預處理后的上清,按照Elisa試劑盒步驟依次檢測各組IL6、IL10濃度。
1.8 數據處理及統計學分析
所有實驗均用GraphPad軟件統計分析3次獨立實驗結果,計算各組間均值和標準差,多組間差異比較用ANOVA one-way檢驗,P<0.05表示差異有統計學意義。
2 結果
2.1 原代WJ-MSC上BK通道的表達
光鏡觀察發現,原代WJ-MSC為梭狀,似成纖維細胞,與間充質干細胞描述一致(圖1)。Westernb lot檢測顯示,3個不同來源臍帶組織的原代WJMSC提取的蛋白質,均可檢測到BK通道抗體表達(圖2)。同時,以瓊脂糖凝膠電泳在這3個不同標本來源的間充質干細胞上鑒定到了編碼BK通道的KCNMA1基因的表達(圖3),即不同來源的臍帶華通膠分離的間充質干細胞均有BK通道的表達。

圖1 光鏡下原代WJ-MSC形態Fig 1 The morphology of primary WJ-MSC cells under optical microscope

圖2 不同標本來源WJ-MSC中BK通道的表達Fig.2 The protein expression of BK channel in different WJ-MSC was detected
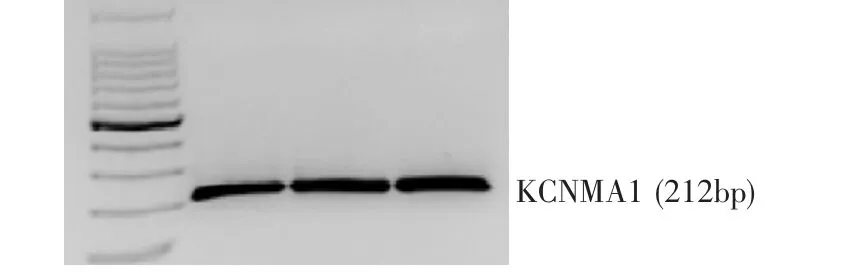
圖3 不同標本來源WJ-MSC中編碼BK通道的KCNMA1Fig.3 The gene KCNMA1 encoding BK channel in WJ-MSC
2.2 不同濃度Paxilline對WJ-MSC活性的影響
不同濃度Paxilline(0μM、0.1μM、1μM、10μM)處理WJ-MSC 24 h后,用CCK-8試劑盒檢測各組在450 nm處的吸光度值。結果顯示,低濃度的BK通道抑制劑Paxilline對細胞活性沒有明顯影響,而高濃度Paxilline(1μM、10μM)可顯著降低細胞活性(P<0.01)(圖4)。
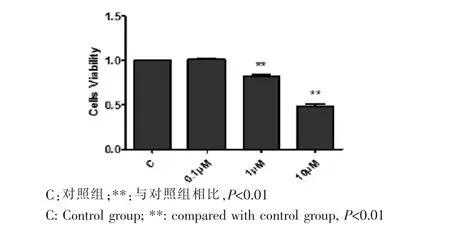
圖4 CCK-8法檢測不同濃度BK通道抑制劑對WJ-MSC活性的影響Fig.4 The cell viability of WJ-MSC was detected by CCK-8 after treated with different
2.3 不同濃度Paxilline對WJ-MSC凋亡的影響
不同濃度Paxilline(0μM、0.1μM、1μM、10μM)處理WJ-MSC 24 h后,收集細胞上清及細胞,通過Annexin-V-FITC/PI試劑盒檢測細胞凋亡情況。結果顯示,高濃度Paxilline(10μM)可明顯增加Annexin-V單陽細胞的比例,促進WJ-MSC細胞的凋亡(P<0.01),而低濃度Paxilline對WJ-MSC細胞的凋亡無明顯影響(圖5)。
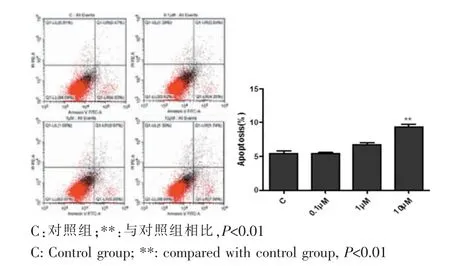
圖5 流式細胞分析儀檢測不同濃度BK通道抑制劑處理WJ-MSC后凋亡細胞比例Fig.5 The cell apoptosis ratio of WJ-MSC was detected by flow cytometry after treated with different concentration of BK channel inhibitors
2.4 不同濃度Paxilline對WJ-MSC分泌IL6、IL10的影響
不同濃度Paxilline(0μM、0.1μM、1μM、10μM)處理WJ-MSC 24 h后,用Elisa檢測試劑盒檢測各組上清中IL6和IL10的濃度。結果顯示,各濃度Paxilline均能夠促進WJ-MSC分泌IL6(P<0.01),但并不增加IL10的分泌(圖6)。
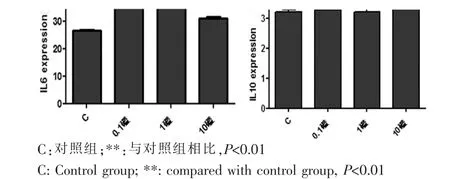
圖6 Elisa法檢測不同濃度BK通道抑制劑對WJ-MSC分泌的IL6和IL10的表達Fig.6 The expression of IL6 and IL10 secreted by WJMSC was detected by Elisa after treated with different concentration of BK channel inhibitors
3 討論
大量的研究均肯定了間充質干細胞在各種疾病中存在的治療作用,亦可通過分泌細胞因子、生長因子、胞外囊泡等發揮抗炎、免疫調控等作用[2,13-14]。由于表面分子表達的差異,不同來源的間充質干細胞具備的免疫特性有所差異[15]。其中,WJ-MSC來源更原始,免疫原性更低。同時,研究還發現,通過一些干預方法預處理間充質干細胞能夠改變其免疫調節能力[16],如使用低濃度LPS預處理MSC后,能夠增強MSC對高濃度LPS介導的凋亡的耐受作用[17]。本研究利用組織貼壁法成功從人臍帶組織中分離培養出WJ-MSC,利用Western-b lot檢測了WJ-MSC上BK通道的表達,與BMSC研究結果一致,BK通道也存在于WJ-MSC上[12]。Paxilline可選擇性抑制BK通道,在不同濃度(0μM、0.1μM、1μM、10μM)預處理下,高濃度Paxilline能夠抑制WJ-MSC的細胞活性,促進其凋亡。表明抑制BK通道活性能夠降低WJ-MSC的細胞活性,促進其凋亡。
研究表明,BK通道參與各種炎癥過程的調節,如BK通道抑制劑能夠減少LPS刺激下巨噬細胞分泌的炎癥因子(TNFα),能夠減輕胰腺炎小鼠模型中巨噬細胞炎癥反應等,但目前尚無研究探究BK通道抑制劑對WJ-MSC分泌的炎癥因子的影響。細胞因子IL6可由多種類型細胞分泌產生[18],發揮不同的效應:①可誘導肝臟細胞合成急性時相蛋白(如C反應蛋白、血清淀粉樣蛋白A)等,啟動急性炎癥反應[19];②作用于骨髓,可促進血小板釋放[20];③與TGF-β共同促進CD4+的T細胞向Th17細胞分化,上調Th17/Treg細胞的比例,促進自身免疫性疾病以及慢性炎癥的發展[21]。細胞因子IL10則主要由受刺激的髓樣細胞和淋巴細胞產生[22],能夠抑制促炎因子的分泌,增強B淋巴細胞分化及抗體的產生[23]。這兩種細胞因子的平衡有助于調節多種疾病的炎癥反應過程[18]。本研究發現,抑制BK通道后可明顯增加WJ-MSC分泌IL6的水平,但不影響其IL10的分泌。表明BK通道的活性能夠影響WJ-MSC細胞因子的分泌,進而影響其在免疫反應中發揮調節作用。
本研究存在一定的局限性。首先,還需通過細胞電生理實驗,以進一步驗證WJ-MSC上BK通道的活性;其次,針對BK通道的抑制只使用了抑制劑,或可利用shRNA敲減WJ-MSC上的BK通道后進行驗證,同時由于一直沒有探索出原代干細胞的過表達質粒構建條件,尚缺乏過表達BK通道以進一步檢驗上述結論。此外,雖然BK通道抑制劑能夠促進WJ-MSC分泌的IL6水平,但抑制BK通道后對WJ-MSC的免疫負調控作用的影響尚需進一步研究明確。

