阿格列汀對2型糖尿病模型大鼠心肌纖維化的保護作用及其機制
張 毅,孟祥雯
(湖北科技學院醫藥研究院糖尿病心腦血管病變湖北省重點實驗室,湖北 咸寧 437100)
糖尿病(diabetes mellitus,DM)作為21世紀發展最迅速的慢性疾病之一,嚴重危害人類的身體健康。其主要是由胰島素抵抗或胰島素分泌不足或兩者共同作用而導致血糖持續升高[1]。根據國際糖尿病聯合會的數據,到2035年,全世界DM患者的數量將從2013年的3.82億增加到5.92億[2]。DM心肌纖維化(DM myocardial fibrosis,DMMF)作為糖尿病心肌病(diabetic cardio myopathy,DCM)最主要的并發癥,是各種心血管疾病的共同病理特征,主要表現為成纖維細胞的過度增殖和細胞外基質(extracellular matrix,ECM)的沉積,被認為是DCM的最初改變。在心肌纖維化過程中,膠原扮演著重要角色。正常生理條件下,膠原的產生和降解處于動態平衡狀態,而高糖、高脂等病理因素可刺激心肌成纖維細胞過度增殖,膠原過度積聚,導致間充質重塑和結構紊亂,損害心功能,而致心力衰竭[3]。
參與心肌纖維化發生發展的因子很多,其中最重要的因子之一是轉化生長因子β1(transforming growth factor-β1,TGF-β1)。它主要通過誘導下游經典的Smad通路參與DMMF的發生發展。而相關研究表明,TGF-β1誘導的非經典信號通路如絲裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK),NF-κB都在心肌纖維化中發揮著重要作用[4-5]。
阿格列汀(alogliptin,Alog)屬于二肽基肽酶4(dipeptidyl peptidase-4,DPP-4)抑制劑,是一類新型的口服降糖藥物,被廣泛應用于治療2型DM(type 2 DM,DM2)。DPP-4抑制劑主要通過抑制胰高血糖素樣肽1(glucagon-like peptidase-1,GLP-1)和葡萄糖依賴性促胰島素分泌多肽(glucosedependent insulinotropic polypeptide,GIP)的降解,提高內源性GLP-1和GIP的水平,促進胰島素的產生和釋放,從而改善血糖水平[6]。
目前,世界范圍內已上市多種DPP-4抑制劑,如Alog、西格列汀、利格列汀和維格列汀等。靶向DPP-4抑制劑越來越被認為是有前景的抗DM藥物。而在控制血糖的同時,預防和降低心血管風險也顯得尤為重要。相關研究表明,Alog能減輕DM大鼠肝及心肌纖維化程度,改善心功能[7-8],然而其分子機制尚不清楚。因此,本研究采用高糖高脂聯合鏈佐星(streptozocin,STZ)誘導建立DM2大鼠心肌纖維化模型,再給予Alog進行治療,探討Alog對DM2大鼠心肌纖維化的保護作用及可能的作用機制,為Alog在DMMF的臨床治療應用中提供理論依據。
1 材料與方法
1.1 動物、試劑和主要儀器
雄性Sprague Dawley(SD)大鼠40只,體質量180~200 g,購自華中科技大學實驗動物中心,動物合格證批號:SCXK(鄂)2010-0009。苯甲酸Alog片(武田藥品工業株式會社大阪工廠);STZ粉末和小鼠抗人TGF-β1單克隆抗體(SAB5300197)購自美國Sigma公司;兔抗人膠原Ⅰ型多克隆抗體(ab34710)和兔抗人膠原Ⅲ型多克隆抗體(ab6310)、兔抗人轉化生長因子β受體Ⅱ(transforming growth factor-β receptorⅡ,TβRⅡ)多克隆抗體(ab186838)購自英國Abcam公司;兔抗人轉化生長因子β活化激酶1(transforming growth factor activated kinase 1,TAK1)多克隆抗體(#4505)、兔抗人P38-MAPK多克隆抗體(#9212)、兔抗人c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)多克隆抗體(#9252)和小鼠抗人磷酸化c-Jun氨基末端激酶(p-JNK)單克隆抗體(#9255s)購自美國CST公司;辣根過氧化物酶標記的羊抗兔IgG抗體(BL003A)購自biosharp公司,蘇木精-伊紅(hematoxylin-eosin,HE)染色試劑(G1004)和Masson染色試劑(G1006)購自武漢塞維爾公司;苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)購自碧云天公司;RIPA裂解液(radio immunprecipitation assay lysis buffer,RIPA)和蛋白酶抑制劑(protease inhibitor cocktail)購自美國CST公司;二喹啉甲酸(bicinchonininc acid,BCA)蛋白濃度檢測試劑盒購自美國Thermo Fisher公司;電化學發光(electro-chemiluminescence,ECL)顯影液購自武漢愛博泰克公司。BX53-正置熒光顯微鏡(Olympus公司,日本);LP-渦旋振蕩儀(Thermo Scientific公司,美國);AL104-電子分析天平(METTLER TOLEDO公司,瑞士);Universal HoodⅡ-凝膠成像系統(Bio-Rad公司,美國),5424R-低溫高速離心機(Eppendorf公司,德國);Synergy2-酶標儀(BioTek公司,美國);PowerPac Basic-垂直電泳儀(Bio-Rad公司,美國)。
1.2 2型糖尿病大鼠模型的制備
分別給予大鼠4周高糖(10%)和高脂(20%)的飲食,單次ip給予STZ 55 mg·kg-1制備DM2大鼠模型。正常對照組大鼠飼喂正常飼料,ip給予等量檸檬酸緩沖液。檢測空腹血糖≥16.7 mmol·L-1即為DM2造模成功。將DM2大鼠隨機分為4組:正常對照組(n=10)、Alog藥物對照(Alog)組(n=10)、模型(DM2)組(n=10)和Alog治療(DM2+Alog)組(n=10)。Alog(每天5 mg·kg-1)通過ig給藥,正常對照組和DM2組給予等量生理鹽水。自高糖高脂喂養起,16周后處死大鼠[9],取各組心尖組織置于4%多聚甲醛中進行固定,用于HE和Masson染色及免疫組化分析,左心室組織于液氮中冷凍后置-80℃冰箱冷凍保存備用。
1.3 HE染色觀察大鼠心肌組織病理變化
各組心肌組織固定后,進行脫水、石蠟包埋,然后切片。將組織切片于60℃烤箱烘干1 h,然后脫蠟至水,蘇木素染液浸染5 min,蒸餾水洗,1%鹽酸乙醇分化6 s,蒸餾水洗,0.6%氨水返藍10 s,蒸餾水洗,伊紅染液浸染5 min,蒸餾水洗,脫水透明后采用中性樹膠封片。于光學顯微鏡下觀察心肌組織病理變化并拍照。
1.4 Masson染色觀察大鼠心肌組織膠原纖維沉積
各組心肌組織固定后,脫水,石蠟包埋。待蠟塊充分凝固后切片,60℃烘干1 h后,脫蠟至水,進行Masson染色。
用配制好的鐵蘇木素染液浸染5 min,蒸餾水沖洗,酸性乙醇分化10 s,蒸餾水洗,藍化液浸染3 min,蒸餾水洗,麗春紅染液浸染5 min,弱酸1 min,磷鉬酸1 min,苯胺藍1 min,弱酸1 min,然后脫水透明,中性樹膠封片。顯微鏡下觀察心肌組織膠原纖維沉積部位為藍色,正常心肌組織為紅色。
1.5 免疫組化法檢測大鼠心肌組織中膠原Ⅰ型和膠原Ⅲ型蛋白表達
各組大鼠心尖組織固定、脫水、石蠟包埋,然后切片,60℃烘干1 h后,脫蠟至水,加抗原修復液進行微波抗原修復后,PBS洗3次,每次5 min,用3%H2O2避光封閉25 min后,PBS洗3次,每次5 min,滴加3%BSA室溫封閉30 min,瀝干多余BSA液體,滴加1∶100比例稀釋的一抗,于濕盒內4℃孵育過夜。PBS洗3次,每次5 min,滴加1∶100比例稀釋的羊抗兔IgG室溫孵育1 h,PBS洗3次,每次5 min;滴加DAB染色液顯色,鏡下觀察陽性細胞被染色后,水洗終止反應,然后將片子放入蘇木素染液復染2~3 min,水洗1 min,1%鹽酸乙醇分化5 s,水洗2 min,梯度乙醇脫水,二甲苯透明、風干后中性樹膠封片。于普通光學顯微鏡下觀察心肌組織中膠原蛋白表達,陽性區域呈深棕色。
1.6 Western印跡法檢測大鼠心肌組織中相關蛋白表達
取各組心肌組織30 mg,分別加含蛋白酶抑制劑的RIPA裂解液,于冰浴條件下勻漿,再置于冰上裂解30 min后,在4℃條件下以12 000×g離心10 min,取上清轉移到新的EP管內,用BCA法測定蛋白濃度。然后將蛋白樣品與上樣緩沖液(3×)按2∶1體積比混合均勻后,95℃變性5 min。之后進行SDSPAGE蛋白電泳,在冰浴條件下250 mA,3 h轉膜。轉膜結束后,用TBST洗膜3次,然后用5%脫脂牛奶室溫封閉2 h,用1∶1000比例配制的一抗在4℃搖床上孵育過夜,TBST洗膜3次,用1∶10 000比例配制的二抗室溫搖床上孵育1 h,TBST洗膜3次,采用ECL化學發光法顯影,使用ImageJ軟件進行半定量分析,以目的條帶吸光度值與內參條帶吸光度值的比值表示目的蛋白相對表達水平。
1.7 統計學分析
2 結果
2.1 Alog對2型糖尿病模型大鼠心肌組織病理變化的影響
HE染色結果顯示,正常對照組大鼠心肌細胞形態完整、排列規則、整齊;DM2組大鼠心肌細胞肥大且排列紊亂、松散,心肌間充質出現炎性細胞浸潤,成纖維細胞增殖;與DM2組大鼠比較,給與Alog治療后的大鼠心肌細胞肥大有所改善,纖維排列趨于整齊(圖1)。
2.2 Alog改善2型糖尿病模型大鼠心肌組織膠原的沉積
Masson染色結果顯示(圖2A和B),正常對照組大鼠心肌細胞間充質中膠原纖維較少且分布均勻;DM2組大鼠心肌細胞排列紊亂,膠原纖維明顯增加且主要在血管周圍沉積,為正常對照組的2.1倍(P<0.05);DM2+Alog組較DM2組心肌細胞排列趨于整齊,間充質纖維化減少52%,幾乎恢復至正常水平(P<0.05)。
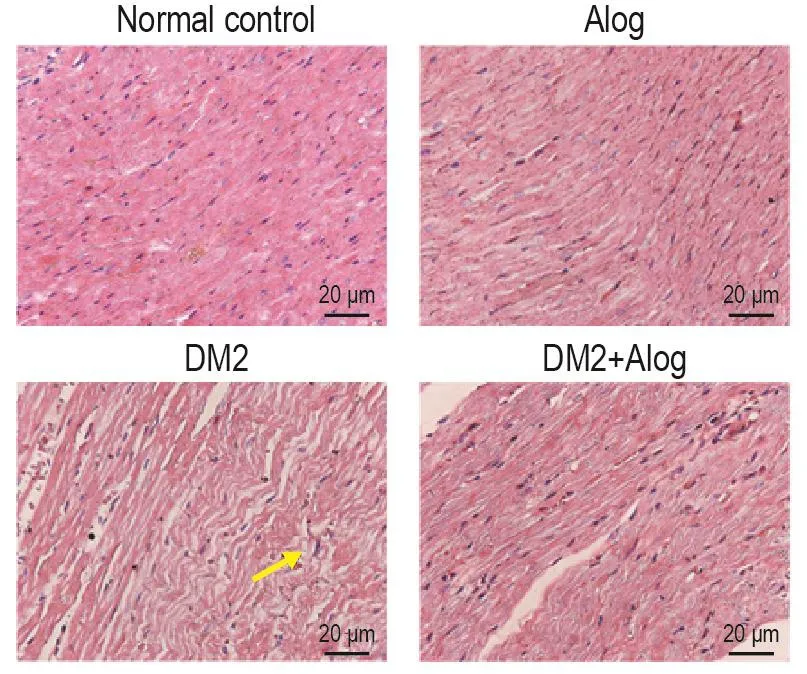
Fig.1 Pathological changes in myocardial tissue of type 2 diabetic rats by HE staining.Rats were injected with streptozocin(STZ)55 mg·kg-1for one time,and then were ig given alogliptin(Alog)5 mg·kg-1per day for another twelve weeks.Arrow shows the pathological change of myocardial tissue.
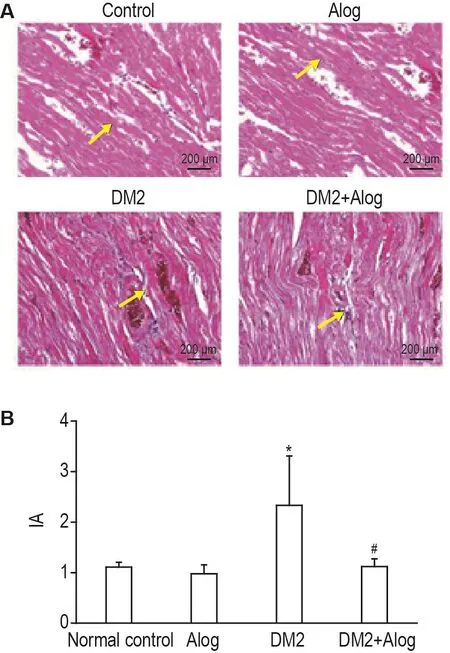
Fig.2 Pathological changes in myocardial tissue of type 2 diabetic rats by Masson staining.See Fig.1 for the rat treatment.IA:integrated absorbtion.B:semi-quantitative results of A.±s,n=4-7.*P<0.05,compared with normal control group;#P<0.05,compared with DM2 group.Arrows show the collagen accumulation of myocardial tissue.
2.3 Alog降低2型糖尿病模型大鼠心肌組織中膠原Ⅰ型和膠原Ⅲ型的表達
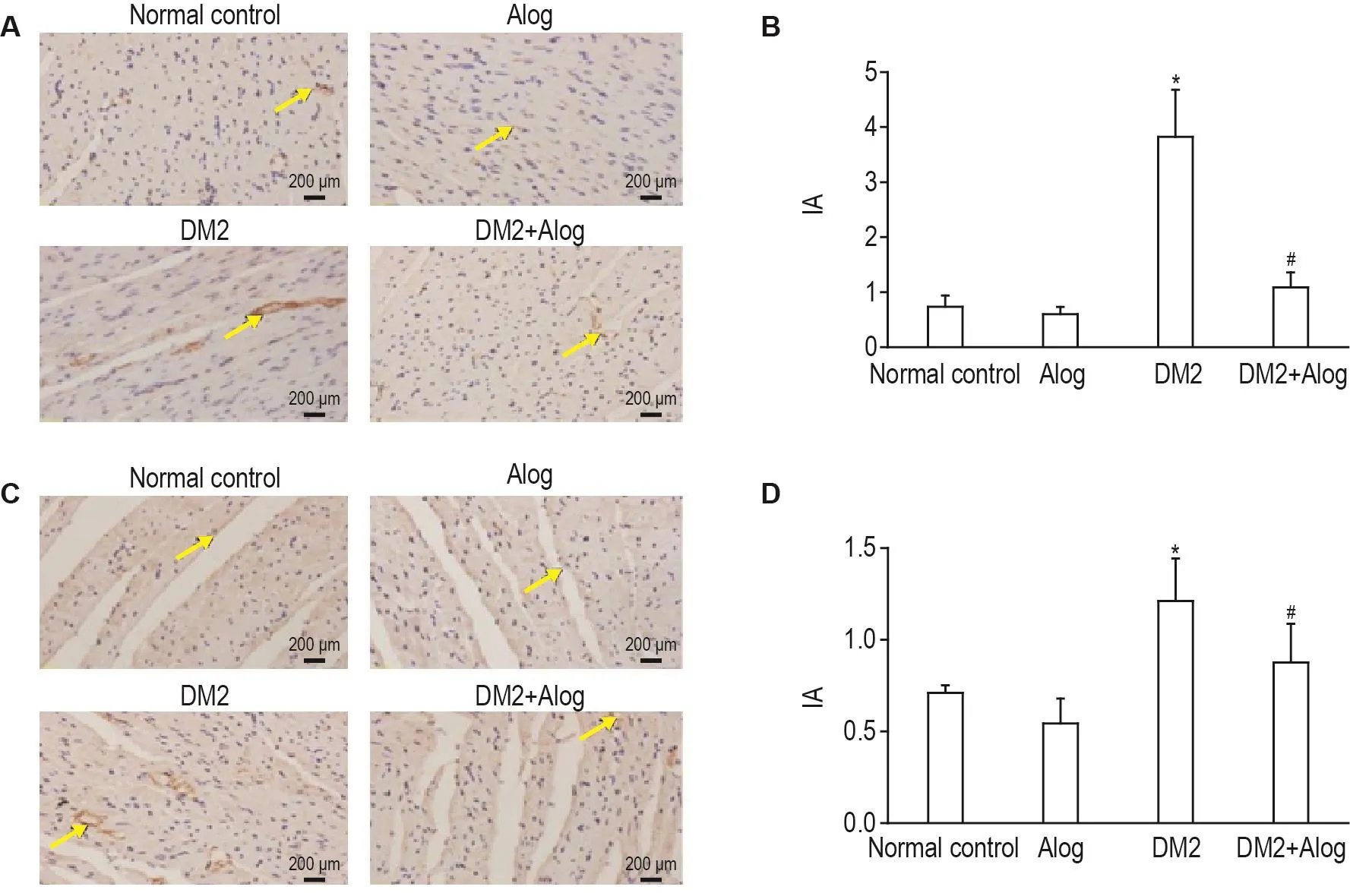
Fig.3 Effect of Alog on protein expression of collagenⅠand collagenⅢin myocardial tissue of type 2 diabetic rats by immunohistochemistry(lHC).See Fig.1 for the rat treatment.A and C:protein expression of CollagenⅠand collagen Ⅲwere detected by immunohistochemistry;B and D:semi-quantitative result of A and C,respectively.±s,n=5-10.*P<0.05,compared with normal control group;#P<0.05,compared with DM2 group.Arrows show the protein expression of collagenⅠand Ⅲ.
免疫組化法檢測大鼠心肌組織中膠原表達(圖3),箭頭指示位置的棕色為膠原表達,較正常對照組相比,DM2組大鼠心肌組織中膠原Ⅰ型和膠原Ⅲ型表達明顯增多,分別約為正常對照組的5.2倍和1.4倍(P<0.05);Alog治療后大鼠心肌組織中膠原Ⅰ型、膠原Ⅲ型表達量顯著性降低,分別降低71%和28%(P<0.05),說明Alog能降低心肌組織中膠原的表達,減輕心肌纖維化。
2.4 Alog對2型糖尿病模型大鼠心肌組織膠原Ⅰ型、膠原Ⅲ型和TGF- β1蛋白表達的影響
Western印跡法檢測膠原Ⅰ型、膠原Ⅲ型和TGF-β1蛋白表達(圖4)。與正常對照組相比,DM2組大鼠心肌膠原Ⅰ型、膠原Ⅲ型及TGF-β1蛋白表達水平顯著提高,分別為正常對照組的1.6,1.7和1.8倍(P<0.05),而Alog能夠下調大鼠心肌組織中膠原Ⅰ型、膠原Ⅲ型及TGF-β1蛋白表達,分別比DM2組降低19%,34%和45%(P<0.05)。
2.5 Alog對2型糖尿病模型大鼠心肌組織T βRⅡ,TAK1,P38-MAPK和p-JNK的影響
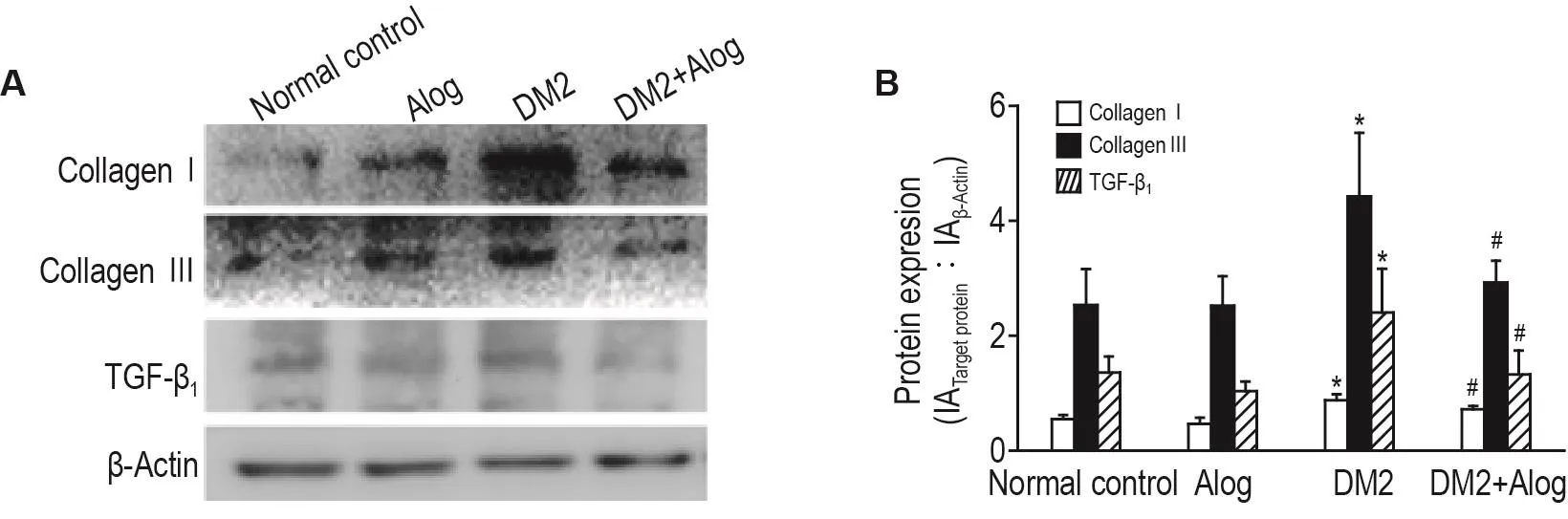
Fig.4 Effect of Alog on protein expressions of collagenⅠ,collagen Ⅲ and transforming growth factor- β1(TGF- β1)in myocardial tissue of type 2 diabetic rats by Western blotting.See Fig.1 for the rat treatment.B:semi-quantitative results of A.±s,n=4.*P<0.05,compared with normal control group,#P<0.05,compared with DM2 group.
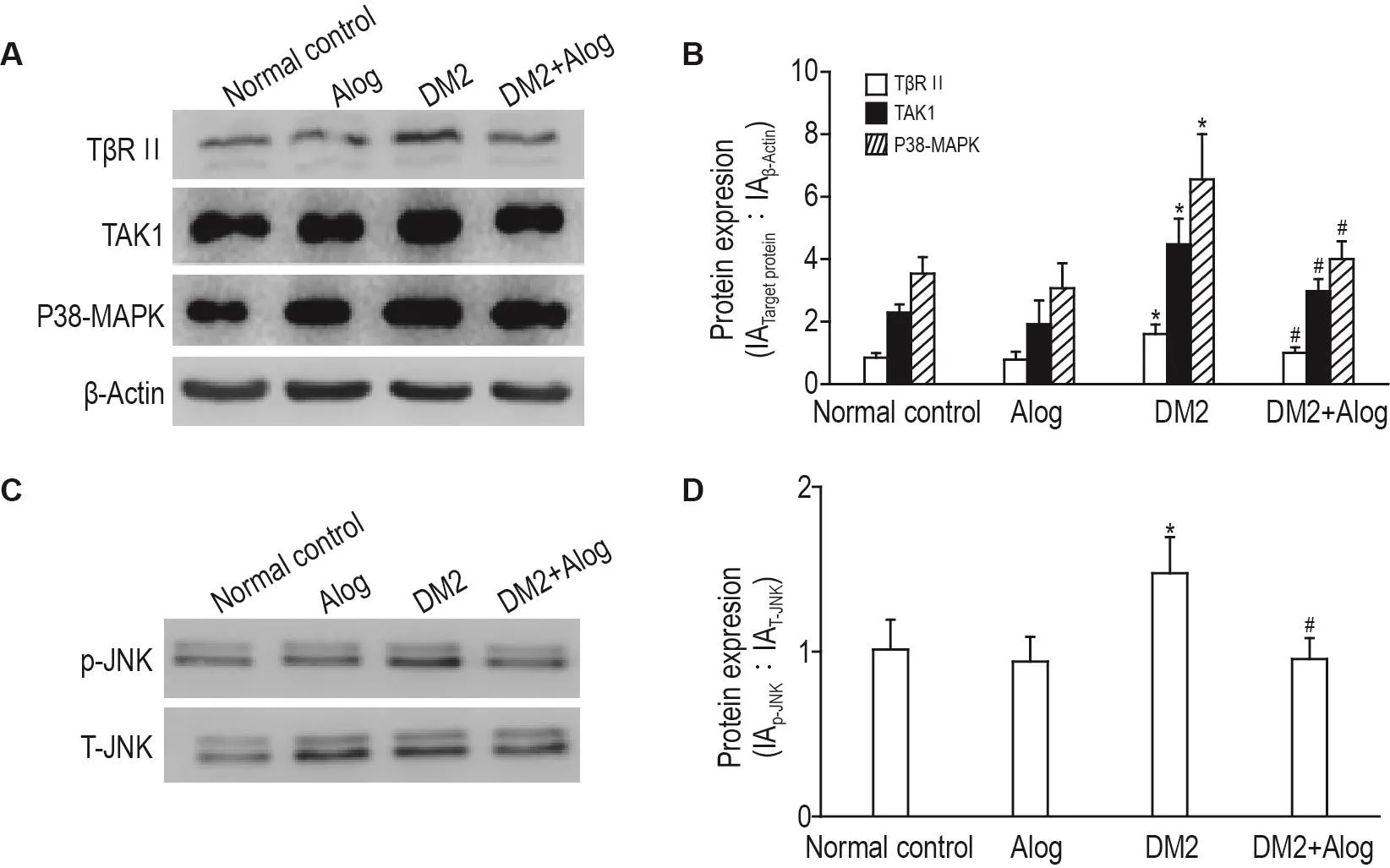
Fig.5 Effect of Alog on protein expression of transforming growth factor- β receptorⅡ(T βRⅡ),transforming growth factor activated kinase 1(TAK1),P38 mitogen-activated protein kinase(P38-MAPK)and phosphorylation of c-jun N-terminal kinase(p-JNK)in myocardial tissue of type 2 diabetic rats by Western blotting.See Fig.1 for the rat treatment.B and D:semi-quantitative results of A and C.±s,n=4.*P<0.05,compared with normal control group;#P<0.05,compared with DM2 group.
為進一步研究Alog對DM2模型大鼠心肌纖維化的作用是否與TGF-β1誘導的非Smad依賴的P38-MAPK信號通路有關,采用Western印跡法檢測大鼠心肌組織中的TβRⅡ,TAK1,P38-MAPK及p-JNK的表達水平。與正常對照組相比,DM2組的TβRⅡ,TAK1,P38-MAPK和p-JNK表達顯著上升,分別為正常對照組的1.9,2.0,1.8和1.5倍(P<0.05)(圖5)。與DM2組相比,Alog治療組TβRⅡ,TAK1,P38-MAPK和p-JNK表達明顯降低,分別降低38%,34%,39%和35%(P<0.05)。
3 討論
本研究結果顯示,高糖高脂聯合STZ誘導的DM2模型大鼠中,心肌細胞發生明顯紊亂現象,膠原纖維大量累積,提示DM2模型大鼠MF模型的成功構建。給予Alog治療后DM2模型大鼠心肌細胞形態結構出現一定程度的恢復,且膠原表達顯著性降低,說明Alog能對DM2模型大鼠心肌纖維化起到一定的調控作用。同時蛋白表達檢測結果顯示,DM2組大鼠心肌細胞中TGF-β1及TβRⅡ的表達增加,同時p-JNK、P38-MAPK及其上游激酶TAK1的表達也顯著增加;給予Alog治療后大鼠心肌組織中TGF-β1及 TβRⅡ的表達顯著降低,p-JNK,P38-MAPK和TAK1的表達也有不同程度的降低,Alog對DM2肌大鼠心肌纖維化起到一定的治療作用,而Alog的抗纖維化作用可能與非Smad依賴的TGF-β1/P38-MAPK信號通路有關。
DMMF作為多種心臟疾病發展到一定階段的共同特征主要表現為成纖維細胞過度增殖及膠原蛋白過度沉積。在正常生理情況下,心肌膠原的合成和降解受復雜的生長因子網絡調控,維持動態平衡狀態。TGF-β1作為心肌纖維化發生發展的重要因子之一,可通過經典的TGF-β1/Smad信號通路及非Smad依賴信號通路參與DMMF的發生發展。在非Smad依賴的信號通路中,MAPK信號通路。主要包括JNK,ERK和P383大類。MAPK通過下游這3大類家族成員參與并影響成纖維細胞的增殖、遷移、分化以及ECM的沉積等,在纖維化的發生發展過程中起著促纖維化的作用[10]。本研究結果進一步驗證了TGF-β1介導的P38-MAPK信號通路參與DMMF進程。而Alog作為新一代DPP-4抑制劑降糖藥物,多篇文獻已報道Alog可改善DM狀態下心肌損傷,緩解心肌纖維化[8,11-12]。同樣,本研究結果顯示,Alog能改善DM2大鼠心肌纖維化,且這種調節與TGF-β1介導的P38-MAPK信號通路有關。
目前,Alog對心肌纖維化的保護機制研究主要集中在經典的TGF-β1/Smads信號通路,對于非Smad依賴的信號通路鮮有報道。因此,本研究結果可為Alog抗心肌纖維化提供新的理論依據。同時鑒于目前尚無有效抗纖維化策略的現狀,心肌纖維化相關的其他信號通路的研究既可為心肌纖維化的發生機制提供新的理論支持,也可為心肌纖維化的藥物治療提供新的靶點。由于本研究只在大鼠DM2模型中探討了Alog通過P38-MAPK信號通路對心肌纖維化的調控機制,實驗設計存在一定的局限性。今后應在細胞水平上進一步深入闡述Alog的抗心肌纖維化機制。

