大鯢Agouti基因的克隆、表達及多態性分析
姜維, 鄧捷, 王啟軍, 趙虎, 孔飛, 張紅星
(陜西省動物研究所,陜西省秦嶺珍稀瀕危動物保育重點實驗室,西安710032)
動物體色(毛色)受自然選擇、性別選擇、遺傳漂變及群體間地理阻隔等因素的影響,呈現出豐富多變的表型,成為進化和遺傳領域的研究熱點。其中,兩棲動物體色的多樣性和變化,對于個體擬態、逃避捕食、擇偶、體溫調節等行為尤為重要(Wente & Phillips,2003)。兩棲動物體色主要由真皮層中的3類色素細胞決定:載黑素細胞位于最下層,通過指狀突起擴展到上一層色素細胞之間;中間一層為載虹素細胞,對光有反射和散射作用,產生藍-綠色;最上面靠近表皮的一層是載黃素細胞,含蝶啶或類胡蘿卜素,呈黃色。當黑色素顆粒移動到黑色素細胞的突起中時,皮膚呈現深暗色,當黑色素顆粒聚攏到細胞核周圍時,皮膚顏色變淺(Obika & Bagnara,1964;Frostetal.,1984;Yasutomi & Yamada,1998)。
動物體色形成機制的研究以哺乳動物、鳥類和魚類為主,揭示了以黑色素細胞為核心的黑色素合成和運輸的分子調控系統。已經發現的參與黑色素合成的主要酶和其他分子包括:酪氨酸酶及其相關蛋白、黑皮質素受體-1(MC1R)、刺鼠信號蛋白(Agouti)、小眼畸形相關轉錄因子等(Hoekstra,2006)。以往主要通過生理學和行為學方面的研究來解釋兩棲動物獨特的體色模式及其形成過程(Bagnara & Hadley,1969;Thibaudeau & Altig,2012;Rudh & Qvarnstr?m,2013;Beukemaetal.,2016;Kindermann & Hero,2016),關于兩棲動物體色形成的潛在分子遺傳機制知之甚少(Beukemaetal.,2016)。MC1R基因突變會導致哺乳動物產生毛發白化、黃化和黑化等表型變化(Mundy & Kelly,2003;Garcia-Borronetal.,2005)。Herczeg等(2010)的研究發現MC1R基因的核苷酸突變與歐洲蛙Ranatemporaria個體體色的黑化程度不相關。Woodcock等(2017)從美西鈍口螈Ambystomamexicanum的白色個體和白化病個體中分別鑒定出了相關的edn3基因突變和tyr基因142 bp的核苷酸缺失。動物黑色素合成通路十分保守,因此推測參與黑色素合成的其他基因,尤其是Agouti也可能是兩棲動物體色形成的重要決定因子。Agouti是G蛋白偶聯受體MC1R的天然拮抗劑,以競爭方式結合MC1R,抑制MC1R的活化,引起環腺苷酸水平下降,降低酪氨酸酶和多巴色素異構酶的活性水平,從而使黑色素的合成由合成黑色的真黑素轉為合成黃色或紅色的褐黑素(Suzukietal.,1997;Ollmann & Barsh,1999)。
大鯢Andriasdavidianus隸屬于兩棲綱Amphibia有尾目Urodela隱鰓鯢科Cryptobranchidae,是世界上現存體型最大的兩棲動物(Duellman & Trueb,1986)。在漫長的進化及人工馴養過程中,大鯢形成了多種不同的體色表型,表現出豐富的多態性,使其成為研究兩棲動物體色多態性形成和分子遺傳機制的優良材料。本實驗克隆了大鯢Agouti基因,采用實時熒光定量PCR(qPCR)方法檢測其在大鯢10個組織和器官中的表達分布,并通過分析不同體色大鯢皮膚組織中Agouti基因的序列多態性和表達,探討Agouti基因與大鯢體色之間的關系,旨在了解大鯢體色形成的分子基礎,為兩棲動物體色遺傳機制研究提供基礎資料。
1 材料與方法
1.1 實驗材料
大鯢[野生動物經營利用許可證:(漢)水野經字(2015)23號]采自漢中古生大鯢有限公司:(1)選取體色為黑色的成年商品大鯢3尾(1雌2雄),處死后立即取其肌肉、皮膚、心臟、肝臟、脾、肺、胃、腸、胰腺、生殖腺(卵巢/精巢)等10個組織和器官樣品,-80 ℃保存備用。(2)選取15尾大鯢,根據體色表型分為野生型(圖1:A)、白斑型(圖1:B)和白斑黑化型(圖1:C~E),于2017年10月22日手術法采集尾尖部皮膚組織約0.5 cm2,焦碳酸二乙酯(DEPC)水沖洗干凈,-80 ℃保存備用。采樣結束后清洗傷口并涂抹碘伏消毒液。依據采集皮膚組織的顏色分為:(1)野生型個體或白斑個體,尾部皮膚組織為深棕色-深灰色(WT;圖1:A、B),共 5尾;(2)白斑黑化個體,背部皮膚為黃色,尾部皮膚組織大部分為黃色(aa;圖1:C),共3尾;(2)白斑黑化個體,背部皮膚為黃色,尾部皮膚組織為黑色(am;圖1:D),共3尾;(4)白斑黑化個體,背部及尾部皮膚組織上散布有白斑(ma;圖1:E),共4尾。
1.2 方法
1.2.1組織RNA的提取取0.2 g組織,在組織研磨器中研磨勻漿后,采用Trizol一步法提取總RNA,使用1.5%瓊脂糖凝膠電泳檢測總RNA的完整性,以Nano Drop2000核酸檢測儀測定RNA的濃度和純度。
1.2.2反轉錄用RevertAid cDNA Synthesize Kit(Fermentas,加拿大)反轉錄,反應體系:Total RNA 2 μg,OligodT(18)1 μL,5×buffer 2 μL,RNase抑制劑1 μL,10 mmol·L-1dNTP mix 1 μL,反轉錄酶1 μL,加DEPC水至20 μL。反應程序:42 ℃ 60 min,70 ℃ 2 min。-20 ℃保存備用。
1.2.3Agouti基因擴增及qPCR引物設計與合成
參照GenBank數據庫中西部錦龜Chrysemyspictabellii(登錄號:XM_005295463.3)和中華鱉Pelodiscussinensis(登錄號:XM_006131706.3)的Agouti基因序列,使用PrimerQuest(http://sg.idtdna.com/Primerquest/Home/IndexPrimer)設計特異性引物用于擴增Agouti基因的cDNA序列,并設計Agouti基因qPCR引物(表1)。

圖1 不同體色的大鯢Fig. 1 Different body colors of Andrias davidianus

表1 Agouti基因克隆引物及其與內參基因實時熒光定量引物Table 1 Primers used in this study
1.2.4Agouti基因的克隆以第一鏈cDNA為模板,使用大鯢Agouti基因特異性引物,進行PCR擴增。PCR反應體系為25 μL:1.0 μL 模板,2.5 μL 10×Taq buffer,2.5 mmol·L-1MgCl2,2.5 mmol·L-1dNTP,1 U TaqDNA polymerase (Fermentas,加拿大),上、下游引物各10 μmol·L-1。PCR反應程序:94 ℃ 4 min;35個循環(94 ℃ 30 s,65 ℃ 60 s,72 ℃ 120 s);72 ℃ 10 min。PCR擴增產物經1%瓊脂糖凝膠電泳檢測,純化、PEMG-Teasy載體連接、轉化后,選擇酶切鑒定正確的質粒,送南京金斯瑞生物科技公司測序。
1.2.5Agouti基因序列分析利用CAP3(http://biosrv.cab.unina.it/webcap3/)進行大鯢Agouti基因序列拼接;vecscreen(https://www.ncbi.nlm.nih.gov/tools/vecscreen/)去除載體序列,Open Reading Frame Finder(https://www.ncbi.nlm.nih.gov/orffinder/)推算開放閱讀框和編碼氨基酸序列。FeatureMap3D(http://www.cbs.dtu.dk/services/FeatureMap3D/)及SMART(http://smart.embl-heidelberg.de/)用于蛋白結構域的分析。ClustalW將大鯢Agouti氨基酸序列與GenBank中其他物種的Agouti氨基酸序列進行同源比對。
1.2.6qPCR分析大鯢Agouti基因的組織特異性表達以大鯢肌肉、皮膚、心臟、肝臟、脾、肺、胃、胰腺、生殖腺(卵巢/精巢)、腸組織cDNA為模板,使用大鯢Agouti基因qPCR引物,進行PCR擴增。反應體系為20 μL:cDNA 1 μL,10 nmol·μL-1dNTP 1 μL,10 μmol·L-1上、下游引物各0.75 μL,FastStart? SYBR Green qPCR Master Mix(Roche,德國)14.5 μL。PCR反應程序為:94 ℃ 1 min;40個循環(94 ℃ 18 s,62 ℃ 18 s,72 ℃ 20 s),85 ℃讀板。以GAPDH作為內參基因,并以1個不加模板的反應作為空白對照,每個反應設置3次重復。使用Excel和SPSS 16.0分析數據,以Agouti基因Ct值減相應GAPDH基因Ct值,得出Agouti基因的ΔCt,使用2-ΔΔCt計算Agouti基因的相對表達量。
1.2.7qPCR分析不同體色大鯢Agouti基因的特異性表達以WT、am、aa、ma 4種體色大鯢皮膚組織cDNA為模板,使用大鯢Agouti基因qPCR引物,進行PCR擴增。反應體系、反應程序和數據處理見1.2.6。
1.2.8Agouti基因多態性檢測分別以15尾不同體色大鯢皮膚組織cDNA為模板,使用Agouti基因特異性引物(表1)通過 PCR 擴增Agouti基因,送南京金斯瑞生物科技公司測序。使用ClustalW進行序列比對,分析多態位點。
2 結果與分析
2.1 RNA檢測
大鯢皮膚組織總RNA電泳圖顯示28S條帶亮度是18S亮度的2倍左右,說明提取的總RNA完整性和濃度較好,可用于下游實驗。
2.2 Agouti基因的全長克隆及序列分析
將皮膚組織總RNA反轉錄為cDNA,用設計的Agouti基因引物進行PCR擴增,電泳結果顯示擴增產物約1 000 bp(圖2)。經克隆、測序、拼接后得到大鯢Agouti基因cDNA全長為1 068 bp,其中編碼區長399 bp,編碼132個氨基酸(圖3),該序列已提交至NCBI(登錄號:MH748032)。通過在線軟件分析,發現大鯢Agouti基因編碼的蛋白N端含1~24個氨基酸殘基的信號肽,剪切位點位于第24~25位氨基酸,并在8~128位氨基酸具有保守的Agouti結構域。
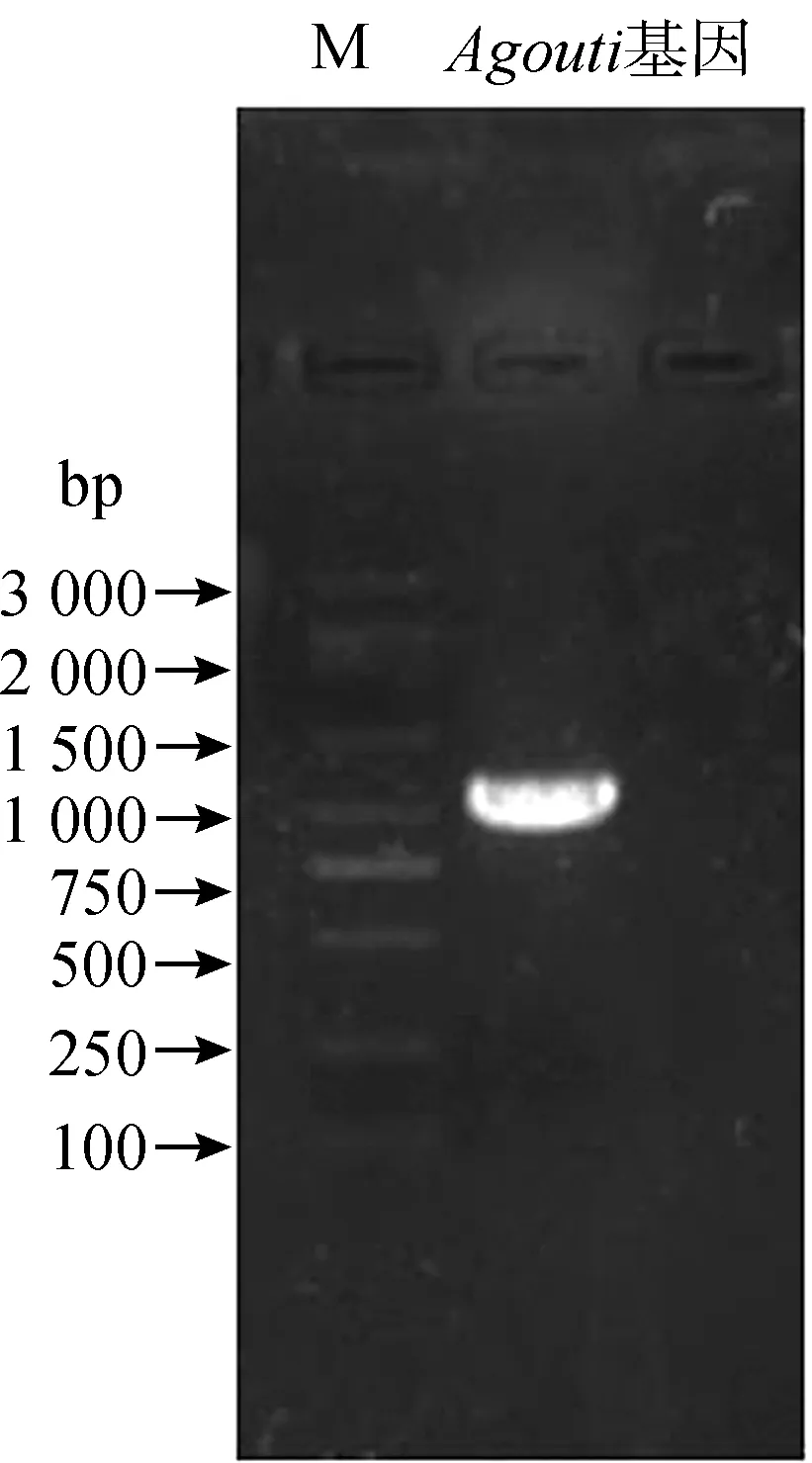
圖2 Agouti基因PCR擴增產物Fig.2 Electrophoresis of the PCR product of Agouti gene
2.3 Agouti蛋白同源性比較及系統進化樹構建
使用BioEdit的ClustalW對大鯢Agouti與其他物種氨基酸序列相似性進行多重比對(圖4),結果顯示,大鯢與高山倭蛙Nanoranaparkeri相似性最高,為59%,與其他爬行動物的相似性為50%~59%,與其他脊椎動物的相似性為38%~45%。采用鄰接法構建蛋白系統發育樹,結果顯示:大鯢與高山倭蛙的Agouti進化關系最近,聚為一支,之后與美國短吻鱷Alligatormississippiensis、中華鱉等爬行動物及虎皮鸚鵡Melopsittacusundulates等鳥類聚為一個大分支,與哺乳動物和魚類等其他脊椎動物聚為另一個大分支(圖5),這與ClustalW比對結果一致。

圖3 大鯢Agouti基因和編碼蛋白的序列Fig.3 The sequence of Andrias davidianus Agouti gene and the predicted amino acids
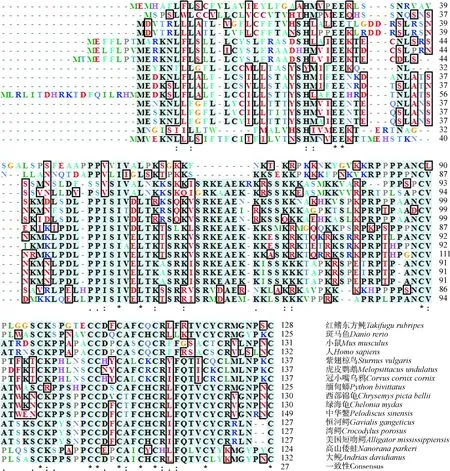
圖4 大鯢Agouti與其他物種同源分子的氨基酸序列比對Fig.4 Comparison of amino acid sequence of Agouti between Andrias davidianus and other species
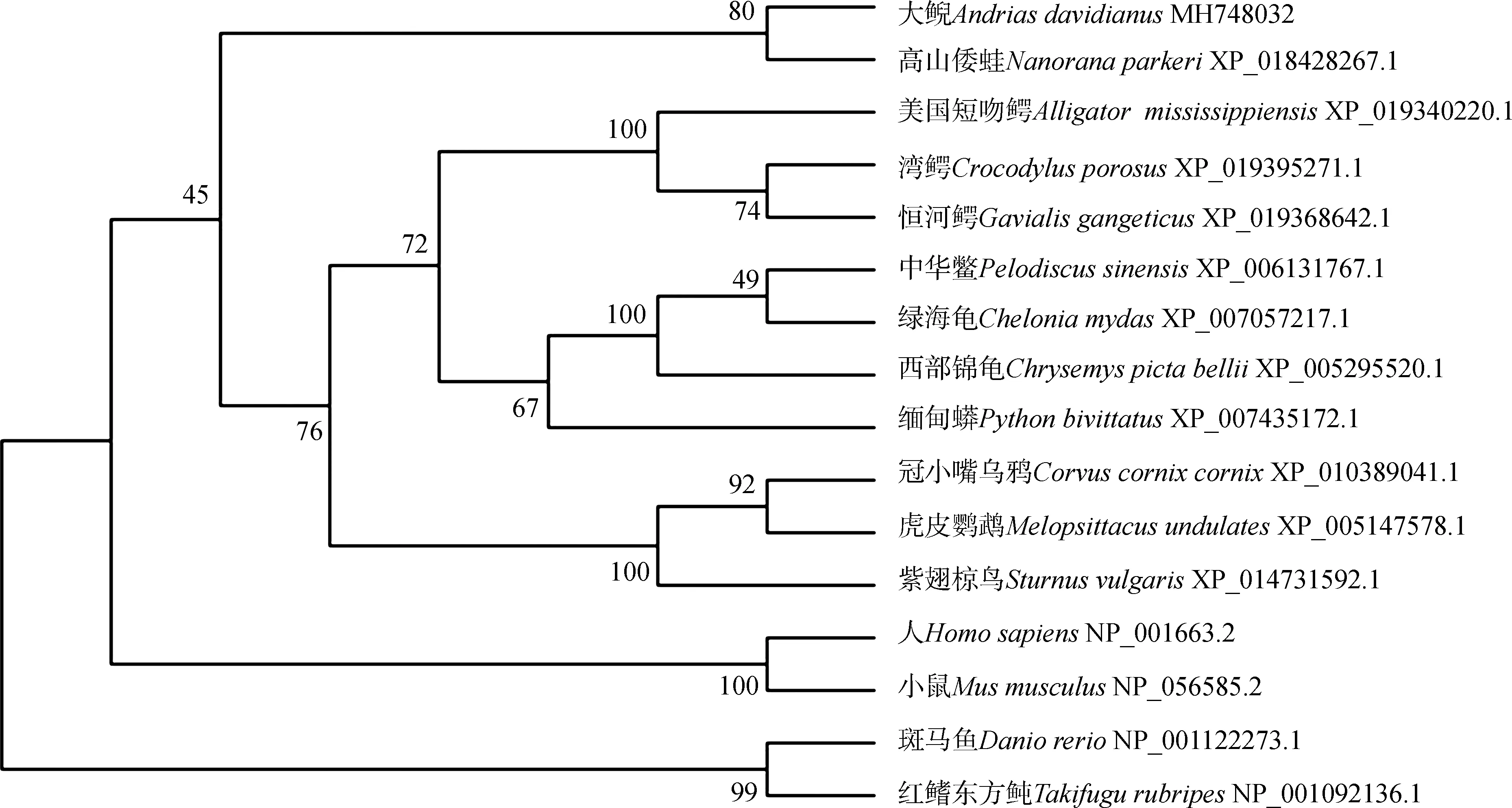
圖5 鄰接法構建的Agouti氨基酸序列系統發育樹Fig.5 Phylogenetic tree constructed by Neighbor-joining method using amino acid sequences of Agouti
2.4 Agouti基因的組織特異性表達
qPCR結果顯示,大鯢Agouti基因在10個組織和器官中均有表達(圖6)。在不同體色大鯢的皮膚組織中也均有表達(圖7),其中,在aa型中mRNA的表達量最高,其次為WT型和尾部皮膚為am型的個體,ma型個體皮膚組織中Agouti基因的表達量最低。
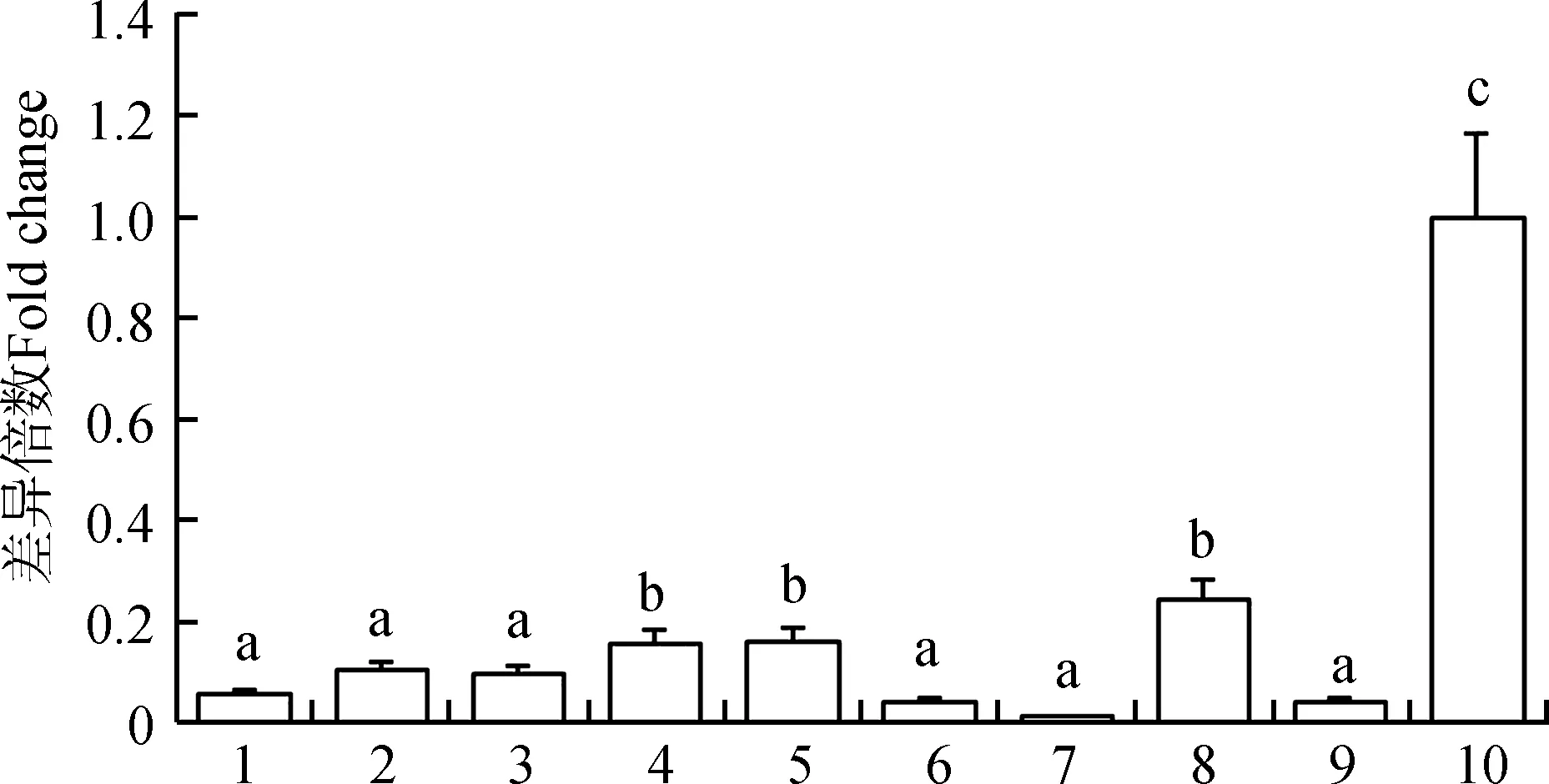
圖6 Agouti基因在大鯢器官、組織中的表達分布Fig.6 Expression of Agouti gene in different organs and tissues of Andrias davidianus
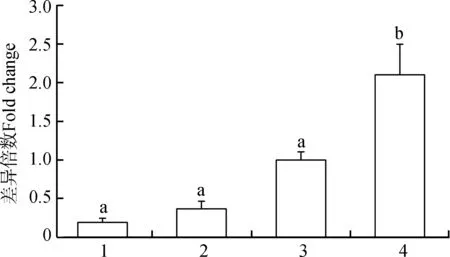
圖7 Agouti基因在不同體色大鯢皮膚組織中的表達Fig.7 Expression of Agouti gene in skins of Andrias davidianus with different skin colors
2.5 Agouti基因多態性分析
以15尾不同體色的大鯢皮膚組織RNA為模板,擴增Agouti基因共1 068 bp的核苷酸序列,序列比對結果顯示不同體色大鯢個體Agouti基因的核苷酸序列一致。
3 討論
不同物種的Agouti基因及其Agouti蛋白具有較高的同源性,人Homosapiens、小鼠Musmusculus、牛Bostaurus、馬Equuscaballus和山羊Caprahircus等的Agouti基因含有4個外顯子,其編碼的Agouti蛋白由131~133個氨基酸殘基組成(Bultmanetal.,1992;Kwonetal.,1994)。本實驗獲得的大鯢的Agouti基因cDNA序列長1 068 bp,開放閱讀框長399 bp,編碼132個氨基酸,包含1個保守的Agouti功能結構域。氨基酸系統發育分析顯示,大鯢和高山倭蛙聚成單獨的一個分支,與人、小鼠和魚類等其他動物分歧較大。
MC1R基因和Agouti基因是黑色素合成過程中最重要的調控基因。哺乳動物毛色(體色)的表型變化有毛色變黃或變白和黑化等類型。研究發現,這2種類型的變異主要是由MC1R基因和Agouti基因功能改變而導致的(Robbinsetal.,1993)。當MC1R基因沉默或者Agouti基因過表達時,黑色素細胞內黑色素的合成轉為合成褐黑素或受到較強的抑制,動物毛色(體色)呈現出黃色或者白色(Schiaffino,2010)。目前,已經鑒定出小鼠(Milleretal.,1993)、山羊(吳偉偉,2013;張天,2014)、綿羊Ovisaries(Norris & Whan,2008;Fontanesietal.,2009)、鵪鶉Coturnixcoturnix(Nadeauetal.,2008)等哺乳動物或鳥類黃色或者白色的毛色與Agouti基因的大量表達直接相關。實驗發現大鯢Agouti基因mRNA在黃色皮膚組織中的表達量較野生型(深棕色-深灰色)有大幅提高,這一結果表明大鯢Agouti基因的高表達可能與載黑素細胞的消失有一定的關系。
在本實驗中,約1/3的大鯢個體背部至尾部的皮膚出現黑化,這種體色上的變異在其他兩棲動物中亦有報道(Herczegetal.,2010),而毛色(膚色)黑化的個體在哺乳動物和鳥類中也普遍存在(Takeuchietal.,1996;Theronetal.,2001;Kambeetal.,2011)。動物毛色(膚色)的深淺與細胞內黑色素的合成量呈正相關。當MC1R基因持續表達或者Agouti基因表達缺失時,細胞內大量合成黑色素,動物毛色(膚色)變深。小鼠MC1R基因核苷酸序列發生280G>A的替代,使MC1R基因持續表達,產生了黑色變異個體(Kambeetal.,2011)。在本研究中,大鯢Agouti基因mRNA在am和ma 2種黑化型個體中的表達量均低于WT的表達水平,說明大鯢體色黑化的現象可能與Agouti基因的表達量降低有關。
本實驗對15尾不同體色大鯢Agouti基因編碼區序列多態性進行了研究,結果發現大鯢Agouti基因編碼區無突變位點。Agouti基因非轉錄區的多態性,能夠影響馬、山羊、綿羊、狐貍Vulpesvulpes等哺乳動物毛色的形成(Badaouietal.,2011;Hanetal.,2015;Jakubczaketal.,2016;Sakamotoetal.,2017)。大鯢Agouti基因的非編碼區是否存在序列變異還需進一步研究。另外,本實驗中大鯢Agouti基因mRNA除在皮膚中大量表達外,在胰腺、胃、肺、肝臟、腸、脾臟、生殖腺(卵巢/精巢)、心臟、肌肉中有較低水平的表達,這與人、鯉魚Cyprinuscarpio、紅原雞Gallusgallus等其他物種Agouti基因mRNA的組織表達情況類似(Dinulescu & Cone,2000;Yoshiharaetal.,2012)。
本實驗成功克隆了大鯢Agouti基因cDNA序列,進行了相關生物信息學分析,并對其在各組織中的表達和在不同體色個體皮膚組織中的表達進行了檢測,為進一步探討大鯢黑色素的代謝機理和體色形成機制奠定了基礎。

