繼代培養時間對抗性黑松體胚發生的影響
王艷麗 孫婷玉 沈李元 吳小芹 葉建仁 朱麗華
( 南京林業大學南方林業協同創新中心,林學院,江蘇 南京 210037)
松材線蟲病是由松材線蟲(Bursaphelenchus xylophilus)引起的一種毀滅性森林病害,主要危害松屬植物,對森林資源和生態環境造成了嚴重的威脅,大量研究表明,松材線蟲病抗性選育已成為防御松材線蟲病危害的重要途徑[1]。日本松材線蟲病抗性育種工作較為先進,先后2次對感病黑松(Pinus thunbergii)和赤松(Pinus densiflora)開展了抗性選育工作,最終篩選出了多個黑松、赤松抗性家系并建立抗病種子園[2]。江蘇省有害生物預防與控制重點實驗室于2004年從日本引進一批抗性種子材料,并建立了抗松材線蟲病黑松、赤松優良家系基因資源庫,但種質資源有限,遠不能滿足林業大規模生產的需要。因此建立優良無性系黑松的快繁體系具有重要意義。另外李清清等[3]已對抗松材線蟲病赤松組培苗進行了抗病性測定,抗性家系表現出一定的抗病性,朱麗華等也報道了赤松的微繁殖及其對線蟲的抗性[4]。
目前,抗性黑松體細胞胚胎發生及植株再生體系雖已經建立[5],但抗性黑松胚性愈傷組織誘導率較低,最高僅為7.8%[6],所以胚性愈傷彌足珍貴,胚性愈傷組織保持十分重要。植物組織培養過程中,繼代培養是其中重要的環節,而長期繼代則是種質資源離體保存的必要手段[7]。已有研究發現,植物細胞在離體培養時,再生頻率和再生植株的質量與培養時間密切相關[8]。隨著繼代次數的增加很多植物愈傷組織的分化率會呈下降趨勢[9],如梨 S 系矮化砧 (Picea wilsonii)[10]、葉毛棗(Ziziphsu mauritiana)[11]、杉木(Cunninghamia lanceolata)[12]、球根海棠(Begonia tuberhybrida)[13]以及一些落葉松屬的樹種[14-15]。也有研究表明,胚性愈傷組織的體胚發生能力是可以長期保持的,如白杄(Picea meyeri)的胚性愈傷組織繼代培養3 a其增殖能力和分化潛力仍保持在原來的水平,無明顯降低趨勢[16];青杄(Picea wilsonii)愈傷組織在適宜的繼代條件下,培養3 a繼代40次體細胞胚的分化率仍可達90%以上[17];此外,棉花(Gossypiumspp.)、玉米(Zea mays)等的胚性愈傷組織體胚發生能力也是能夠長期保持的[18-20]。在長期繼代中愈傷組織是否會保持一定的體胚發生和植株再生能力,這關系到組培快繁技術的實用化問題。國內外文獻雖見對黑松組培技術的相關研究,但有關黑松愈傷組織在長期繼代中分化能力的研究卻很少。因此,通過對抗性黑松胚性愈傷組織體胚發生及植株再生能力進行了研究,以培養0.5、1.5、3.5 a的胚性愈傷組織為材料,從細胞形態、愈傷組織增殖率、每克胚性愈傷形成的體胚數、以及獲得體胚的正常萌發率和植株成活率等方面,具體評估繼代培養時間對愈傷組織再生分化的影響,以期為抗性黑松體胚發生快繁體系中篩選出最佳的培養材料,提高組培苗的生產效率。
1 材料與方法
1.1 材料
黑松未成熟球果采集于抗松材線蟲病黑松優良家系基因資源庫(本課題組于2004年從日本良種繁育中心引進抗性種子材料建立[21]),當年從球果中剝離出未成熟合子胚并誘導出具有胚性的愈傷組織,愈傷組織的誘導方法見文獻[5-6]。誘導的抗性黑松37#家系胚性愈傷組織在DCR+2,4-D 0.5 mg/L+KT 0.1 mg/L和DCR+NAA 0.5 mg/L+6-BA 0.5 mg/L 2種增殖培養基交替培養,培養時間分別為0.5 a(繼代12次)、1.5 a(繼代36次)和3.5 a(繼代84次)。愈傷組織采用半固體增殖的培養方式,培養周期為15 d。
1.2 培養基
增殖培養基采用DCR基本培養基[22],添加麥芽糖15 g/L、肌醇1 g/L、谷氨酰胺0.5 g/L、酸水解干酪素0.5 g/L、維生素C 0.5 mg/L、2-(N-嗎啡啉)乙磺酸0.25 g/L、瓊脂(Agar)5.4 g/L。
成熟培養基采用LP為基本培養基[23],添加脫落酸(ABA)10 mg/L、赤霉素(GA3)0.5 mg/L、麥芽糖30 g/L、肌醇1 g/L、谷氨酰胺1.5 g/L、聚乙二醇(PEG 8000)130 g/L、活性炭(AC)1.5 g/L、植物凝膠(Phytagel)3.4 g/L。
萌發培養基采用1/2 LP,添加麥芽糖20 g/L、活性炭(AC)1 g/L、瓊脂(Agar)8 g/L。
誘導生根培養基采用WPM基本培養基[24],添加0.15 mg/L NAA、1 mg/L IBA、1 g/L活性炭和瓊脂5.4 g/L。
生長培養基采用1/4 WPM基本培養基(大量元素減少),添加硝酸銨5 mg/L、硼酸0.15 mg/L、蔗糖17.5 g/L、肌醇0.1 g/L、卡拉膠9 g/L。
所有培養基在滅菌前pH調至5.8,121 ℃高壓滅菌20 min。
1.3 實驗方法
1.3.1 細胞形態觀察
取少量抗性黑松愈傷組織置于載玻片上,滴1滴清水,用鑷子打散,采用醋酸洋紅和伊文思藍雙染色法染色(先用1%醋酸洋紅染色,后滴加0.05%伊文思藍),加蓋玻片吸去多余染液,然后將臨時裝片置于蔡司體式顯微鏡下觀察愈傷組織的細胞結構。
1.3.2 指標測定
增殖率:稱取一定量抗性黑松胚性愈傷組織(M1),在DCR半固體增殖培養基上生長15 d,稱取愈傷組織質量(M2),愈傷組織增殖率=(M2-M1)/M1×100%。
每克胚性愈傷組織發育形成成熟體細胞胚數量:將一定量的增殖愈傷轉入LP成熟培養基,2個月后統計形成的體胚數。以每克愈傷組織形成的成熟胚數量作為衡量細胞產胚能力的主要參數。每克愈傷組織形成成熟胚數量的測定:稱取一定量愈傷組織放入成熟培養基,2個月后統計每培養皿成熟培養基的體胚數。每培養皿3團胚性愈傷組織,每團1 g,3個重復。每克胚性愈傷組織形成的成熟體細胞胚數量=愈傷組織出胚數(個)/愈傷組織質量(m)。在此期間,記錄愈傷組織形成成熟體細胞胚的時間。
體胚萌發率、畸形率、死亡率:將成熟培養基所得的成熟體細胞胚水平放置1/2 LP萌發培養基上,每皿15個胚,3個重復,非直射光照培養5 d,再轉直射光照培養25 d后統計體胚的萌發情況。萌發率(%)=萌發正常體胚個數/接種體細胞胚個數×100%;畸形率(%)=畸形體胚個數/接種體細胞胚個數×100%;死亡率(%)=死亡體胚個數/接種體細胞胚個數×100%。
植株成活率:將正常萌發的植株轉入誘導生根培養基中,生長1個月后形成根、莖、葉完整的再生植株。再將植株轉入加WPM營養液,V(蛭石)∶V(珍珠巖)為2∶1的基質中。2個月后統計植株成活率。每個處理15棵植株,3個重復。植株成活率=成活株數/接種株數×100%。
1.3.3 培養條件及數據處理
培養溫度設定為(23±1)℃,光照強度為3000 lx,愈傷組織誘導、增殖和成熟階段均為暗培養方式,萌發及生根壯苗階段采用光培養方式(光照16 h,黑暗8 h)。數據采用Excel處理,用SPSS19.0軟件進行方差分析和差異顯著性檢驗。
2 結果與分析
2.1 繼代培養時間對愈傷組織形態的影響
在繼代培養過程中,肉眼可見細胞團結構逐漸疏松。顯微觀察發現,培養0.5、1.5 a和3.5 a的細胞團均具有胚性胚柄細胞團(ESM)結構(圖1)。繼代培養0.5 a的胚性愈傷組織形態一致性較好,胚柄纖長,染成紅色的胚頭部分(染色體或染色質)在整個結構中所占面積較大,細胞核物質豐富,細胞排列緊密(圖1a)。繼代培養1.5 a的胚性愈傷組織細胞結構,長型的胚柄細胞結構明顯增長,胚頭部分減少,細胞排列緊密(圖1b)。培養3.5 a的胚性愈傷組織細胞胚頭結構比培養0.5 a和1.5 a的細胞胚頭結構松散,胚頭結構明顯減少,胚柄細胞縮短變粗,細胞結構一致性差,出現細胞形態紊亂的現象。另外在培養3.5 a的胚性愈傷組織中,我們還發現不少無胚頭結構的空泡細胞(圖1c)。
2.2 繼代培養時間對愈傷組織增殖的影響
由圖2可知,繼代培養0.5 a和1.5 a的胚性愈傷組織的增殖率分別為200.37%和182.47%,增值率下降不顯著(P>0.05)。而繼代3.5 a的胚性愈傷組織雖然仍有一定的增殖能力,但是胚性愈傷組織增殖率(111.63%)較培養0.5 a和1.5 a的胚性愈傷組織顯著下降(P<0.05)。由此可知,隨著培養時間的增長,胚性愈傷組織的增殖能力呈下降趨勢。培養1.5 a以內的胚性愈傷組織較適于繼代增殖培養。
2.3 繼代培養時間對愈傷組織體細胞胚成熟的影響
2.3.1 愈傷組織體胚分化至各階段的時間差異
將繼代培養0.5、1.5、3.5 a的愈傷組織在DCR增殖培養基上繼代1個周期(15 d)后,選取生長狀態較好的愈傷(圖3a)轉至成熟培養基中,于蔡司體式顯微鏡下觀察發現,愈傷慢慢開始聚攏,逐漸干燥,愈傷表面抽出的絲狀結構慢慢增粗(圖3b)。一段時間后,愈傷組織表面出現肉眼可見的柱狀胚伸出,至柱狀胚早期階段(圖3c)。之后,柱狀胚逐漸伸長、增粗、顏色白或黃,至柱狀胚階段(圖3d)。柱狀胚頂端清晰可見子葉形狀至子葉胚前期階段(圖3e)。子葉胚顏色(顏色白或黃)加深,子葉伸長,收攏或張開,形狀基本保持不變,形成成熟子葉胚(子葉胚階段)(圖3f)。

圖1 抗性黑松不同培養時間胚性愈傷組織的形態觀察Fig. 1 Morphology of embryogenic callus with subculture times of nematode-resistant P. thunbergii
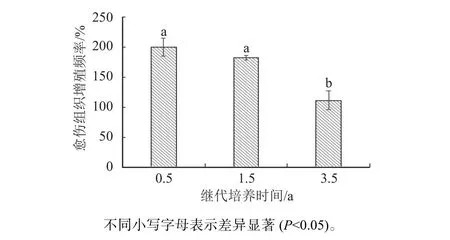
圖2 不同繼代培養時間愈傷組織的增值率Fig. 2 Proliferation rate of callus vary with subculture time
觀察愈傷組織體胚分化成熟過程發現,不同繼代培養時間的愈傷組織分化至體胚各階段的時間存在差異(表1)。培養0.5 a的胚性愈傷組織在18 d觀察到肉眼可見的柱狀胚前期階段,而培養1.5 a和3.5 a的胚性愈傷組織分別在21 d 和25 d觀察到該現象。在隨后的發育過程中,培養0.5 a的胚性愈傷組織達到柱狀胚階段、子葉胚前期階段和子葉胚階段分別用了26、32、46 d;而1.5 a的胚性愈傷組織分別用了30、40、63 d;3.5 a的胚性愈傷組織發育更為緩慢,達到柱狀胚階段、子葉胚前期階段和子葉胚階段分別用了38、55、74 d,培養時間越長體胚成熟所需時間越長,體胚發育能力越弱。因此認為,隨著培養時間的延長,胚性愈傷組織細胞在逐漸老化,以致于不同培養時間的愈傷組織形成體胚的時間不一致。

圖3 抗性黑松體細胞胚成熟觀察Fig. 3 Developmental stages of somatic embryo of nematode-resistant P. thunbergii
2.3.2 培養時間對胚性愈傷組織產胚數量的影響
每克愈傷形成的體胚數量統計結果見圖4。
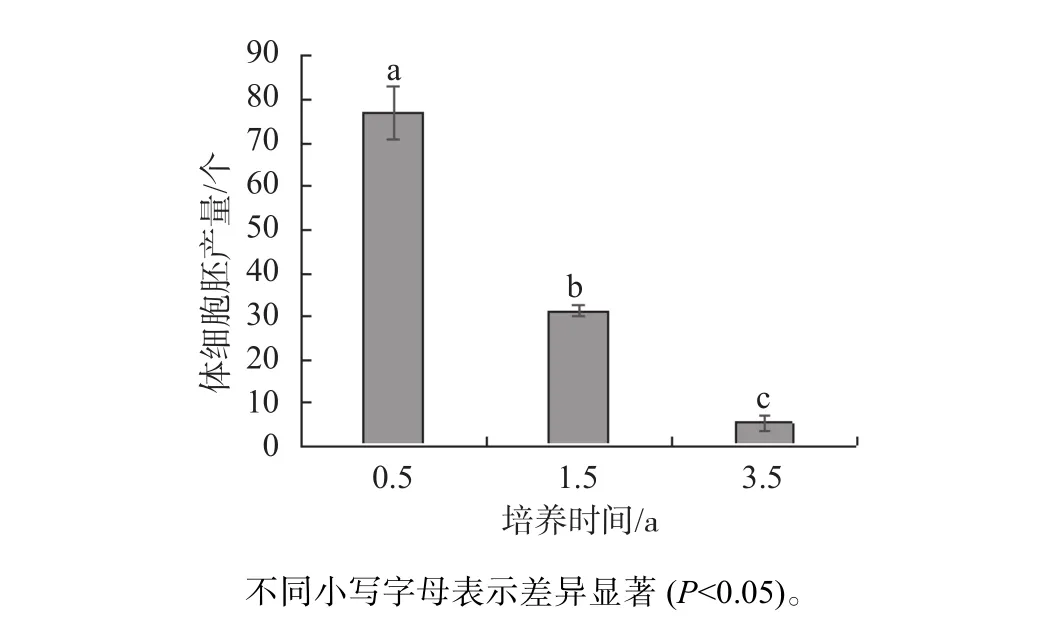
圖4 每克愈傷形成的體胚數量Fig. 4 Somatic embryos yiels of per gram callus
由圖4可知,不同培養時間的胚性愈傷組織體胚分化能力差異顯著,培養0.5 a胚性愈傷組織每克可生產77個體細胞胚;而培養1.5 a每克可生產31個體細胞胚;培養3.5 a每克可生產5個體細胞胚。培養1.5 a的胚性愈傷組織產胚能力較培養0.5 a的胚性愈傷組織顯著(P<0.05)下降;培養3.5 a的胚性愈傷組織產胚能力較培養0.5 a和1.5 a的胚性愈傷組織均顯著(P<0.05)下降。因此,認為短期(0.5 a)培養的胚性愈傷組織較1.5 a和3.5 a培養時間的胚性愈傷組織更容易誘導產生體細胞胚,但隨著培養時間的延長,胚性細胞的分化能力會降低。
2.4 繼代培養時間對體胚萌發與再生植株成活的影響
培養時間對體胚萌發及生長的影響結果見圖5,體胚萌發及植株生長發育情況見圖6。培養0.5 a的胚性愈傷組織的體胚萌發率為84.5%,再生植株的成活率為73.3%;而培養1.5 a和3.5 a的胚性愈傷組織的萌發率分別為51.1%和11.1%,再生植株的成活率分別為50.0%和6.7%。培養3.5 a的胚性愈傷組織的萌發率和植株成活率較培養1.5 a的胚性愈傷組織顯著(P<0.05)下降;并且培養1.5 a的胚性愈傷組織的萌發率和植株成活率較培養0.5 a的胚性愈傷組織也呈顯著(P<0.05)下降趨勢。但是,研究發現隨著培養時間的增長,畸形率和死亡率呈上升趨勢。培養0.5 a的胚性愈傷組織的畸形率為8.9%,死亡率為6.9%;而培養1.5 a和3.5 a的胚性愈傷組織的畸形率分別為26.7%和37.8%,死亡率分別為22.3%和40.0%。研究顯示體細胞胚的萌發和再生植株成活率隨培養時間的增長呈顯著下降,而萌發的畸形率與死亡率隨培養時間的增長則呈顯著上升趨勢。
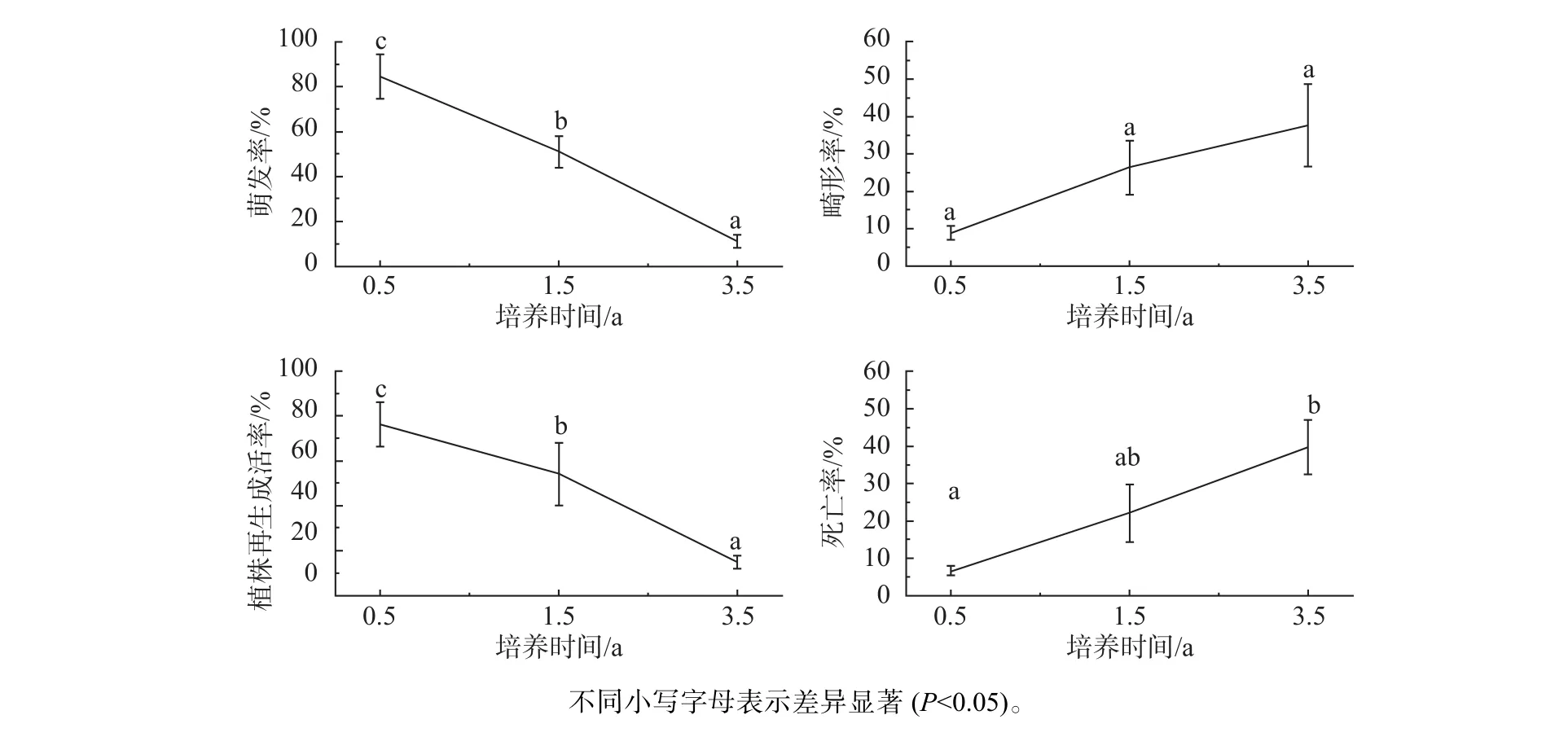
圖5 培養時間對體胚萌發及生長的影響Fig. 5 The effects of sub-culture time on germination and growth of regenerated plant

圖6 抗性黑松體胚萌發及植株的生長發育Fig. 6 Somatic embryo germination and plant growth of somatic embryos of nematode-resistant P. thunbergii
3 結論與討論
目前,許多學者對松樹的組織培養進行了相關研究,也取得了一定進展。2015—2017年,本實驗室先后報道了抗性黑松[5-6]、抗性赤松的體胚發生[21,25],但至今抗性黑松的體胚發生仍存在一些問題,如胚性愈傷組織的誘導率較低,獲得胚性愈傷組織材料極為有限,所以胚性愈傷組織的保持與維持就顯得極為重要。
先前的研究發現:在胚性胚柄細胞團(ESM)結構中,胚柄是由胚頭基部的分生組織細胞分裂、分化而成的,它對胚頭可提供結構上的支持和吸收營養物質的作用,也是合成生長調節物質和儲存一些產物的場所[26]。然而在長期的繼代培養過程中,發現愈傷組織的胚頭結構會減少,胚柄細胞也出現縮短增粗的現象。胚性愈傷組織形態結構的變化很可能會導致愈傷胚性能力的退化。這與都小龍等對吉粳88愈傷組織細胞形態結構發生變化的研究中報道相似[27]。
胚性愈傷組織是由胚柄和大量胚性細胞團以及原胚組成的,所以本身就具有一定的分裂能力,可以保持一定的增殖能力。但是研究中發現抗性黑松胚性愈傷組織增殖率隨著培養時間的增長而降低,這可能與顯微觀察發現胚頭減少,胚性細胞與原胚團降低有關。在對白云杉(Picea glauca)、黑云杉(Picea mariana)[28-29]、青杄[17]及思茅松(Pinus kesiyavar.langbianensis)[30]的研究中,也觀察到了相似的現象。因此認為在胚性細胞的增殖培養時間不宜過長,最好不要超過1.5 a。且在增殖過程中,要及時將細胞形態一致性較好的胚性愈傷組織保存。
在培養時間對體胚產量的研究中發現培養0.5 a的愈傷組織產胚能力較強,每克可生產77個體細胞胚,而培養3.5 a的愈傷僅為5個。隨著培養時間的增長,每克愈傷產胚數量呈顯著(P<0.05)下降趨勢。另外,培養0.5 a的胚性愈傷組織形成子葉胚的時間為46 d,培養1.5 a胚性愈傷組織需要63 d,而培養3.5 a的胚性愈傷組織需要74 d,培養0.5 a的胚性愈傷組織形成子葉胚的時間要比培養3.5 a的胚性愈傷組織縮短28 d,培養時間越長體胚成熟過程越慢。這可能與胚性愈傷組織形態紊亂,胚頭比例下降,胚性逐漸喪失有關。在對杉木(Cunninghamia lanceolata)、海棠(Malusspp.)以及毛葉棗(Ziziphsu mauritiana)的研究中也有發現胚性愈傷組織在長期繼代過程中會出現形態發生能力喪失的現象[9-15]。研究證實了在松屬樹種中這個現象仍然存在。另外,研究發現培養時間對體胚萌發和再生植株的成活也具有非常大的影響。培養1.5 a的胚性愈傷組織的萌發率(51.1%)和植株成活率(50.0%)較培養0.5 a的胚性愈傷組織的萌發率(84.5%)和植株成活率(73.3%)顯著下降;培養3.5 a的胚性愈傷組織的萌發率(11.1%)和植株成活率(6.7%)較培養1.5 a的胚性愈傷組織也呈顯著下降趨勢。而隨著培養時間的增長,萌發的畸形率和死亡率則由8.9%和6.9%上升到37.8%和40.0%(圖5)。體胚的萌發和再生植株成活率都隨著培養時間的延長顯著下降,而萌發的畸形率與死亡率與培養時間則呈顯著上升趨勢。這與薛美鳳等對棉花胚性愈傷組織長期繼代的結果相一致[8]。
因此,隨著繼代培養時間的增長,胚性愈傷組織的增殖能力、產胚能力以及體胚萌發和再生植株成活能力均下降,而萌發的畸形率和死亡率在逐漸增加。因此,在抗性黑松體胚發生過程中要及時對培養的胚性愈傷組織進行更新換代,以保持體胚發生良好的原始材料;在胚性愈傷組織培養過程中要對胚性細胞形態進行及時的跟蹤觀察,確保細胞的形態維持良好;短期培養的胚性愈傷組織(0.5 a)為抗性黑松體胚發生較為理想的初始材料,且愈傷組織繼代培養時間不宜超過1.5 a。

