解析探究性試題 培育學科核心素養
浙江 方大學
科學探究活動是學生學習化學的一種方式,科學探究是化學學科核心素養的重要組成部分。《普通高中化學課程標準》(2017年版)給化學探究活動提出了明確的要求,即認識科學探究是進行科學解釋和發現、創造和應用的科學實踐活動;能發現和提出有探究價值的問題;能從問題和假設出發,依據探究目的設計并優化實驗方案,完成實驗操作,能對觀察記錄的實驗信息進行加工并獲得結論;能和同學交流實驗探究的結果,提出進一步探究或改進的設想;能尊重事實和證據,破除迷信,反對偽科學;養成獨立思考、敢于質疑和勇于創新的精神。
探究型試題涉及的知識一般為課內知識,其中注重的是真實情境下研究問題、分析問題的過程和方法,設問點可以是問題的名稱,信息、數據整合與應用,實驗過程的完善、分析、比較、評價和改進,對給出實驗現象的解釋(尤其是異常現象的解釋),根據實驗對未知實驗現象的大膽預測等。隨著課程改革和高考改革的進行,培養學生終身學習的能力、信息搜集與數據整合的應用能力、探究能力將越來越被重視。現結合高考試題對探究型試題的命題基本原則、呈現過程、常見題型進行分析。
一、基本原則
(1)真實性原則:所設計的情境應該源于真實的生產、生活、實驗,不能憑空捏造。情境和有價值的實驗密切關聯,體現探究性和實用性。
(2)科學性原則:要想某個實驗更能夠說明問題,一般要設計一個對照性的實驗;所設計的實驗中的平行反應,試劑的取用應該是等量的;對多因素影響的實驗,要研究某個因素的影響,要人為控制條件,使眾多變量中,只能在單因子的變量條件下探究等。
(3)體驗性原則:讓學生經歷探究的全過程或某些關鍵環節,再現一個從困頓到澄明的問題解決過程,在解題過程中認識到科學探究是進行科學解釋和發現、創造和應用的科學實踐活動,達到有效評價學生探究素養的目的。
二、探究過程
科學探究過程包括提出問題和假設、設計方案、實施實驗、獲取證據、分析解釋或建構模型、形成結論及交流評價等核心要素。教師應指導學生從問題和假設出發,明確研究目的,依據研究目的設計方案,基于證據進行分析和推理。
三、常見題型
1.數據圖形分析探究型:(2017·北京·26·節選)TiCl4是由鈦精礦(主要成分為TiO2)制備鈦(Ti)的重要中間產物,制備純TiCl4的流程如圖1:
圖1
資料:TiCl4及所含雜質氯化物的性質
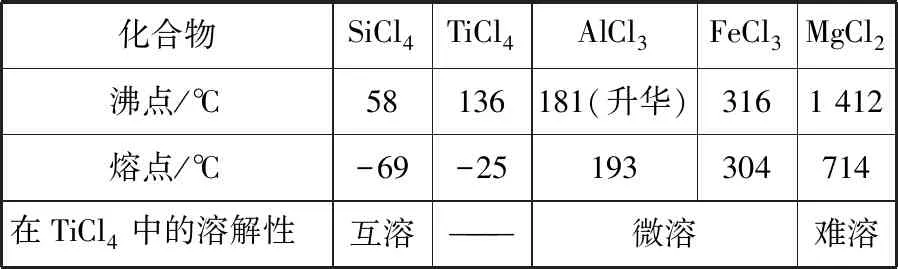
化合物SiCl4TiCl4AlCl3FeCl3MgCl2沸點/℃58136181(升華)3161 412熔點/℃-69-25193304714在TiCl4中的溶解性互溶———微溶難溶
(1)氯化過程:TiO2與Cl2難以直接反應,加碳生成CO和CO2可使反應得以進行。
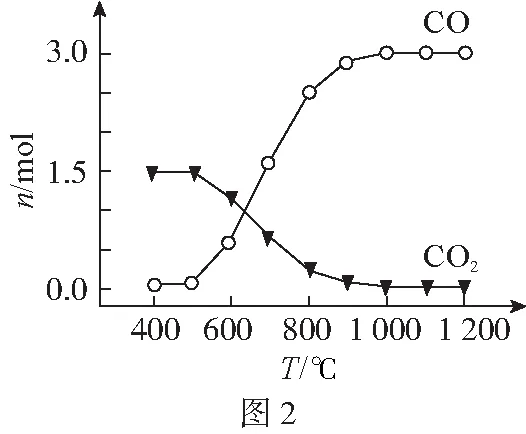
①沸騰爐中加碳氯化生成TiCl4(g)和CO(g),氯化過程中CO和CO2可以相互轉化,根據圖2判斷:CO2生成CO反應的ΔH________(填“>”“<”或“=”)0,判斷依據:_______。
②氯化產物冷卻至室溫,經過濾得到粗TiCl4混合液,則濾渣中含有________。
(2)精制過程:粗TiCl4經兩步蒸餾得純TiCl4。如圖3所示:
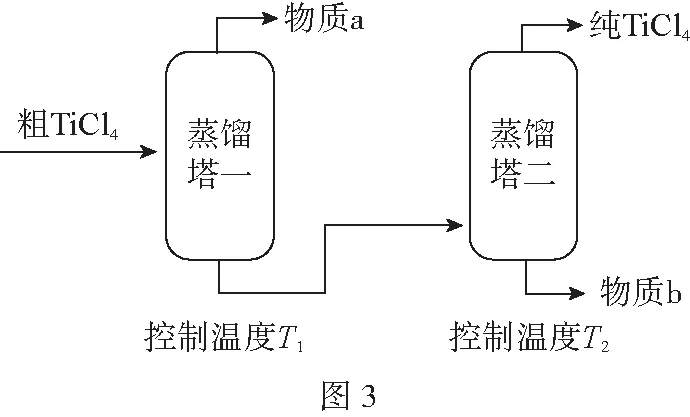
物質a是____________,T2應控制在____________。
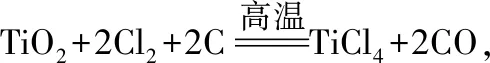
【點評】本題考查物質的制備實驗,為高頻考點,把握流程中發生的反應、混合物分離提純為解答的關鍵,側重分析與實驗能力的考查,注意反應原理與實驗的結合。
備考建議:(1)觀察數據、圖形要全面、仔細;(2)結合原有知識,分析角度要全面;(3)影響變量要遵循“多定一變”的原則。
2.實驗方案選擇評價型:(2017·江蘇·19)某科研小組采用如圖4方案回收一種光盤金屬層中的少量Ag(金屬層中其他金屬含量過低,對實驗的影響可忽略)。
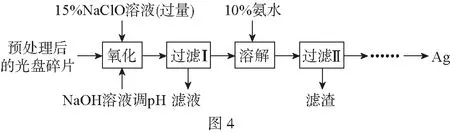


(1)“氧化”階段需在80℃條件下進行,適宜的加熱方式為____________。
(2)NaClO溶液與Ag反應的產物為AgCl、NaOH和O2,該反應的化學方程式為____________。
HNO3也能氧化Ag,從反應產物的角度分析,以HNO3代替NaClO的缺點是____________。
(3)為提高Ag的回收率,需對“過濾Ⅱ”的濾渣進行洗滌,并____________。
(4)若省略“過濾Ⅰ”,直接向冷卻后的反應容器中滴加10%氨水,則需要增加氨水的用量,除因過量NaClO與NH3·H2O反應外(該條件下NaClO3與NH3·H2O不反應),還因為____________。
(5)請設計從“過濾Ⅱ”后的濾液中獲取單質Ag的實驗方案:____________(實驗中須使用的試劑有:2 mol·L-1水合肼溶液,1 mol·L-1H2SO4)。

(1)“氧化”階段需在80℃條件下進行,不超過水的沸點,則適宜的加熱方式為水浴加熱,故答案為水浴加熱。

(3)為提高Ag的回收率,需對“過濾Ⅱ”的濾渣進行洗滌,并將洗滌后的濾液合并入過濾Ⅱ的濾液中,減少Ag的損失。故答案為將洗滌后的濾液合并入過濾Ⅱ的濾液中。
(4)若省略“過濾Ⅰ”,直接向冷卻后的反應容器中滴加10%氨水,則需要增加氨水的用量,除因過量NaClO與NH3·H2O反應外(該條件下NaClO3與NH3·H2O不反應),還因為未過濾掉的溶液會稀釋加入的氨水,且其中含有一定濃度的Cl-,不利于AgCl與氨水反應。故答案為未過濾掉的溶液會稀釋加入的氨水,且其中含有一定濃度的Cl-,不利于AgCl與氨水反應。
(5)由信息③可知,從“過濾Ⅱ”后的濾液中獲取單質Ag的實驗方案為向濾液中滴加2 mol·L-1水合肼溶液,攪拌使其充分反應,同時用1 mol·L-1H2SO4溶液吸收反應中放出的NH3,待溶液中無氣泡產生,停止滴加,靜置、過濾、洗滌、干燥。故答案為向濾液中滴加2 mol·L-1水合肼溶液,攪拌使其充分反應,同時用1 mol·L-1H2SO4溶液吸收反應中放出的NH3,待溶液中無氣泡產生,停止滴加,靜置、過濾、洗滌、干燥。
【點評】本題考查混合物分離提純,為高頻考點,把握流程中發生的反應、混合物分離提純方法、實驗技能為解答的關鍵,側重分析能力和實驗能力的考查,注意信息的應用及實驗設計。
備考建議:(1)根據題的要求,利用自己的知識,仔細分析流程圖中每步操作的實驗原理和物料進出。(2)對實驗方案優劣評價的角度常見有綠色化學(環保)、原子經濟、實驗條件的可行性等。

向硝酸酸化的0.05 mol·L-1硝酸銀溶液(pH≈2)中加入過量鐵粉,攪拌后靜置,燒杯底部有黑色固體,溶液呈黃色。
(1)檢驗產物
①取少量黑色固體,洗滌后,(填操作和現象),證明黑色固體中含有Ag。
②取上層清液,滴加K3[Fe(CN)6]溶液,產生藍色沉淀,說明溶液中含有。
(2)針對“溶液呈黃色”,甲認為溶液中有Fe3+,乙認為鐵粉過量時不可能有Fe3+,乙依據的原理是(用離子方程式表示)。針對兩種觀點繼續實驗:
①取上層清液,滴加KSCN溶液,溶液變紅,證實了甲的猜測。同時發現有白色沉淀產生,且溶液顏色變淺、沉淀量多少與取樣時間有關,對比實驗記錄如下:

序號取樣時間/min現象ⅰ3產生大量白色沉淀;溶液呈紅色ⅱ30產生白色沉淀,較3 min時量少;溶液紅色較3 min時加深ⅲ120產生白色沉淀,較30 min時量少;溶液紅色較30 min時變淺
(資料:Ag+與SCN-生成白色沉淀AgSCN)
②對Fe3+產生的原因作出如下假設:
假設a:可能是鐵粉表面有氧化層,能產生Fe3+;
假設b:空氣中存在O2,由于(用離子方程式表示),可產生Fe3+;
假設d:根據現象,判斷溶液中存在Ag+,可產生Fe3+。
③下列實驗Ⅰ可證實假設a、b、c不是產生Fe3+的主要原因。實驗Ⅱ可證實假設d成立。
實驗Ⅰ:向硝酸酸化的溶液(pH≈2)中加入過量鐵粉,攪拌后靜置,不同時間取上層清液滴加KSCN溶液。3 min時溶液呈淺紅色,30 min后溶液幾乎無色。
實驗Ⅱ:裝置如圖。其中甲溶液是________,操作及現象是________。
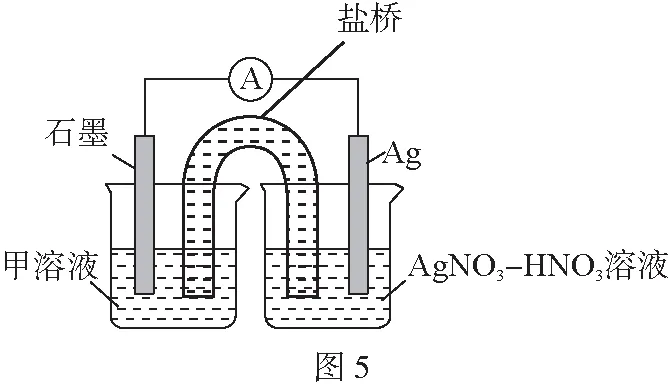
(3)根據實驗現象,結合方程式推測實驗ⅰ~ⅲ中Fe3+濃度變化的原因:________。

【點評】本題涉及物質的性質探究,側重于學生的分析能力和實驗能力的考查,注意把握物質的性質以及實驗的嚴謹性和可行性的評價。
備考建議:(1)對于題中的異常現象要根據自己的原有知識進行大膽的排查、推測。(2)推測的正確性要靠實驗來驗證,如果題中給出驗證實驗,要仔細分析其是否合理;如果題中沒給出驗證實驗,自己要設計合理的實驗驗證。


