天山1號冰川前緣土壤中光合細菌的分離鑒定及氮轉化能力分析
劉珍珠,樊 振,高 雁,李玉國,劉歡歡,3,馬貴軍,婁 愷,劉建偉,晁群芳,曾 軍*
(1.新疆農業科學院微生物應用研究所,新疆 烏魯木齊 830091;2.新疆特殊環境微生物實驗室,新疆 烏魯木齊 830091;3.新疆大學生命科學與技術學院,新疆 烏魯木齊 830046;4.新疆天康飼料科技有限公司生物添加劑分公司,新疆 烏魯木齊 830013;5.烏魯木齊膳源生態農業有限公司,新疆 烏魯木齊 830037)
【研究意義】冰川前緣原生裸地是冰川退縮后暴露的一類營養匱乏,無植物生長,貧瘠的土壤[1]。大量研究表明土壤中氮含量是這種貧瘠土壤發育,微生物原生演替主要驅動力和限制性因素[2]。【前人研究進展】本實驗室前期通過分子生物學技術對天山1號冰川前緣土壤中氮循環功能微生物的原生演替進行了研究,結果發現該冰川前緣土壤中存在大約5 %~10 %紫色非硫光合細菌(例如,類球紅桿菌和沼澤紅假單胞菌)[1-2]。紫色非硫光合細菌(Non-sulfur Purple potosynthetic bacteria,P,SB)因其能夠在黑暗有氧和光照厭氧條件下進行固碳、降解大分子有機物、固氮、硝化、反硝化和硫化物氧化等代謝,而被廣泛的應用于各種有機含氮廢水處理[3]。其中,類球紅桿菌和沼澤紅假單胞菌是PSB中目前最為廣泛使用的菌株,全基因組測序結果顯示這兩種細菌包含固氮(nifH)和反硝化基因(nirK)[4],這表明其在氮循環過程中可能起到獨特的作用。【本研究的切入點】本研究通過對冰川前緣土壤進行光合細菌定向富集、分離與純化、以其能夠分離得到可培養菌株,通過對其生理生化和氮轉化(氨氮和硝酸鹽降解以及亞硝酸鹽的生成)能力進行研究。【擬解決的關鍵問題】為揭示冰川前緣土壤氮素循環提供模式菌株以及為環境有機污染物降解和修復提供優良菌株。
1 材料與方法
1.1 供試材料
菌種來源:光合細菌分離自新疆天山1號冰川退縮后新暴露出的土壤(43°06′N, 86°49′E))。培養基:富集培養基為RCVBN培養基[5]:乙酸鈉3 g;丙酸鈉1 g;硫酸銨1 g;硫酸鎂0.2 g;氯化鈉1.0 g;磷酸二氫鉀0.3 g;磷酸氫二鉀0.5 g;氯化鈣0.05 g;酵母膏0.1 g;微量元素1 mL;蒸餾水1000 mL;pH 7.0。分離、純化培養基:RCVBN固體培養基,添加1.5 %瓊脂。儀器:超凈工作臺(SW-CJ-2FD)、滅菌鍋(YXQ-LS-75)、紫外分光光度計(UV-2550)、pH儀(多參數測試儀S220)、電子天平(JY20002)、離心機(20PR-52)。
1.2 試驗方法
1.2.1 光合細菌的富集 稱取5 g冰川前緣土壤加入至250 mL 的錐形瓶中,加入滅菌的液體RCVBN培養基至瓶口,使用無菌的液體石蠟封口隔絕空氣,放入25 ℃的光照強度為3000~5000 lx的培養箱中靜置培養。觀察瓶中培養基是否出現明顯的紅色,粉紅色或黃色。待培養基變色后重復2~3次轉接,直到瓶中光合細菌占明顯優勢后,進行下一步平板分離和純化。
1.2.2 光合細菌的分離與純化 采用雙層瓊脂平板法,按照10倍逐級稀釋富集液,將10-5,10-6兩個梯度的稀釋液用移液槍吸取100 μl于固體RCVBN平板上,用涂布棒均勻涂布,室溫放置30 min,待菌液被培養基吸收完畢后,平鋪一層無菌液體瓊脂封閉,其凝固后,將平板置于30 ℃光照強度為3000~5000 lx的培養箱中培養。待平板中長出紫色菌落后,挑取不同生長速度的單菌落進行純化。
1.2.3 分離純化菌株生長形態觀察 在純化培養基上對已純化的光合細菌菌株進行菌落形態觀察,革蘭氏染色和顯微鏡觀察。
1.2.4 活細胞吸收光譜測定 取培養7 d的菌液5 mL加入到離心管中,8000 r/min離心10 min,棄上清,加入無菌生理鹽水反復洗滌2次并離心,棄上清,加入60 %蔗糖溶液充分溶解后定容至10 mL,以60 %蔗糖溶液為空白對照,在波長300~900 nm范圍內測定吸光值,繪制吸光度曲線。
1.2.5 生長性能測定 為研究其生長規律,測定光合細菌的生長曲線。取容量為2.5 L的透明塑料袋,置于超凈工作臺下開紫外殺菌3 h,加入2 L滅菌后的液體培養基,隨后挑取純化后的單菌落加入液體培養基中,混勻。將透明塑料袋中的空氣排空后封口。培養方法同1.2.2,每24 h超凈工作臺中吸取菌液10 mL使用紫外分光光度計測量吸光度值。
1.2.6 最適生長pH測定 將純化后單菌落的菌液分別取1 mL加入到液體培養基中,調節pH梯度分別為5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0進行培養。每隔24 h取樣測量OD600nm值,共培養7 d。
1.2.7 分子生物學鑒定 結合16S rDNA基因序列比對分析進行鑒定。上游引物27F: 5’-AGAGTTT GATCCTGGCTCAG-3’,下游引物1492R: 5’-GGT-TACCTTGTTACGACTT-3’。擴增體系(50 μl): 上下游引物各1 μl, 模板DNA 3 μl,Mix 25 μl,Taq酶20 μl。擴增條件: 預變性95 ℃ 2 min;35個循環包括變性95 ℃ 20 s,引物退火 58 ℃ 20 s,引物延伸 72 ℃ 1 min;最后延伸72 ℃ 10 min。PCR擴增產物經1.2 %瓊脂糖凝膠電泳檢測后,交由昆泰銳生物科技有限公司進行測序。測序結果在NCBI(https://blast.ncbi.nlm.nih.gov/)GenBank數據庫中進行同源性比對,并下載序列相似性最高菌株。利用MEGA軟件[8]對光合細菌16S rDNA序列同源性相近的其他光合細菌進行系統發育分析并構建系統發育樹。
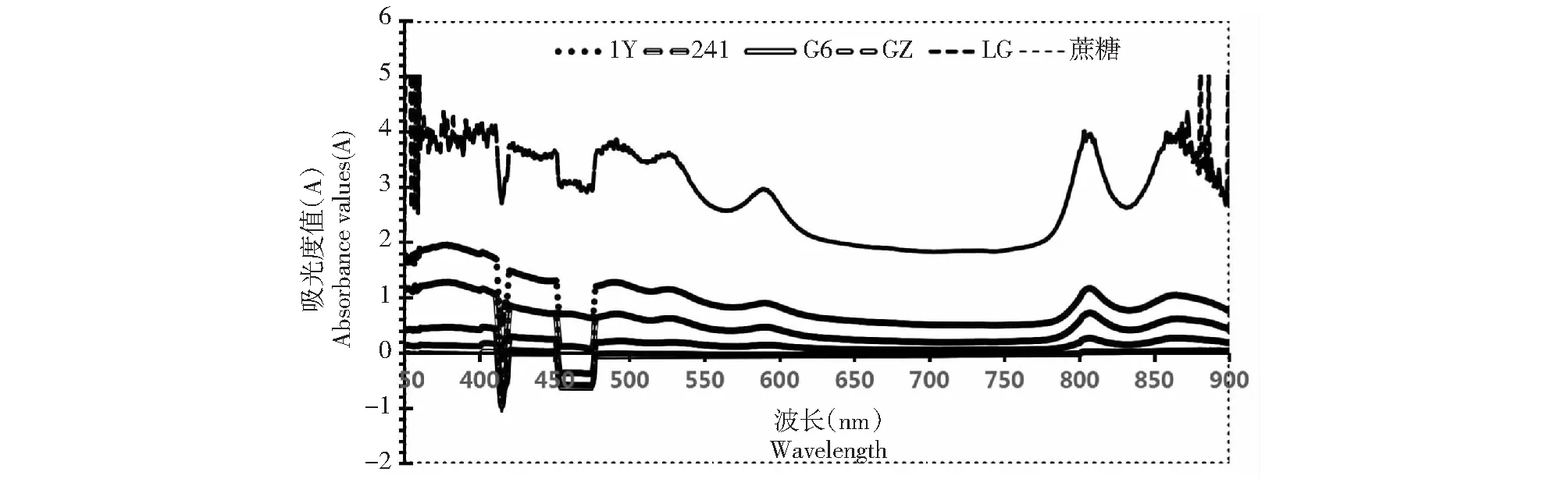
圖1 5株光合細菌的活菌吸收光譜Fig.1 Absorption spectrum of five photosynthetic bacteria
1.2.8 光合細菌氮轉化能力比較 氨轉化能力的比較:為排除有機氮降解產生的氨氮對硝化速率的影響,硝化速率測定在RCVBN液體培養基中去除酵母浸粉。連續監測15 d,每天同一時間取樣檢測氨氮[6,9],亞硝氮[7,10],硝態氮含量[11]。反硝化能力(硝態氮轉化能力)比較,為了消除培養基中有機氮對研究的影響,反硝化能力測定同樣在RCVBN液體培養基中去除酵母浸粉,并且培養基中的1 g/L硫酸氨換成1 g/L硝酸鉀。
接種:取生長指數期光合細菌,12 000 r/min離心10 min,棄去上清使用0.9 %生理鹽水懸浮菌體,共清洗3次,然后將20 g菌泥接種于2 L培養基中(1 %,W/V),搖勻,放入25 ℃的光照強度為3000~5000 lx的培養箱中靜置培養。
2 結果與分析
2.1 光合細菌的分離與鑒定
2.1.1 細胞形態觀察 在RCVBN瓊脂平板上共分離得到5株紫色菌株,分別命名為1Y、241、LG、G6和GZ。革蘭氏染色結果顯示5株菌都為革蘭氏陰性桿狀菌。
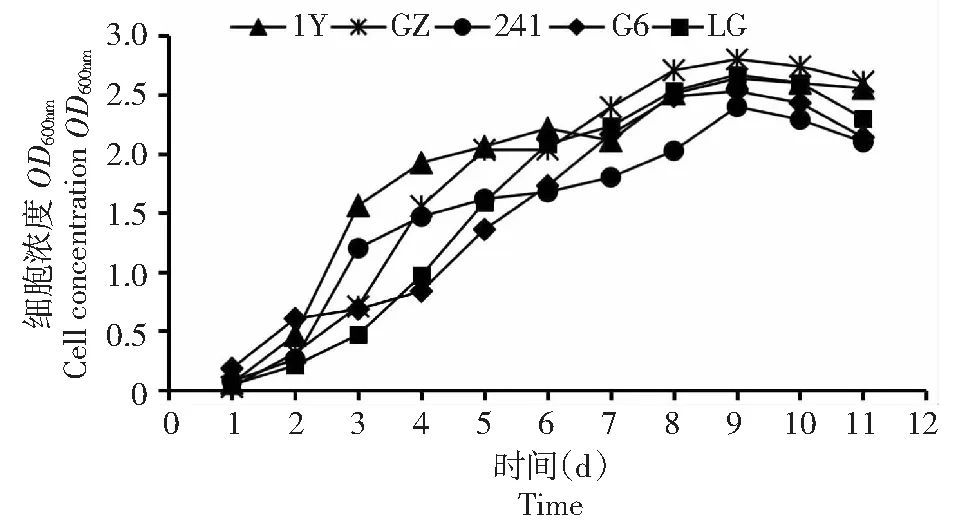
圖2 5株光合細菌生長曲線Fig.2 Growth curve of five photosynthetic bacteria
2.1.2 活細胞吸收光譜測定 將5株菌的菌液在波長300~900 nm范圍內測定其吸光度值(圖1)。與蔗糖對照相比5株菌在波長300~900 nm范圍內有4個特征峰,分別位于480、510、590和810 nm處。
2.1.3 生長速率比較 由圖2顯示,5株菌的生長速率比較,它們的生長趨勢基本一致,接種后2 d內為生長遲滯期。3~7 d為生長指數期,8~10 d內為生長穩定期,第10天開始衰退。菌株GZ和LG的生長速度略高于其余3株菌。
2.1.4 最適生長pH測定 絕大多數光合細菌最適生長pH為7.0,pH低于5.5明顯不生長,超過8.5生長明顯被抑制。如圖3所示,菌株1Y、LG和GZ在pH7.0左右菌體濃度最高。菌株241在pH為6.0左右菌體濃度最高。菌株G6在pH 8.5左右菌體濃度最高。
2.2 分子生物學鑒定及系統發育分析
由圖4顯示, 5株菌中1Y、241、G6和GZ與類球紅桿菌(Rhodobactersphaeroides)基因登錄號NR029215相似性為99.3 %。菌株LG與沼澤紅假單胞菌(Rhodopseudomonaspalustris,基因登錄號NR115542)相似性為100 %。

圖3 pH對5種菌株的生長影響Fig.3 Effect of pH on growth of five strains
2.3 光合細菌的氮轉化能力比較
2.3.1 氨氮轉化能力比較 將5株菌培養在去除酵母浸粉的RCVBN液體培養基中,連續監測15 d。氨氮降解動態變化結果如圖5所示,其中轉化能力最高的是菌株LG,轉化率為65.7 %,其次是菌株GZ,轉化率為56.22 %。菌株G6的轉化率為55.9 %,菌株1Y的轉化率為53.99 %,最少的是菌株241,轉化率為53.93 %。從圖5A中可看出,前7 d菌株LG的轉化速率最快為46.78 %,其次是菌株1Y轉化速率為40.13 %,菌株GZ為34.6 %,菌株G6為13.14 %,菌株241的轉化速率最慢,為3.58 %。
5株菌降解氨氮生成亞硝酸鹽動態變化如圖5B所示。從第3 天開始,菌株1Y,241,LG亞硝酸根的轉化量有所增加,但在第7天菌株1Y,GZ轉化的亞硝酸鹽量高達1.2和2.5 mg/L占整個降解的氨氮的0.14 %~0.2 %。硝酸鹽生成量監測結果如圖5C所示,硝酸鹽生成高峰在培養第8~12天,生成量最高為0.4~0.5 mg/L。另外,在整個培養期間,并未檢測到有氣體生成。
2.3.2 反硝化能力比較 從圖6可以看出,對5株菌的反硝化轉化能力進行檢測,在以硝酸鹽為唯一氮源情況下(RCVBN培養基不添加酵母粉),連續取樣15 d分別檢測硝酸根的轉化和亞硝酸根的生成。從圖6A可以看出,菌株G6對硝酸根的轉化能力最強,轉化率為95.79 %。菌株LG對硝酸根的轉化能力次之,轉化率為95.58 %。菌株1Y對硝酸根的轉化率為94.99 %。菌株GZ對硝酸根的轉化率為87.73 %。菌株241對硝酸根的轉化能力最弱,為69.96 %。亞硝酸鹽的生成如圖6B所示,從培養時間第7天開始,第8~9天亞硝酸鹽的積累達到頂峰。其中,菌株GZ的生成量最高,為11.19 mg/L。其次是菌株G6為10.77 mg/L,菌株241的生成量最低為4.10 mg/L。
3 小結與討論
本實驗通過雙層瓊脂平板法分離純化出5株純菌株,經革蘭氏染色與活細胞吸收光譜測定,5株菌都為革蘭氏陰性菌,并且在480 和510 nm處有吸收峰,說明活菌中含有類胡蘿卜素[12];在590 nm處有吸收峰,說明活菌中含有細菌葉綠素a;光合細菌的吸收光譜主要受類胡蘿卜素和細菌葉綠素a的影響。在790~1030 nm之間的810 nm處有吸收峰,綜合這幾處吸收峰結果與文獻報道的紫色非硫光合細菌的吸收峰完全一致[12]。進一步的基于16S rRNA基因測序的分子生物學鑒定,NCBI數據庫上其他同源性序列的進化樹分析,進一步的確定了這五株菌為紫色非硫光合細菌,并且1Y、G6、241和GZ為類球紅桿菌,LG為沼澤紅假單胞菌。最適pH檢測結果顯示大部分菌株在pH 7.0的培養環境下菌濃度最高,說明光合細菌喜好中性偏堿的生長環境,這一結果也與其所處的冰川前緣新暴露出的土壤普遍偏弱堿性(pH>7.5)有關[2,4]。
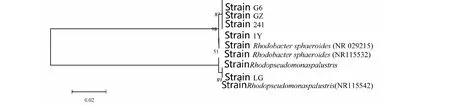
圖4 光合細菌系統發育分析Fig.4 Phylogenetic analysis of the photosynthetic bacteria

A:氨氮降解;B:亞硝酸鹽;C:硝酸鹽生成動態變化圖5 株光合細菌對氨氮的降解Fig.5 Dynamic changes of ammonia nitrogen degradation, nitrite and nitrate production by the five strains
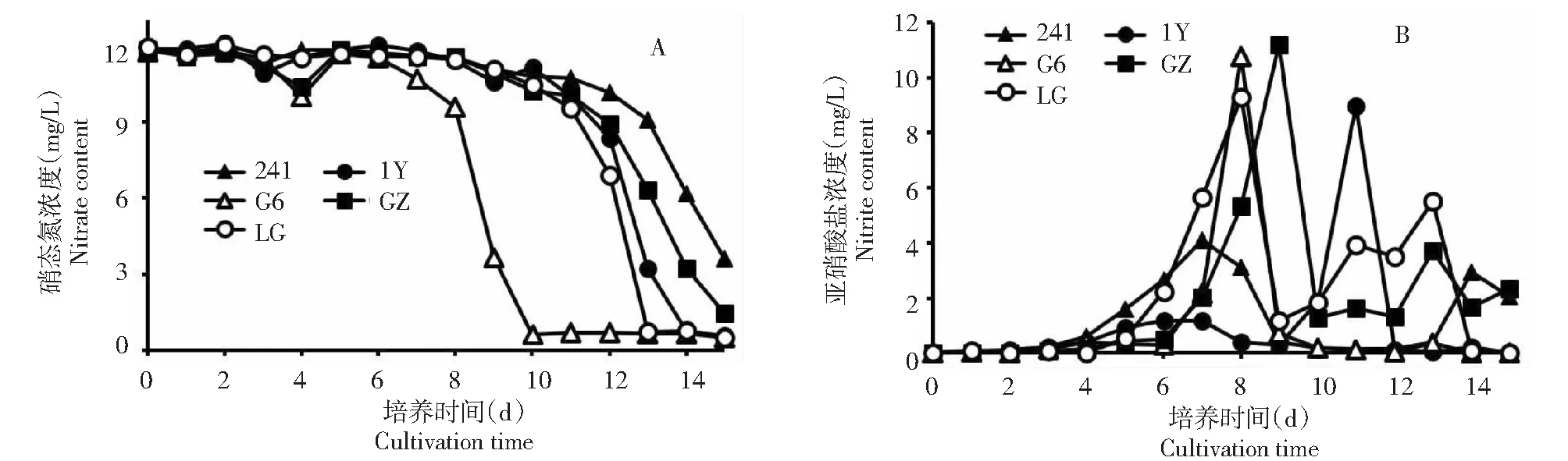
A:亞硝酸鹽的生成;B:亞硝酸鹽生成動態變化圖6 5株菌對硝酸根的轉化Fig.6 Dynamic changes of denitrification
這5株菌對氨態氮轉化結果可知,在以(NH4)2SO4為唯一氮源情況下,其能夠將絕大多數的氨用于菌體生長,繁殖,僅有少部分氨被轉化為亞硝酸鹽和硝酸鹽。本實驗室前期研究結果發現,這類光合細菌在冰川0年土壤固氮微生物中相對豐度占10 %左右[4],因此推測其可能對推動冰川前緣早期土壤發育具有重要作用。這5株菌的反硝化能力測定結果顯示,其能夠在以硝酸鹽為唯一氮源的RCVBN培養基上生長,并且隨著硝酸鹽的被利用,亞硝酸鹽的量呈現上升趨勢,并且在短暫的時間內降低,這可能與沼澤紅假單胞菌和類球紅桿菌被報道具亞硝酸鹽還原酶基因(nirK)有關[13-15]。本研究培養期間也發現密閉培養容器內有大量氣體生成,經定性檢測氣體主要是以N2為主,N2O,NH3,CO2。此外,菌體量也有所增加,但增加幅度不高,表明光合細菌雖然可以利用硝態氮,但利用硝態氮轉化為菌體蛋白率較低,硝態氮主要是通過反硝化作用生成氮氣,氧化亞氮,氨氣等方式損失,但其對氮損失過程中的貢獻量,需要進一步的研究。
本研究從新疆天山1號冰川前緣土壤中分離到的紫色非硫光合細菌純菌株,據其特殊的低溫生長環境可推測,而本研究所分離得到的菌株可能屬于低溫菌;并且對其氨氮和硝態氮轉化活性進行了研究,揭示了其對氨氮的高固定率和硝態氮的反硝化過程,為揭示冰川前緣土壤發育過程中氮素循環具有重要參考價值,并且這一研究結果在國內外目前尚屬首次。此外,由于紫色非硫光合細菌已被廣泛的應用于諸如高化學需氧量(COD),氨氮的有機廢水處理和資源化等方面研究,因此其可以作為低溫污染物修復提供高效菌種的依據。

