組氨酸激酶HK853酸堿調控機制的NMR研究
吉仕夏,劉乙祥,姜紅鷹,李從剛,姜 凌*,劉買利*
(1.中國科學院生物磁共振重點實驗室,波譜與原子分子物理國家重點實驗室,武漢磁共振中心(中國科學院 武漢物理與數學研究所),湖北 武漢 430071;2.中國科學院大學,北京 100049)

圖1 組氨酸側鏈基團在蛋白酶催化反應過程中的作用Fig.1 The role of the histidine side chain group in the process of protease catalysisA.balance of different protonation states of histidine side chains;B.crystal structure of complex at pH 8.0(dark,PDB:3DGE) and pH 5.0(light,PDB:5HUT),respectively,where in the CA domain of HK853 is in purple,the DHp domain of HK853 in cyan,and RR468 in green[13-14](A.組氨酸側鏈不同質子化態的平衡;RR468復合物分別在pH 8.0(深色,PDB:3DGE)和pH 5.0時的晶體結構(淺色,PDB:5HUT),其中紫色為HK853的CA結構域,青色為HK853的DHp結構域,綠色為RR468[13-14])
雙組分信號轉導系統( Two-component signal transduction system,TCS)是細菌感知和響應周圍環境的主要手段[1],細菌的絕大多數生理過程(例如感知滲透壓[2]、營養元素的代謝[3]、細胞壁的合成、細胞的增殖和分裂[4]等)都受到雙組分系統的調控。雙組分信號轉導系統在細菌中廣泛存在,平均每個物種有超過20個雙組分系統,一些真菌和植物中也發現了雙組分系統,但是目前為止尚未在人類和其他哺乳動物中發現它的存在[5-6]。雙組分系統也被認為是一種潛在的抗菌藥物靶點,正確認識其生物作用/功能的分子機制,有利于為日趨嚴重的細菌耐藥性問題提供新的抗菌藥物靶點[7],為對抗相關疾病提供新的潛在的方向。
雙組分信號轉導系統主要由兩類蛋白組成:組氨酸激酶(Histidine kinase,HK)和應激調節蛋白(Response regulator,RR)[8]。HK蛋白由膜外的Sensor結構域、跨膜區、胞內的DHp結構域(Dimerization and histidine phosphotransfer domain)和 CA結構域(Catalytic and ATP binding domain)組成[6,9]。其中最為重要的結構域DHp是形成二聚體界面的核心區域,并且含有高度保守的組氨酸殘基以實現磷酸轉移。大多數HK蛋白具有多功能性,不僅能實現自身磷酸化并傳遞磷酸基團給RR蛋白,還能介導催化RR蛋白的去磷酸化[10-12]。筆者在前期研究中發現,HK853的磷酸酶功能受pH值調控,在不同pH值條件下,HK853胞內全長蛋白(HK853cp)與底物RR468的復合物晶體結構不同,特別是參與去磷酸化反應的His260殘基的咪唑側鏈空間位置發生變化(圖1B)[13-14]。組氨酸的咪唑側鏈在催化反應中常通過不同的質子化狀態靈活調控反應進程(圖1A),但是受限于晶體結構的分辨率,關鍵殘基His260在催化去磷酸化反應時的質子化狀態并不清晰。由于蛋白復合物的分子量超過80 kDa,普通的同位素標記方法無法獲得可分辨的NMR信號,本研究對DHp結構域的組氨酸殘基側鏈采用選擇性標記的方法,獲得了清晰的NMR信號,有利于運用核磁共振方法研究His260側鏈的質子化狀態,闡明HK853行使磷酸酶功能時的酸堿調控機制。
1 實驗部分
1.1 表達與純化
1.1.1 HK853cp、HK853DHp及RR468的表達13Cε1-His選擇性標記的蛋白的表達,需將HK853cp或其突變體(H260A、H301A、H347A、H419A、H456A)、HK853DHp或其突變體(H259A、H260A、H301A)的質粒轉化至組氨酸缺陷型大腸桿菌菌株BL21(DE3)-His-中[15],于LB固體培養基中37 ℃過夜培養后,接種至5 mL LB培養基中37 ℃過夜培養,再轉移至添加了非標記的組氨酸、酪氨酸、苯丙氨酸和色氨酸的M9培養基中,37 ℃培養至OD600達到0.8~1.0,然后轉移至新的添加了13Cε1標記的組氨酸和非標記的酪氨酸、苯丙氨酸和色氨酸的M9培養基中,加入終濃度為0.5 mmol/L的異丙基硫代半乳糖苷(IPTG),于20 ℃誘導表達10 h,6 000 r/min離心10 min收菌,菌體保存于-20 ℃冰箱。
非標記的RR468的表達,需將RR468的質粒轉化至大腸桿菌BL21(DE3)中,并于LB固體培養基中37 ℃過夜培養,然后接種至LB培養基中,37 ℃培養至OD600達到0.6~0.8,加入終濃度為0.5 mmol/L的IPTG,于20 ℃誘導表達16~20 h,6 000 r/min離心10 min收菌,菌體保存于-20 ℃冰箱。
1.1.2 HK853cp、HK853DHp及RR468的純化HK853cp的純化:將菌液超聲破碎,20 000 r/min離心30 min,取上清液加入40%的硫酸銨使蛋白沉淀,20 000 r/min離心30 min,沉淀重懸后于65~70 ℃加熱30 min,除去部分雜蛋白,20 000 r/min高速離心后留取上清。樣品液用0.22 μm濾膜過濾后,上樣至QFF離子交換柱(緩沖液為Buffer A和Buffer B,見表1),以15%~50%體積分數的Buffer B進行梯度洗脫,收集目標蛋白并濃縮樣品液體積至5 mL以內;再用S-200分子篩柱(緩沖液為Buffer C)對蛋白進一步純化,收集目標蛋白并濃縮樣品液體積至5 mL以內;最后用脫鹽柱去除鹽離子(緩沖液為ddH2O)。分裝蛋白并凍干,-20 ℃保存備用。
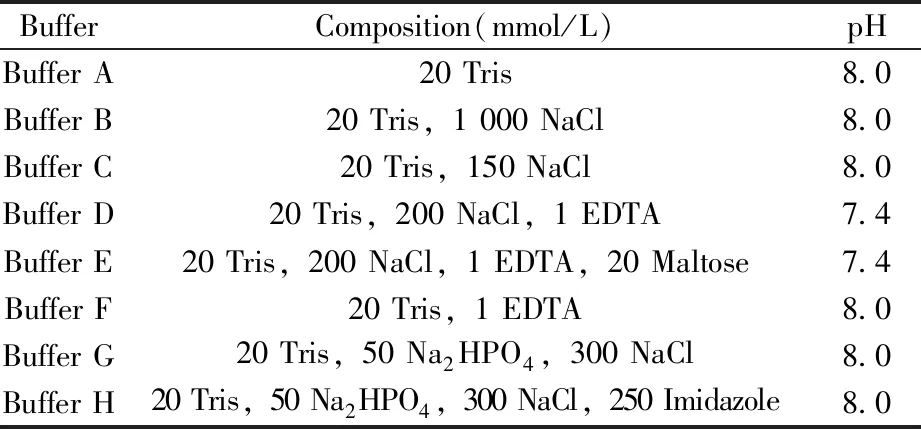
表1 蛋白質純化的緩沖液配方Table 1 Buffer for mulation for protein purification
HK853DHp的純化:將菌液超聲破碎后,20 000 r/min離心30 min,取上清液用0.22 μm濾膜過濾,上樣至MBP標簽親和柱(緩沖液為Buffer D和Buffer E),Buffer D沖洗至紫外吸光光度值達到基線值后,用Buffer E洗脫,收集目標蛋白并濃縮樣品液體積至5 mL以內;用Buffer F作緩沖液經脫鹽柱脫鹽后,再用Buffer F透析24 h,除去NaCl和麥芽糖(NaCl和麥芽糖會影響TEV酶切效率);加入TEV酶25 ℃下酶切過夜,切除MBP標簽;用Buffer D透析4 h后,過MBP柱層析(緩沖液為Buffer D和Buffer E)分離除去MBP標簽蛋白;然后進行鎳柱層析(緩沖液為Buffer G和Buffer H),梯度洗脫(目標蛋白在12%Buffer H時洗脫)分離除去TEV酶;最后進行脫鹽,再凍干保存備用。
RR468的純化:將菌液超聲破碎后于60 ℃加熱30 min,除去雜蛋白,20 000 r/min高速離心后留取上清。樣品液用0.22 μm濾膜過濾,上樣至QFF離子交換柱(緩沖液為Buffer A和Buffer B)。用0%~30%體積分數的Buffer B進行梯度洗脫,收集目標蛋白并濃縮樣品液體積至5 mL以內;再用S-100分子篩柱(緩沖液為Buffer C)對蛋白進一步純化,收集目標蛋白并濃縮樣品液體積至5 mL以內;最后用脫鹽柱去除鹽離子(緩沖液為ddH2O)。分裝蛋白并凍干以備用。
1.2 去磷酸化功能實驗
1.2.1 RR468磷酸化樣品的制備將6 mg/mL的RR468蛋白與12.5 mmol/L的乙酰磷酸在含20 mmol/L Tris(或NaAc)、100 mmol/L NaCl、10 mmol/L MgCl2的緩沖液中混合,于25 ℃下反應1 h;然后在同樣的緩沖液體系下進行脫鹽柱層析,除去多余的乙酰磷酸,得到磷酸化的RR468蛋白;最后分裝蛋白,并于-20 ℃下保存備用。分別在不同pH值的緩沖液中反應,可制得不同pH值環境下的磷酸化RR468樣品。
1.2.2 不同pH值下HK853的去磷酸化速率比較將P~RR468(磷酸化的RR468)與HK853DHp蛋白按照物質的量之比10∶1的比例混合,在4 ℃下反應,間隔不同時間取樣,時間間隔分別為0、5、10、20、40、60、90 min,另外設置不加入HK853DHp的P~RR468為對照組并同時取樣,用液氮速凍終止反應,然后利用Phos-Tag凝膠電泳實驗表征反應結果。
1.3 核磁共振實驗
1.3.11H-13C HSQC實驗1H-13C HSQC實驗于Bruker Avance 700 MHz核磁共振譜儀上完成。將凍干的HK853cp或HK853DHp蛋白樣品溶于含有20 mmol/L HEPES(4-羥乙基哌嗪乙磺酸)、50 mmol/L KCl、10 mmol/L MgCl2和10%D2O的緩沖溶液中,復合物樣品則額外加入5 mmol/L BeCl2、50 mmol/L NaF和略過量的RR468,蛋白終濃度為0.5~1.0 mmol/L,pH值調為7.0,實驗溫度為298 K。實驗參數:F2(1H)和F1(13C)維譜寬分別設為7 002.801 Hz和1 760.892 Hz,采樣數據點陣t2×t1=2 048×256,累加次數ns=16,弛豫等待時間d1=1.0 s。在pH滴定實驗中,通過改變樣品的pH值,采集相應pH值下的1H-13C HSQC譜。
1.3.21H-13C HSQC譜圖的信號歸屬由于13Cε1-His選擇性標記樣品的譜圖簡單,信號少,本研究通過定點突變的方式對1H-13C HSQC譜圖的信號進行歸屬。
信號歸屬實驗于Bruker Avance 700 MHz核磁共振譜儀上完成,實驗數據使用軟件Bruker Topspin 3.2處理。將HK853cp的各個組氨酸位點分別突變為丙氨酸,得到突變體H260A-HK853cp、H301A-HK853cp、H347A-HK853cp、H419A-HK853cp和H456A-HK853cp,將HK853DHp的各個組氨酸位點分別突變為丙氨酸,得到突變體H249A-HK853cp、H260A-HK853cp和H301A-HK853cp。再采集各個突變體13Cε1-His選擇性標記樣品的1H-13C HSQC譜圖。結合野生型和突變體蛋白的1H-13C HSQC譜圖,對13Cε1-His選擇性標記樣品的1H-13C HSQC譜圖進行信號歸屬。
2 結果與討論
2.1 選擇性同位素標記與信號歸屬
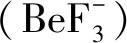

本研究對咪唑基團的Cε1位置進行選擇性標記,并使用組氨酸缺陷型大腸桿菌菌株BL21(DE3)-His-以保障標記的順利進行,減少交叉串擾。選擇這一標記位點,是因為咪唑基團的質子化發生在Nε1和Nε2位點,Cε1與它們距離相近,對化學位移變化敏感,而且碳氫鍵十分穩定,不會受到溶液質子交換的影響,是理想的表征咪唑基團質子化程度的原子探針。通過氨基酸定點突變對HK853cp的1H-13C HSQC譜進行了信號歸屬和驗證。HK853cp共含有5個組氨酸殘基,譜圖(圖2A)下部的信號分別對應于HK853 DHp結構域的His301和His260位點,以及位于CA結構域Loop區的His419;譜圖上部的信號分別對應CA結構域α-螺旋上的His456和His347(圖2A)。其中His301、His260和His419在后續的pH滴定中均表現出化學位移變化,而His456和His347處于蛋白質的疏水內部,無法與溶液發生質子交換,因此在pH滴定中未表現出化學位移的變化。HK853的DHp結構域共含有2個組氨酸殘基,分別為His301和His260(圖2B)。需要指出的是,圖2B中的His249是設計蛋白質純化標簽時額外引入的,TEV酶切后殘留了一個組氨酸殘基,不影響蛋白質的結構與功能。
2.2 pH滴定譜圖
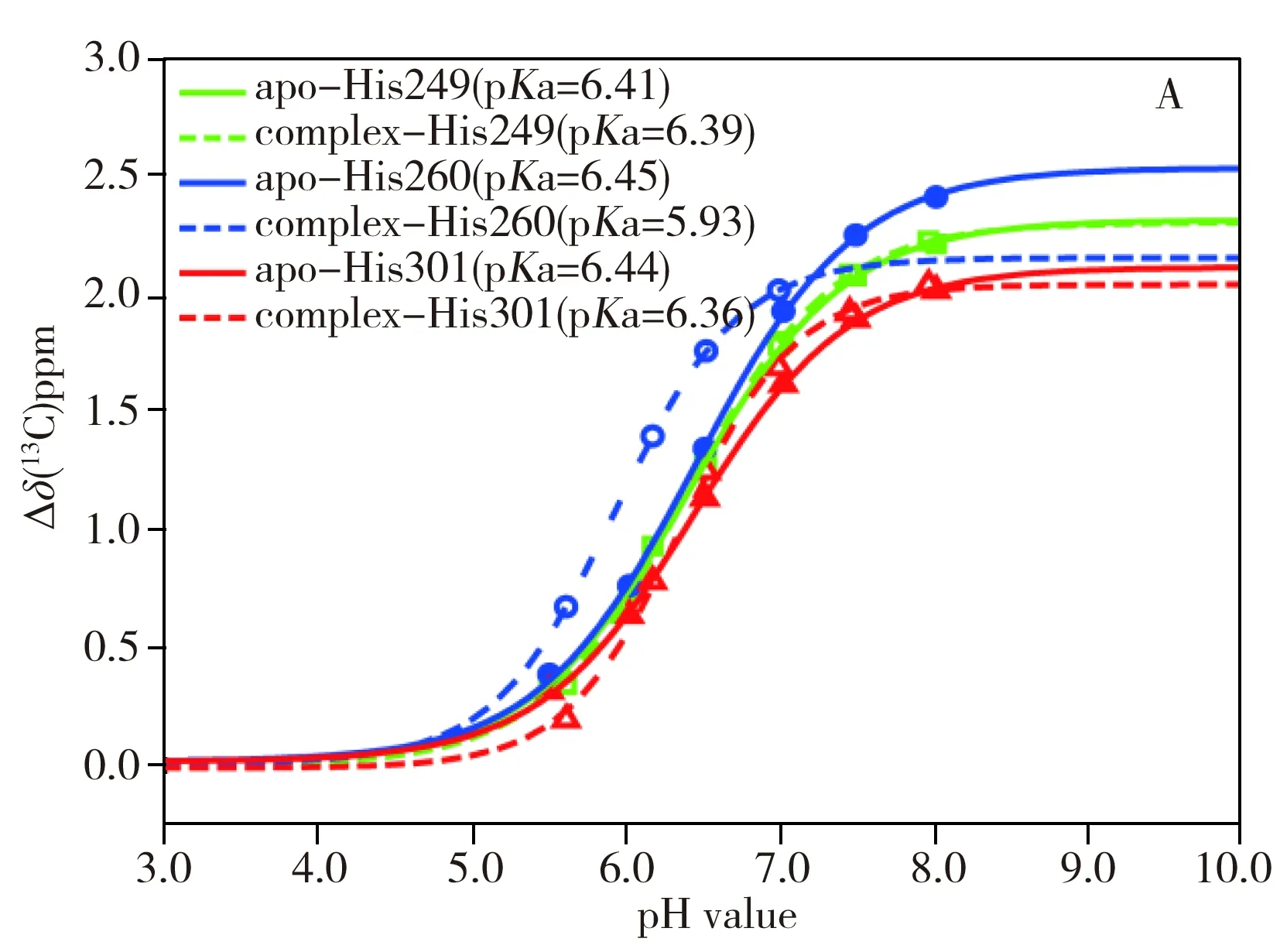
2.3 形成復合物對HK853 His260側鏈pKa值的影響
酸度系數pKa是一種描述酸解離質子能力的物理量,其值越小說明解離出質子的能力越強。從圖3A中可以看到,His249和His301兩個組氨酸位點在形成復合物前后pKa值變化較小,說明復合物的形成對于兩個位點幾乎沒有影響。His260位點的pKa值在形成復合物之后明顯減小,響應明顯異于其它位點。這是由于His260位點是HK853磷酸酶催化活性的關鍵位點,pKa對復合物的形成十分敏感,形成復合物前His260的pKa值為6.5左右,與其他組氨酸位點近似,而形成復合物后pKa值減小,意味著該咪唑側鏈的質子更易于離去,pH值小于6.0時即大部分處于去質子化狀態。
從圖3B可以看到,無論是HK853的胞內全長(HK853cp)還是DHp結構域(HK853DHp),在形成類磷酸化復合物之后His260位點的pKa值都明顯減小,變化趨勢和變化幅度基本一致,說明具有磷酸酶活性的主要結構域為DHp。形成復合物之后His260咪唑側鏈在中性條件下即處于去質子化狀態,有利于催化底物的去磷酸化反應。


2.4 pH值對HK853磷酸酶活性的影響
根據上述測定的pKa值,通過HK853DHp的去磷酸化功能實驗能夠很好地說明pH值對HK853磷酸酶活性的影響。實驗設計了4種pH值溶液條件(pH 5.0,6.0,7.0,8.0),將HK853DHp與底物P~RR468混合,在不同反應時間點取樣,測定HK853DHp的去磷酸化能力。凝膠電泳出現上下兩個條帶,分別為P~RR468和RR468(圖4)。由于P~RR468有自去磷酸化的功能,所以每張膠圖的右半部分都用未加HK853的樣品做對照(apo-RR468)。當反應溶液pH 值(5.0)小于His260的pKa時(圖4A),HK853DHp不能明顯加速底物P~RR468的去磷酸化;當pH 值(6.0)接近His260的pKa時,HK853DHp的催化能力加強,RR468條帶漸深(圖4B);當反應溶液pH值大于His260的pKa時(圖4C,4D),底物P~RR468的濃度顯著減少,apo-RR468的濃度顯著增加,說明HK853DHp的催化能力大幅增強,而且,在pH 8.0時HK853DHp的去磷酸化速率比在pH 7.0時更快。

3 結 論
本文運用13Cε1選擇性標記組氨酸側鏈的咪唑基團的方法研究了HK853與底物形成復合物前后組氨酸殘基側鏈的pKa值,發現His260側鏈在催化反應中呈現去質子化狀態。蛋白質的酶活功能實驗說明,不同的pH值下組氨酸激酶HK853的磷酸酶活性表現出顯著差異,這可能是細菌通過雙組分信號轉導系統應對外界pH值變化的一個重要手段。在一般的組氨酸殘基參與的蛋白酶催化過程中,組氨酸的pKa值大致為6.6~6.8[17],而在本實驗結果中,形成復合物之前自由態的HK853cp和HK853DHp的pKa值比較接近這個范圍,而形成復合物之后pKa值則下降到5.8~6.0。實驗結果說明,當酶與底物形成復合物后,催化位點pKa值降低,即使在pH 6.0條件下His260咪唑基團也是以去質子態的形式存在,有助于磷酸酶活性的提高,有利于保證酸堿調控的效率。
上述結果進一步闡明了HK853組氨酸激酶的酸堿調控機制,為雙組分信號轉導系統調控機制的研究提供了新的數據。相對于常規標記方法無法有效解決的大分子量蛋白質體系,選擇性標記是更好的選擇,為大分子量蛋白之間相互作用的研究提供了新的思路。

圖5 組氨酸激酶HK853的酸堿調控機制Fig.5 pH regulatory mechanism of HK853 investigated

