基于SIRT1/FoxO1通路研究白背三七總黃酮對糖尿病肝損傷大鼠的保護作用*
金鐵峰
浙江中醫藥大學第二臨床醫學院 浙江 杭州 310053
糖尿病對肝臟的損害臨床最常見的表現為非酒精性脂肪肝病(NAFLD)。沉默信息調節因子1(SIRT1)和叉頭轉錄因子(FoxO1)在NAFLD演變中起著重要的作用,研究發現,SIRT1/FoxO1信號通路與改善機體胰島素敏感性、調節肝臟脂質代謝、抗氧化應激及抗炎等作用緊密相關。本研究擬用鏈脲佐菌素(STZ)造成的2型糖尿病(T2DM)模型大鼠研究白背三七總黃酮對SIRT1/FoxO1通路的干預作用,并探討白背三七總黃酮對糖尿病肝損傷的保護作用及其可能機制。
1 材料和方法
1.1 動物及飼料:清潔級(SPF)雄性SD大鼠40只,體重180~220g,購自上海西普爾-必凱動物有限公司,許可證號:SCXK(滬)2013-0016,飼養于浙江中醫藥大學動物實驗中心。常規飼料由浙江省醫學科學院提供。高糖高脂飼料由1O.0%白砂糖、10.0%熟豬油、0.5%膽固醇、1O.0%蛋黃粉及69.5%基礎飼料組成,由浙江省醫學科學院制作成型及烘焙而成。
1.2 藥物及試劑:白背三七,由浙江名中醫館提供。白背三七總黃酮(黃酮質量分數為51.3%)由浙江中醫藥大學動物實驗中心制備。鏈脲佐菌素(STZ)(美國Sigma公司,批號B64927)。抗S1RT1抗體(Abcam公司);抗FOXO1抗體(Santa Cruz公司);抗Ac-FOXO1抗體(Santa Cruz公司)。
1.3 糖尿病模型復制:適應性喂養1周后,隨機選取6只作為正常對照組,給予普通飼料喂養。其余大鼠作為實驗組:高糖高脂飼料喂養4周,誘發胰島素抵抗。禁食10h后,將2%鏈脲佐菌素溶液按30mg/kg腹腔注射。72h后采用尾靜脈采血的方法測量血糖,持續3d的血糖濃度>16.7mmol/L證明T2DM模型大鼠造模成功。
1.4 分組與給藥:將造模成功的24只大鼠隨機分為模型組、白背三七總黃酮低(30mg/kg)、中(60mg/kg)、高(120mg/kg)劑量組,每組6只。正常對照組給予普通飼料喂養,實驗組繼續給予高糖高脂飼料。各給藥組大鼠按每次lml/100g體質量的容量灌胃給藥。正常對照組和模型組給等體積的生理鹽水,每日1次,連續8周。
1.5 標本的采集:在用藥8周末,大鼠禁食不禁水12小時后稱重,以1.0mg/kg 10%水合氯醛腹腔注射麻醉,心臟穿刺抽血,靜置30min后,以3000r/min離心10min,分離血清(用于檢測血糖、血脂、胰島素水平及肝功能指標),-20℃保存。分離肝臟,取部分組織固定于10%中性甲醛溶液中以備光鏡觀察,再取部分肝臟快速液氮冷凍,用于SIRT1、FoxO1及乙酰化的FoxO1(Ac-FoxO1)蛋白含量的檢測。
1.6 血清生化指標測定:采用全自動生化分析儀測定空腹血糖(FBG)、丙氨酸氨基轉移酶(ALT)、天門冬氨酸氨基轉移酶(AST)、甘油三酯(TG)。
1.7 肝組織病理變化:肝臟組織常規固定脫水、透明、包埋、切片,行蘇木素一伊紅(HE)染色,光鏡下觀察肝臟病理形態學改變。
1.8 Western-blot法檢測肝臟組織中Sirt1、FoxO1、Ac-FoxO1蛋白的表達:用二喹啉甲酸(BCA)比色法蛋白定量試劑盒檢測各組樣品蛋白濃度。在電泳加樣孔內加入等量蛋白質,10%Bis/Tris凝膠分離蛋白,并用濕轉法將蛋白轉移到PVDF膜上。用TBST(150mM NaC1,50mM Tris,0.1%Tween-20,pH 7.5)稀釋的5%脫脂牛奶封閉PVDF膜2h,孵育抗SIRT1(1:500稀釋)、FOXO1(1:1000稀釋)、Ac-FOXO1(1:1000稀釋),4℃過夜;用TBST洗滌3次;室溫孵育對應的二抗(1:5000稀釋)1.5h;用TBST洗滌3次。使用BioRad成像系統檢測蛋白質條帶并使用Image Lab軟件定量。
1.9 統計學方法:采用SPSS 19.0軟件處理數據。結果以±s表示,兩樣本均數比較采用t檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 各組大鼠血清生化指標改變情況:見表1。
表1 白背三七總黃酮對DM大鼠FBG、ALT、AST和TG的影響(±s,n=6)

表1 白背三七總黃酮對DM大鼠FBG、ALT、AST和TG的影響(±s,n=6)
注:與正常對照組比較,*P<0.05;與模型組比較,#P<0.05。
TG(mmol/L)0.23±0.06 2.36±0.77*1.79±0.75#1.55±0.65#1.41±0.64#組別正常對照組模型組低劑量組中劑量組高劑量組FBG(mmol/L)5.16±1.08 25.12±6.13*25.24±5.99#25.03±4.61#24.20±3.78#ALT(U/L)50.35±6.66 173.55±89.57*121.75±43.97#111.30±30.15#109.75±14.45#AST(U/L)128.95±21.63 195.50±83.55*149.20±60.46#133.50±45.97#130.70±41.21#
2.2 各組大鼠肝臟組織病理形態學改變:根據HE染色顯示,正常對照組大鼠肝小葉輪廓清晰完整,肝細胞形態正常;模型組大鼠肝細胞呈明顯脂肪變,局灶性壞死,壞死區和匯管區可見程度不一的炎癥細胞浸潤,部分細胞核變型和核偏位;白背三七總黃酮高、中、低劑量組肝細胞病變程度顯著輕于模型對照組,其中高劑量組最明顯。
2.3 各組大鼠肝臟組織SIRT1、FoxO1及Ac-FoxO1蛋白蛋白表達的變化:見表2、圖1。
表2 白背三七總黃酮對DM大鼠肝臟組織SIRT1/FoxO1通路的影響(±s,n=6)
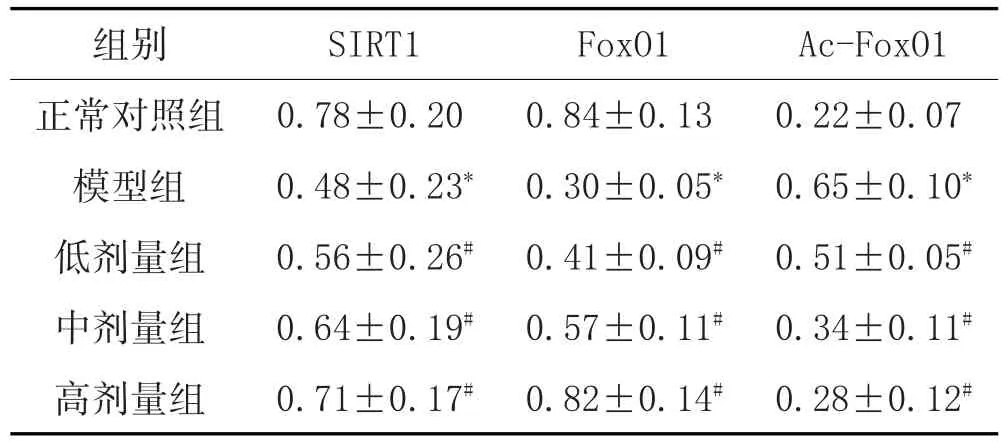
表2 白背三七總黃酮對DM大鼠肝臟組織SIRT1/FoxO1通路的影響(±s,n=6)
Ac-FoxO1 0.22±0.07 0.65±0.10*0.51±0.05#0.34±0.11#0.28±0.12#組別正常對照組模型組低劑量組中劑量組高劑量組SIRT1 0.78±0.20 0.48±0.23*0.56±0.26#0.64±0.19#0.71±0.17#FoxO1 0.84±0.13 0.30±0.05*0.41±0.09#0.57±0.11#0.82±0.14#
注:與正常對照組比較,*P<0.05;與模型組比較,#P<0.05。

圖1 Western blot法檢測SIRT1、FoxO1及Ac-FoxO1蛋白的表達
3 討論
NAFLD的發病機制,主流觀點支持“多重打擊”學說[1],第一重打擊主要是胰島素抵抗(IR),它可促使外周脂解增加和高胰島素血癥,引起肝細胞內甘油三酯儲積,同時誘導脂肪變性的肝細胞對內、外源性損害因素的敏感性提高,并為脂質過氧化提供反應基質。第二重打擊主要是氧化應激產生過多的活性氧自由基及脂質過氧化產物,導致肝細胞線粒體功能障礙、促炎細胞因子生成,最終導致肝細胞炎癥壞死。現階段研究發現某些基因也參與病情的進展[2]。SIRT1是一種依賴煙酰胺腺嘌呤二核苷酸的組蛋白去乙酰化酶,與細胞衰老、壽命延長、抗氧化應激和能量代謝調節等生命活動密切相關[3]。多項證據顯示,SIRT1能使Ac-FoxO1去乙酰化,激活FoxO1的轉錄活性,在脂質代謝中起重要作用。SIRT1-FoxO1信號通路可能通過改善胰島素敏感性、減弱氧化應激等多方面調節肝細胞脂肪代謝。
中醫學認為,糖尿病并發癥的基本病機為瘀濁互阻,氣陰兩虛。消渴日久,治不得法,傷陰耗氣,痰瘀互結于肝絡可致糖尿病肝病。《中華本草》記載白背三七可“清熱涼血,活血止痛,止血。主咳嗽,瘡瘍,燙炎傷,跌打損傷,風濕痛,崩漏,外傷出血”,并被廣泛用于治療糖尿病。實驗證實白背三七中黃酮類化合物含量豐富,且能顯著改善胰島的功能,用于治療2型糖尿病的功效確切。本實驗結果顯示,經白背三七治療后血清FBG、TG、AST、ALT顯著降低;病理形態學發現肝細胞形態多數恢復正常,脂肪變肝細胞、炎性細胞明顯減少;肝內SIRT1、FoxO1蛋白表達明顯增加,Ac-FoxO1蛋白表達明顯減少,提示白背三七總黃酮可能通過激活SIRT1,使Ac-FoxO1去乙酰化,激活FoxO1的轉錄活性,進而改善胰島素敏感性、減弱氧化應激等,從而對糖尿病肝損傷起到了保護作用。

