PMA-qPCR方法檢測陜西獼猴桃潰瘍菌優勢病原菌活菌的研究
肖 妍 劉蕓宏 高貴田,2 曹 凡 馬燕萍 趙武奇 雷玉山
(1.陜西師范大學食品工程與營養科學學院,陜西 西安 710119;2.陜西省獼猴桃工程技術研究中心,陜西 西安 710404;3.陜西省農村科技開發中心,陜西 西安 710054)
獼猴桃潰瘍病是由丁香假單胞桿菌獼猴桃致病變種(Pseudomonassyringaepv.actinidiae,Psa)引起的細菌性病害[1],嚴重影響獼猴桃產業的發展。目前,該病菌的檢測主要采用PCR技術,但是常規的PCR技術不能區分樣品中病原菌的生活狀態,在對活菌DNA進行擴增的同時,也會擴增自由狀態的DNA或者死菌的DNA[2],檢測產生假陽性,無法確定Psa的生活狀態,無法對潰瘍病的發生趨勢作出科學預測,也無法對消毒、防治效果做出科學判斷。
疊氮溴化丙錠(propidium monoazide,PMA)是一種能和DNA共價交聯的熒光染料。PMA可以通過死菌損傷的細胞膜進入死菌細胞,并且光照可使PMA的光敏基團轉化為氮賓自由基,與死菌DNA發生共價交聯,從而抑制后續DNA擴增[3-6];活菌細胞膜完整,PMA不能進入細胞內;剩下的少量游離在溶液中的PMA則可與溶液中的水分子結合形成羥胺(—NH—OH),失去與DNA結合的活性;PMA-qPCR技術就是利用這一特性,實現了只擴增活細胞的DNA,而不擴增死細胞的DNA[4]。
近年來,PMA-qPCR技術已被廣泛應用于多種微生物活死菌的鑒別檢測[7],但該技術用于鑒別陜西獼猴桃潰瘍菌優勢病原菌仍鮮見報道。于小龍等[8]建立的PMA-qPCR方法,能有效對包括VBNC狀態在內的青枯菌活菌進行檢測;溫書香等[9]通過優化PMA處理條件,實現了對結核桿菌活菌的快速檢測;於穎等[10]在PMA濃度30 μg/mL下,曝光5 min,可實現對金黃色葡萄球菌活菌篩選的作用。
世界Psa主要分為三大類群,中國流行的獼猴桃潰瘍病的Psa與最近在意大利、新西蘭、西班牙、法國、葡萄牙等國流行的Psa為同一類群[11]。由于其同屬的Pseudomonassyringaepv.theae和Pseudomonasavellanae與Psa的親緣關系非常近,常規的分子標記技術很難將它們區分開[12]。Gallelli等[13]根據獼猴桃潰瘍菌的hrpW基因保守區,設計P3F/P5R1引物,不僅能區分Pseudomonassyringaepv.theae和Pseudomonasavellanae,也可以準確區分出強致病力菌株(Psa-V)與弱致病力菌株,朱丹等[14]克隆了陜西獼猴桃優勢Psa的hrpW基因保守區,其序列與Psa-V同源性為99%。
因此本研究擬利用陜西獼猴桃優勢Psa的hrpW的P3F/P5R1為引物,建立PMA-qPCR檢測方法,研究PMA濃度、暗孵育時間及曝光時間等對Psa擴增的影響,并將死菌和活菌按一定的比例混合,對PMA-qPCR方法在實際檢測中的可行性進行分析。為陜西獼猴桃潰瘍病的快速檢測、準確診斷及病情預測提供參考。
1 材料和方法
1.1 材料與儀器
丁香假單胞桿菌獼猴桃致病變種(Pseudomonassyringaepv.actinidiae,Psa):為陜西獼猴桃潰瘍病優勢病原菌[15],西北農林科技大學植保學院黃麗麗教授惠贈;
PMA:美國Biotium公司;
Psa質粒標準品:生工生物工程(上海)股份有限公司;
Ezup柱式基因組DNA抽提試劑盒、即用PCR擴增試劑盒:上海生工生物工程有限公司;
SYBR Green I試劑盒:天根生化科技有限公司;
鹵素燈:500 W,飛利浦燈具有限公司。
1.2 方法
1.2.1 Psa菌懸液的制備 挑取Psa單菌落于King’s B液體培養基,24 ℃、190 r/min恒溫震蕩12 h,無菌水調節菌懸液濃度為1×107CFU/mL。
1.2.2 Psa菌膜損傷時間的確定 吸取500 μL菌懸液于1.5 mL的離心管中,沸水浴(98.3 ℃)分別處理10,11,12,13,14,15 min后立即在冰上冷卻至室溫,對照組未經沸水浴處理。吸取100 μL涂布于King’s B固體培養基上,24 ℃培養,3 d后統計單菌落數,無菌落生長視為全部是死菌,該時間為膜損傷菌的處理時間。
1.2.3 DNA提取 吸取500 μL菌液,8 000 r/min離心2 min 棄上清,按照DNA Ezup柱式基因組DNA抽提試劑盒的說明書提取DNA。
1.2.4 qPCR檢測 qPCR引物根據Gallelli等[13],修改如下,引物序列為:GGTTTCGGACACCGCAGGTTCTACCGAG和CTTCCTGATCCCCGTTACCCATCGA-C,由生工生物工程(上海)股份有限公司合成。反應總體系為10 μL,DNA模板1.0 μL,SYBR PCR premix 5.0 μL,引物P3F、P5R1各0.6 μL,ddH2O補足至反應總體積。反應程序為95 ℃預變性10 min,95 ℃變性10 s,72 ℃退火20 s,30個循環,72 ℃延伸20 s。
1.2.5 PMA處理的條件
(1)PMA工作液的制備:1 mg PMA于8 000 r/min離心2 min,加入20%二甲基亞砜(DMSO)溶液200 μL充分溶解,得到5 μg/μL PMA儲備液,于-20 ℃避光保存。
(2)抑制死菌擴增的PMA最小濃度:分別吸取6份膜損傷的死菌懸液500 μL于1.5 mL離心管,加入PMA,使PMA的終濃度分別為0,90,95,100,105,110 μg/mL,顛倒混勻,暗孵育8 min,將樣品置于冰上,離心管口朝上,置于距樣品20 cm的500 W鹵素燈下,曝光處理20 min,提取樣品DNA,用qPCR檢測,從而確定能夠完全抑制死菌擴增的PMA最小濃度。
(3)不影響活菌擴增的PMA最大濃度:吸取4份活菌懸液500 μL于1.5 mL離心管中,加入PMA,使PMA的終濃度分別為0,105,110,120 μg/mL,顛倒混勻,暗孵育8 min,將樣品置于冰上,離心管口朝上,置于距樣品20 cm 的500 W鹵素燈下,曝光處理20 min,提取樣品DNA,用qPCR分別檢測,研究不抑制活菌擴增的PMA最大濃度。
(4)暗孵育時間的優化:分別吸取5份膜損傷的死菌懸液500 μL于1.5 mL離心管,加入確定的最佳PMA工作液濃度,分別暗孵育5,6,7,8,9,10 min,將樣品置于冰上,離心管口朝上,置于距樣品20 cm的500 W鹵素燈下,曝光處理20 min,未加PMA的樣品作為陽性對照,提取DNA,用qPCR檢測,研究完全抑制死菌擴增的最佳暗孵育時間。
(5)曝光時間的優化:分別吸取6份膜損傷的死菌懸液500 μL于1.5 mL離心管,用確定的最佳PMA工作液濃度和最佳暗孵育時間進行處理,將樣品置于冰上,離心管口朝上,置于距樣品20 cm的500 W鹵素燈下,分別曝光處理5,10,15,20,25 min,未加PMA的樣品作為陽性對照,確定能夠完全抑制死菌擴增的最佳曝光時間。
(6)PMA對不同比例活菌/死菌樣品的檢測效果:將培養至107CFU/mL的活菌和死菌按照表1進行混合,經合適條件的PMA處理提取DNA,進行PMA-qPCR反應,以未加PMA處理的樣品作為對照。

表1 不同比例的活死菌樣品Table 1 Proportion of different live and dead bacteria
1.2.6 標準曲線的建立 取已知濃度的Psa質粒標準品(由生工生物工程〔上海〕股份有限公司完成),根據式(1)換算成基因拷貝數。
(1)
式中:
A——質粒DNA拷貝數,拷貝/μL;
C——DNA濃度,ng/μL;
M——片段大小;
NA——阿伏伽德羅常數,6.02×1023。
將Psa質粒標準品10倍梯度稀釋至101,進行熒光定量PCR反應,以拷貝數對數值和所得Ct值為橫、縱坐標建立標準曲線。
1.2.7 PMA-qPCR的靈敏度 菌液10倍梯度稀釋至101,經合適條件的PMA處理提取DNA,進行PMA-qPCR的靈敏度分析。
1.2.8 獼猴桃枝條樣品活菌檢測
(1)枝條樣品的染菌:取無菌的獼猴桃枝條,切成25 g 的小塊,碾碎后放入無菌均質杯中,加入225 mL無菌水,8 000 r/min均質2 min,制成樣品勻液。分別加入101~107CFU/mL的潰瘍菌活菌懸液,作為人工染菌的樣品。
(2)采用合適條件的PMA處理提取DNA,進行PMA-qPCR檢測,根據標準曲線得到基因拷貝數,與平板計數的結果進行比較。
1.2.9 數據分析 采用DPS 7.05對試驗數據進行顯著性差異檢驗,P<0.05表示具有顯著性差異。
2 結果與分析
2.1 Psa膜損傷時間的確定
本試驗采用食品上較常使用的高溫滅菌方式制備死菌懸液[16]。菌懸液濃度為1×107CFU/mL,熱處理不同時間,稀釋一定濃度后涂布,24 ℃培養3 d,計數結果如表2 所示,熱處理時間越長,對活菌的滅活效率越高,當膜損傷時間為13 min時,無菌落生長,因此,以13 min的沸水浴處理作為活菌的全部致死時間。
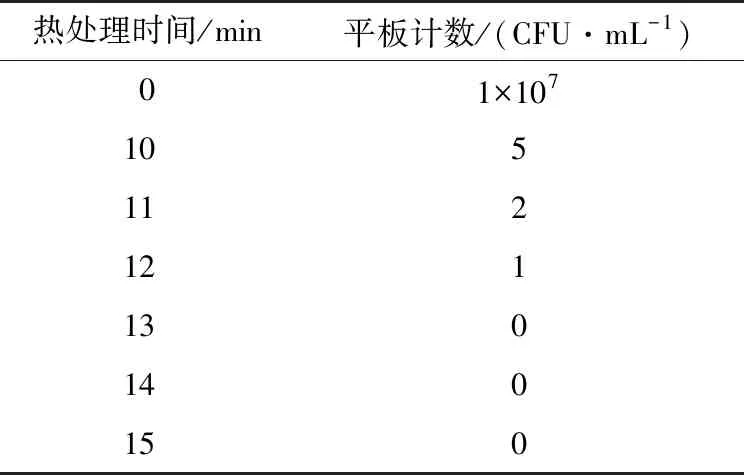
表2 時間對菌液滅活效率的影響Table 2 Effect of heat-treatment time on sterilizing rate
2.2 PMA處理條件的確定
2.2.1 PMA濃度的優化
(1)抑制死菌擴增的PMA最小濃度:由圖1可知,隨著PMA濃度的增大,Ct值逐漸增大,PMA的濃度為100 μg/mL時,Ct值增大比較小,當PMA濃度為105 μg/mL 時,對死菌DNA擴增抑制達到最大,PMA濃度為110 μg/mL時,Ct值幾乎無變化,與PMA濃度為105 μg/mL相比,無顯著性差異(P>0.05),因此,確定抑制死菌DNA擴增最小PMA濃度為105 μg/mL。
PMA是一種能和死菌DNA共價交聯的熒光染料,活菌的完整細胞膜可阻止PMA進入,從而達到檢測活菌效果。但是,PMA濃度過高可能對活菌的細胞產生影響,導致假陰性的檢測結果[17]。趙麗青等[18]在PMA濃度2 μg/mL下,500 W鹵素燈曝光15 min可達到檢測金黃色葡萄球菌活菌的目的。曹夢琪等[19]在PMA濃度15 μg/mL 下,650 W鹵鎢燈曝光5 min,可達到檢測青枯菌活菌的目的。於穎等[10]在PMA濃度30 μg/mL下,650 W鹵素燈曝光5 min可達到篩選金黃色葡萄球菌活菌的作用,并且試驗中的菌懸液濃度均在108CFU/mL。本研究得到的Psa的最佳PMA濃度為105 μg/mL,菌懸液濃度為107CFU/mL。細菌的細胞膜差異很大,革蘭氏陰性菌比革蘭氏陽性菌的細胞壁與細胞膜薄,對PMA的通透性好[20],PMA使用濃度應該較低,但本研究得到的Psa的最佳PMA濃度與已有文獻相差較大,可能與陜西獼猴桃優勢病原菌本身對外界環境的抵抗能力有關,其對PMA產生抵抗的詳細機理還需更深層次的探究。

圖1 PMA濃度對膜損傷菌的影響Figure 1 Effect of PMA concentration on heat-treated bacteria
(2)不影響活菌擴增的PMA最大濃度:由圖2可知,活菌DNA的Ct值隨PMA濃度的增大而增大,PMA濃度為105 μg/mL時,與未加PMA的Ct值無顯著性差異(P>0.05),說明此濃度不會對活菌DNA的擴增產生較大影響,但是當PMA使用濃度>105 μg/mL時,與未加PMA的Ct值有顯著性差異(P<0.05),說明PMA濃度>105 μg/mL對活菌有一定的影響,因此,選擇PMA濃度為105 μg/mL作為不影響活菌擴增的PMA最大濃度。
2.2.2 暗孵育時間的確定 由圖3可知,隨著暗孵育時間的延長,Ct值逐漸增大,暗孵育時間為7 min,Ct值增大比較小,當暗孵育時間延長至8 min,對死菌DNA擴增抑制達到最大,暗孵育時間>8 min,Ct值幾乎無變化,與暗孵育時間8 min相比,無顯著性差異(P>0.05),8 min 的暗孵育時間可完全抑制死菌DNA擴增,因此確定最佳的暗孵育時間為8 min。

圖2 PMA濃度對活菌的影響Figure 2 Effect of PMA concentration on live bacteria
抑制膜損傷菌DNA擴增除PMA濃度外,最佳的暗孵育時間也至關重要。PMA在光照條件下,與水分子結合生成羥胺,羥胺不能和DNA分子結合,從而無法抑制死菌的DNA,因此,在樣品中加入PMA要避光處理合適的時間,而暗孵育時間的長短受樣品菌濃度、PMA濃度、細胞膜結構等因素影響。結果表明,8 min的暗孵育時間可充分使PMA與DNA結合,曝光處理后與DNA結合形成不可逆的共價交聯結構,抑制死菌DNA擴增。未與DNA結合的PMA曝光時可與水分子反應生成羥胺而失去活性[21-22]。
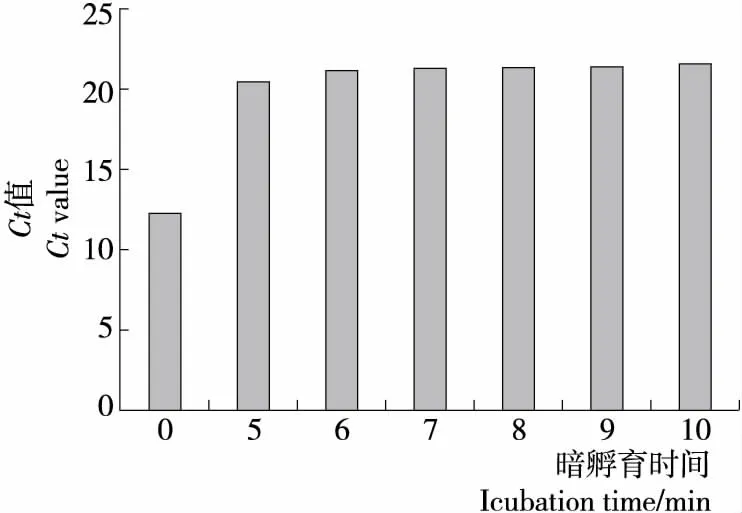
圖3 暗孵育時間對膜損傷菌的影響Figure 3 Effect of incubation time on heat-treated bacteria
2.2.3 曝光時間的確定 由圖4可知,隨著曝光時間的延長,Ct值逐漸增大,曝光時間為15 min,Ct值增大比較小,當曝光時間延長至20 min,對死菌DNA擴增抑制達到最大,曝光時間為25 min,Ct值幾乎無變化,與曝光時間20 min相比,無顯著性差異(P>0.05)。因此,20 min 的曝光時間可完全抑制死菌DNA擴增,確定最佳的曝光時間為20 min。
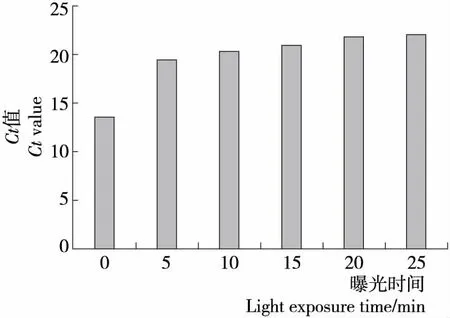
圖4 曝光時間對膜損傷菌的影響Figure 4 Effect of light exposure time on heat-treated bacteria
曝光時間是影響活菌檢測的另一個重要因素,光照時間不充分,PMA不能完全被鈍化,部分殘留在菌懸液中,提取DNA時,活細胞的細胞膜被破壞,暴露出的DNA被PMA分子結合,使檢測結果出現假陰性。鹵鎢燈的選擇也會影響到曝光的時間,650 W鹵鎢燈雖然能降低耗時,但同時會產生大量的熱量,有可能造成管口附近菌體的死亡。所以本研究選用500 W的鹵鎢燈距離20 cm,曝光20 min,一方面使與DNA結合的PMA與DNA分子進一步充分交聯,同時使游離的PMA完全被鈍化。
2.2.4 PMA對不同比例活菌和膜損傷菌影響 PMA對不同比例活菌和死菌的影響如表3所示,當樣品全部為死菌時(活菌比例0%),未加PMA處理的Ct值為16.21,加PMA處理后Ct值為23.28,差異極顯著(P<0.01),活菌的比例為25%,50%,75%,未加PMA處理的樣品Ct值明顯低于加入PMA樣品的Ct值,說明PMA有抑制死菌DNA擴增的作用。當樣品中活菌比例達到100%時,未加PMA樣品的Ct值與加入PMA處理樣品的Ct值無顯著性差異(P>0.05),說明加入的PMA對活菌的擴增幾乎無影響。同時,活菌比例的增大導致Ct值相應的減少,說明經PMA處理后死菌DNA被PMA抑制不能擴增,可以消除死菌對PCR的擴增,降低假陽性結果出現的可能性。

表3 不同比例活菌樣品PMA-qPCR結果?Table 3 PMA-qPCR Results of different live bacteria proportion
? △Ct=PMA處理組-對照組。
2.3 質粒標準品的制備及標準曲線的建立
質粒標準品初始拷貝數為6.39×108拷貝/μL。將其進行10倍梯度稀釋,使濃度范圍在1×101~1×108拷貝/μL。以拷貝數對數值和所得Ct值為橫、縱坐標建立標準曲線,見圖5。可以看出兩者存在對應線性關系,r2=0.995 5,斜率為-3.220 4,該方法最低能夠檢出6.39×102拷貝/μL的潰瘍菌。
2.4 PMA-qPCR的靈敏度
菌液10倍梯度稀釋至101,102,103,104,105,106,107,經合適條件的PMA處理提取DNA,進行PMA-qPCR反應。根據標準曲線得到定量結果見表4,PMA-qPCR方法最低可檢出2.38×102拷貝/μL的潰瘍菌見圖6。
2.5 獼猴桃枝條樣品活菌檢測
染菌樣品經PMA處理提取DNA,進行PMA-qPCR檢測,根據標準曲線得到基因拷貝數,與平板計數的結果進行比較,顯示兩者無顯著性差異(P>0.05)(表5)。
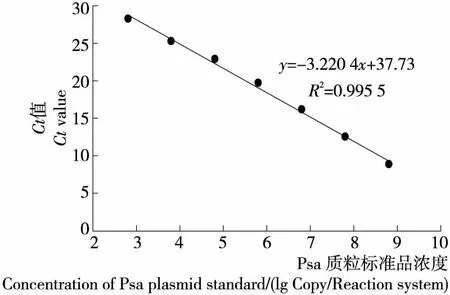
圖5 Psa質粒標準曲線Figure 5 Plasmid standard curve

表4 不同稀釋梯度菌液的PMA-qPCR結果?Table 4 PMA-qPCR results of different dilution bacteria
? UD表示未測得。

1~5分別為稀釋至107,106,105,104,103的菌懸液擴增曲線,最低可檢出2.38×102拷貝/μL的潰瘍菌
圖6 PMA-qPCR靈敏度分析
Figure 6 PMA-qPCR sensitivity analysis

表5 染菌樣品PMA-qPCR結果與平板計數結果比較?Table 5 Compare results of PMA-qPCR with plate count
? UD表示未測得。
3 結論
本試驗以獼猴桃潰瘍菌為研究對象,通過優化PMA處理條件,實現檢測陜西獼猴桃潰瘍病優勢病原菌活菌的目的。結果表明,PMA與死菌共價交聯的最佳濃度為105 μg/mL,最佳暗孵育時間為8 min,最佳曝光時間為20 min,在此條件下,Psa死菌擴增被抑制,而活菌的擴增未受影響。同時,雖然優化后的PMA濃度對活菌的擴增未產生影響,但是該濃度相對此類文獻而言還是偏高,所以對于陜西獼猴桃潰瘍病優勢病原菌是否對PMA具有更強的抵抗力,還需要進一步研究。

