血清抗繆勒氏管激素分析在多囊卵巢綜合征中的臨床應用研究
張秋敏
深圳市坪山區人民醫院,廣東深圳 518118
多囊卵巢綜合征(polycystic ovary syndrome,PCOS)是常見的內分泌紊亂綜合征,以慢性無排卵、卵巢多囊性改變、高雄激素改變為特征,育齡婦女多發[1]。研究發現血清AMH(抗繆勒氏管激素)的水平與竇卵泡計數(AFC,antral follicle count)間有強相關性,患者顯著特征之一為AFC 增加,每個卵泡的AMH 表達量也升高[2]。為了進一步研究AMH 在PCOS 中的臨床應用,特選取我院100 例PCOS 患者進行研究,現報道如下。
1 資料與方法
1.1 一般資料
選取我院2017年3月~2018年3月收治的PCOS 各年齡段患者100 例作為觀察組,患者年齡25~40 歲,平均(32.2±5.3)歲。入選標準采用2003年鹿特丹診斷標準[3]:(1)偶發排卵和(或)無排卵;(2)臨床和(或)生化指標提示高雄激素血癥,并排除先天性腎上腺增生、分泌雄激素腫瘤、Cushing(庫欣)綜合征等其他可能病因;(3)卵巢多囊性改變(ovarian polycystic changes ,PCO):B超檢查提示至少一側卵巢有≥12 個直徑2~9mm卵泡,和(或)卵巢體積增大>10mL,符合其中兩項者診斷為PCOS,排除甲狀腺功能紊亂、高催乳素血癥、先天性腎上腺增生癥患者。選取100 例健康受檢者作為對照組,患者年齡24~39 歲,平均(31.0±5.1)歲。兩組患者年齡等一般資料比較差異無統計學意義(P>0.05),所有受檢者均自愿參與此次研究并簽署知情同意書。
表1 兩組患者各項指標比較(±s)
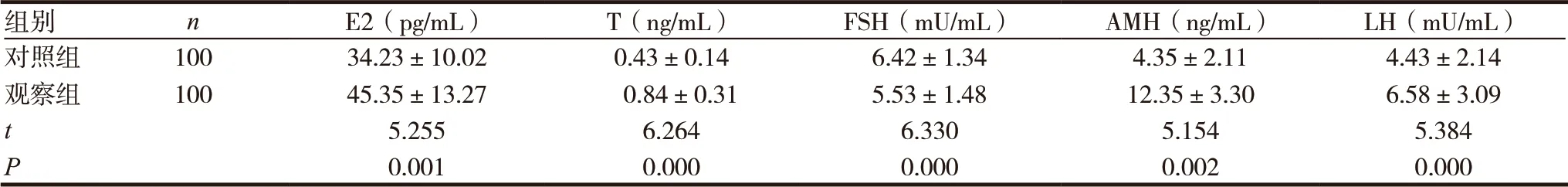
表1 兩組患者各項指標比較(±s)
組別 n E2(pg/mL) T(ng/mL) FSH(mU/mL) AMH(ng/mL) LH(mU/mL)對照組 100 34.23±10.02 0.43±0.14 6.42±1.34 4.35±2.11 4.43±2.14觀察組 100 45.35±13.27 0.84±0.31 5.53±1.48 12.35±3.30 6.58±3.09 t 5.255 6.264 6.330 5.154 5.384 P 0.001 0.000 0.000 0.002 0.000
1.2 方法
患者抽血前應該安靜休息,月經周期第2~5天晨起空腹采血(患者閉經期抽血時間隨意),3000r/min 離心10min 取血清-20℃低溫保存,測試儀器為Beckman Coulter UniCel DXI800 化學發光分析儀,采用酶聯免疫配套試劑。從冰箱中取出AMH試劑盒后平衡至室溫,打開鋁箔袋包裝,取出需要數量的試劑船后將其余的試劑船及干燥劑硅膠裝入密封袋內,排除空氣密封后2~8℃保存。在校準品1-2 和質控物中各加入1.0mL 去離子水,溶解10 分鐘,輕輕渦旋震蕩混勻備用。檢查位置4 中的底物,應為無色,否則應棄掉該試劑船。分別在每個試劑船的位置1 中加85μL 待測血清,或者加入85μL 校準品或質控物。每更換一個批號的試劑,應重新進行校準。放置試劑船到儀器中,按照使用說明書進行校準(若有必要)和檢測。本研究采用AMH -ELISA 測定試劑盒,選購獲得國家食品藥品監督管理局注冊登記的AMH 測定商品試劑盒,以保證檢測結果的準確可靠。
若治療后8 周內卵巢無排卵患者,給予50~100mg 氯米芬(cC)或rFSH 治療,用藥1~3個周期后出現排卵,則認為治療有效,療效欠佳,為卵巢低反應性;若治療后不管使用cC 與否卵巢均不能獲得排卵,則認為治療失敗,無療效,為卵巢無反應性,將低反應性和無反應性患者作為觀察組1。
若治療后8 周內卵巢有排卵,則認為治療有效,為卵巢高反應性,這些患者為觀察組2。
1.3 觀察指標
分析兩組患者雌二醇(E2)、睪酮(T)、卵泡刺激素(FSH)、抗繆勒氏管激素(AMH)、黃體生成素(LH)以及GLU(空腹血糖)、FINS(空腹胰島素)、HOMA-IR(homeostasis model assessment of insulin resistance),抗胰島素性穩態模式評估法。
1.4 統計學方法
應用SPSS19.0 統計軟件進行分析,ROC 曲線分析用于AMH 診斷性能的評價,用()表示計量資料,采用t和F檢驗,以P<0.05 為差異有統計學意義。
2 結果
2.1 治療前兩組患者各項指標比較
觀察組患者卵泡刺激素水平明顯低于對照組,雌二醇、睪酮、抗繆勒氏管激素、黃體生成素水平明顯高于對照組,差異有統計學意義(P<0.05),見表1。
2.2 兩組患者糖代謝指標比較
試驗組患者空腹血糖、空腹胰島素、HOMA-IR 明顯高于對照組,差異有統計學意義(P<0.05),見表2。
表2 兩組患者糖代謝指標比較(±s)
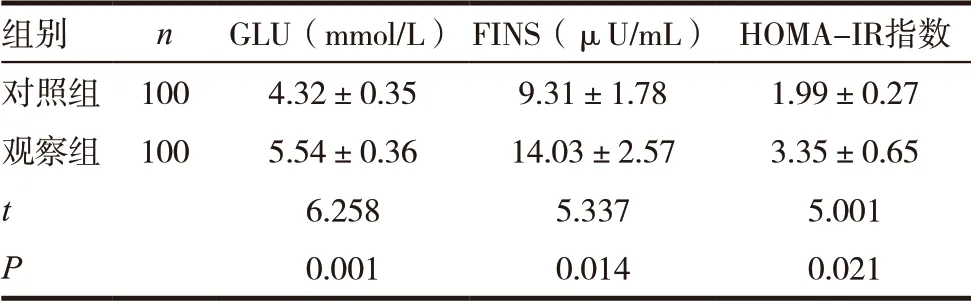
表2 兩組患者糖代謝指標比較(±s)
組別 n GLU(mmol/L) FINS(μU/mL) HOMA-IR指數對照組 100 4.32±0.35 9.31±1.78 1.99±0.27觀察組 100 5.54±0.36 14.03±2.57 3.35±0.65 t 6.258 5.337 5.001 P 0.001 0.014 0.021
2.3 治療后兩組患者AMH指標比較
觀察組2 患者AMH 明顯低于觀察組1 患者,差異有統計學意義(P<0.05),見表3。
表3 治療后兩組患者AMH指標比較(±s,ng/mL)

表3 治療后兩組患者AMH指標比較(±s,ng/mL)
注:與觀察組1 比較,△P <0.05
組別 n AMH對照組 100 4.35±2.11觀察組1 20 10.23±2.98觀察組2 80 5.08±1.91△F 7.662 P 0.001
3 討論
PCOS 是常見的婦科內分泌疾病,育齡婦女多見且高度多樣化,對女性生殖健康造成嚴重影響[4]。PCOS 患者不孕的主要原因是小竇狀卵泡過多、卵泡募集異常、優勢卵泡選擇障礙、小卵泡發育障礙等導致的不排卵,反復促排卵失敗的助孕成功的關鍵則是減少卵巢過度刺激、獲得適當數量的優質卵子[5]。PCOS 患者血清AMH 水平與代謝紊亂、內分泌間的關系成為研究的特點,多于糖代謝、激素代謝、慢性炎癥基因、肥胖基因等有關,干預患者激素代謝對于PCOS 治療有總要意義[6]。AMH 是糖蛋白激素,主要的作用為降低生長卵泡對FSH 的敏感性、抑制原始細胞的募集、調控卵泡的正常發育[7]。血清AMH 的水平與AFC(竇卵泡計數)間有較強的相關性,PCOS 患者中最顯著的內分泌特征之一就是竇卵泡數量的增加,PCOS 患者血清AMH 的水平通常是非PCOS 者的2~4 倍,并且每個卵泡的AMH 表達量也明顯增高[8]。AMH 在女性僅由卵巢分泌,由竇前卵泡和小竇卵泡產生,是生長和分化因子超家族中轉化生長因子-β 家族(TGF-β)中的成員,是目前外周血中能檢測到的最早的卵泡產生的物質[9]。
國內外研究發現AMH 在PCOS 治療后有變化,AMH 在自然月經周期各階段均無明顯波動不受月經周期和藥物等的影響,可以任意時間檢測[10-11]。本研究通過試驗得出結果:觀察組患者卵泡刺激素水平明顯低于對照組,雌二醇、睪酮、抗繆勒氏管激素、黃體生成素水平明顯高于對照組,試驗組患者空腹血糖、空腹胰島素、HOMA-IR 明顯高于對照組,觀察組2 患者AMH 明顯低于觀察組1 患者,差異有統計學意義(P<0.05)。PCOS 患者內分泌失調,過量的雄激素在外周組織轉化為雌酮,抑制卵泡發育同時雌酮反饋導致FSH 減少,從而導致LH 升高,并且卵泡失去周期性、對LH 更為敏感,優勢卵泡選擇受阻,發生跑路安障礙、多濾泡卵巢等[12-13]。而竇前卵泡產生的AMH 增加后會降低卵泡對FSH 的敏感性,從而加劇竇卵泡的聚集,因此AMH 濃度可作為準確反映卵巢竇卵泡數目的替代指標[14]。此次試驗結果也進一步證實,PCOS 治療有效的患者AMH 明顯下降。AMH 正常界值定為60pmol/L,不同研究中由于人群不同或不同亞型PCOS 病例混合導致AMH 診斷的界值也不同,不同類型的PCOS 患者AMH 水平差異較大。有研究顯示AMH 水平隨著PCOS 患者年齡的增長而降低,其降低速度慢于健康的女性,成負相關性,但是PCOS 患者血清AMH 水平與年齡并沒有統計學意義上的負相關性,因此此次研究患者均為20~40 歲的患者[15-16]。
綜上所述,血清AMH在PCOS 患者中明顯升高,較LH、E2、T、FINS 等具有更為穩定、方便的特點,在PCOS 診斷中具有重要價值,給予相應的早治療措施后能夠進一步提高治療的效果,值得臨床推廣使用,但是AMH 與睪酮的代謝以及是否相互調節等問題還需要更進一步的探討。

