多粘菌素B抑制絲狀真菌的定量測定方法研究
王志新,李昌旺,宏 丹,寧亞維,賈英民
(1.河北科技大學生物科學與工程學院,河北省發酵工程技術研究中心,河北石家莊 050018;2.北京工商大學食品學院,北京 100048)
抗菌肽(Antimicrobial peptides,AMPs)是一類具有抗菌生物活性小分子多肽物質的總稱,具有抑制或殺滅細菌、真菌以及病毒、腫瘤的能力[1]。天蠶素是發現的第一個小分子抗菌肽[2],此后,相繼從昆蟲[3]、植物[4]、微生物[5-6],包括人體[7]中發現了2000多種抗菌肽。研究發現,抗菌肽具有抑菌譜廣、抑菌活性高、性質穩定、不易產生耐藥性等優良特性,作為抗生素的良好替代品已引起人們極大關注[1,8]。
目前市面上抗菌肽產品種類眾多,但被批準使用的較少,其中乳酸鏈球菌素已被批準用于食品防腐劑[9],短桿菌肽S、多粘菌素B和林蛙抗菌肽可用于制造皮膚軟膏[10-11],那西肽在歐盟和日本被批準用于飼用添加劑[12]。抗菌肽應用前首先要進行功效評價,然而,由于其來源廣泛、結構多樣、差異較大,致使其評價方法眾多[5,13-15]。在活力評價方面,抗菌肽尚未形成統一的評價體系或標準方法,導致其定量測定方法不統一,產品良莠不齊、缺乏可比性,因此亟需建立和完善抗菌肽的活性測定方法,并制定相關的標準,以保證抗菌肽產業的健康發展。
關于抗菌肽抑制細菌的測定方法研究較多[5,16],而對于真菌研究主要集中在酵母菌和植物病原真菌上[10,17],對引起食品腐敗菌的曲霉菌、青霉菌、毛霉菌等絲狀真菌的研究較少。國內外對于抗菌肽抑制真菌能力評價方法大多借鑒抗生素的測定方法,其中應用較廣泛的是微生物檢定法,包括微量稀釋法、平板擴散法(紙片擴散法、管碟法或打孔法)、孢子萌發抑制法和菌絲生長抑制法等[14,18-19]。其中較權威的是《中華人民共和國藥典》(2015版第四部)推薦的管碟法和濁度法[20],以及美國國家臨床和實驗室標準化委員會(CLSI)推薦的微量肉湯稀釋法M38-A[21]。然而,藥典中評價生物活性時,需要以標準樣品來標定,而抗菌肽種類多、結構復雜,利用標準樣品評價時難度大;而微量稀釋法若采用肉眼觀察判斷渾濁度具有一定誤差,若采用光譜法判讀則受到孢子顏色、大小和形狀的影響,有學者提議針對不同指示菌采用不同的判斷依據[22],但操作起來更為繁雜,應用上具有一定局限性;同時,在進行抑制絲狀真菌實驗時,真菌菌體較大且菌絲茂盛,因此,稀釋法和擴散法不易獲得準確結果,通常采用抑制孢子萌發和抑制菌絲生長這2種方法來衡量抗菌肽對絲狀真菌的抑制作用。
在方法建立過程中一般采用標準物質進行研究,針對本研究而言,主要考慮的是抗菌肽和指示菌。市面上銷售的抗菌肽產品種類眾多,但是目前常用作標準物質的有乳酸鏈球菌素、那西肽、桿菌肽、短桿菌肽、多粘菌素等。文獻報道顯示(表1),對真菌具有抑制作用的抗菌肽有微生物源抗菌肽(桿菌肽、短桿菌肽S和多粘菌素B)、昆蟲類抗菌肽(天蠶素、昆蟲防御素)以及魚類、兩棲類及哺乳動物類抗菌肽。其中報道較多、使用較廣的為微生物源抗菌肽——桿菌肽、多粘菌素B。多粘菌素B對真菌和革蘭氏陰性菌均可以產生較好抑菌效果[10,23],桿菌肽對真菌的抑制作用稍弱于革蘭氏陽性細菌[24],短桿菌肽S對真菌和革蘭氏陽性菌的抑制作用較好[25],但近年短桿菌肽S的應用逐漸減少。

表1 幾種常見的抗菌肽及其生物活性Table 1 Common antimicrobial peptides and the antimicrobial activities
在抗菌肽抑制真菌中,研究較多的是對植物病原菌的抑制,其指示菌一般選擇鐮刀菌、立枯絲核菌等[10],但對引起食品和谷物腐敗或霉變的霉菌研究較少,本研究選擇常用的真菌指示菌——黑曲霉和青霉[33]。由于抗菌肽對真菌的抗菌方式各不相同,所選的指示菌應具有一定代表性,一般選擇標準菌株或質控菌株,綜合考慮,本研究選用標準菌株A.nigerATCC 16404和P.chrysogenumATCC 10106作為指示菌。
在絲狀真菌生長培養基的選擇中,文獻報道大部分采用馬鈴薯葡萄糖瓊脂培養基(PDA)和察氏培養基[18,34],考慮PDA培養基為天然原料,制備時成分不穩定,而察氏培養基為化學合成原料,成分穩定,因此,測定方法標準化時考慮重現性等問題,本研究優先選擇察氏培養基作為絲狀真菌生長的培養基。因此,本研究以多粘菌素B為抗菌肽研究對象,以黑曲霉和產黃青霉為指示菌,通過比較孢子萌發抑制法和菌絲生長抑制法篩選抗菌肽抑制絲狀真菌的定量測定方法,并進一步優化該方法的最適測定條件,為解決抗菌肽評定指標不統一、評價方式混亂等問題奠定基礎。
1 材料與方法
1.1 材料與儀器
黑曲霉(AspergillusnigerATCC 16404)、產黃青霉(PenicilliumchrysogenumATCC 10106) 本實驗室保存;多粘菌素B(polymyxin B)、桿菌肽 USP級,上海麥克林生化科技有限公司;合成肽(天蠶素Cecropin A、天蠶素Cecropin B、滑爪蟾素Magainin Ⅱ、黑斑側褶蛙素Esculentin-1A、防御素LL-37) 90%,上海強耀生物科技有限公司;馬鈴薯葡萄糖肉湯培養基(PDB) BR級,北京索萊寶生物科技有限公司;一次性平板(Φ=90 mm) 江蘇康健醫療用品有限公司。
CX31顯微鏡 日本奧林巴斯株式會社;CD-15AX游標卡尺 日本Mitutoyo(三豐)有限公司;Scan1200全自動菌落計數儀 法國Interscience公司;OMP200A分析天平 上海精密儀器有限公司;打孔器 泰州市刁鋪光學儀器有限公司;SW-CJ-1FD超凈工作臺 蘇州安泰空氣技術有限公司;ZSD-A1160恒溫培養箱 上海智城分析儀器制造公司。
1.2 實驗方法
1.2.1 培養基配制 察氏培養基:氯化鉀0.5 g/L、蔗糖30.0 g/L、硫酸亞鐵0.01 g/L、磷酸氫二鉀1.0 g/L、硝酸鈉3.0 g/L、無水硫酸鎂0.5 g/L和瓊脂20.0 g/L、121 ℃高壓蒸汽滅菌15 min備用。
1.2.2 指示菌孢子懸液及菌餅制備 孢子懸液制備:取麩皮管中保藏的指示菌接種于察氏培養基上,28 ℃恒溫培養3 d,用0.5%葡萄糖溶液洗脫孢子,血球計數板計數,將孢子懸液調整至106個/mL,備用。菌餅制備:將上述制備的孢子懸液,取100 μL涂布于察氏培養基,28 ℃恒溫培養24~30 h,待菌絲長滿平板后,用滅菌打孔器自菌落邊緣切取菌餅,備用。
1.2.3 抗菌肽篩選 按照1.2.2的方法制備A.nigerATCC 16404和P.chrysogenumATCC 10106的孢子懸液,并涂布100 μL于察氏培養基,獲得檢測平板。將多粘菌素B、桿菌肽和5種合成肽分別配制成1 mg/mL的多肽溶液,參照中國藥典(2015版第四部)抗生素的管碟測定法[20],在上述制備的檢測平板上放入牛津杯,每杯添加100 μL多肽溶液,4 ℃預擴散6~10 h,取出放入28 ℃的培養箱中培養24~30 h,測量抑菌圈直徑。
1.2.4 多粘菌素B抑制絲狀真菌評價方法篩選
1.2.4.1 孢子萌發抑制法 配制10.00 mg/mL的多粘菌素B溶液,然后分別與1.2.2制備的孢子懸液等體積混合進行二倍梯度稀釋,得到多粘菌素B終濃度為0.16、0.31、0.63、1.25、2.50和5.00 mg/mL,然后分別滴加入凹玻片中,架放于帶有淺層水的培養皿中,加蓋保濕,28 ℃培養8~18 h,并以不加多粘菌素B的作對照。每個實驗組隨機觀察3個以上視野,調查孢子總數應大于200個,分別記錄各組萌發情況和孢子總數(孢子萌發:孢子牙管長于孢子短半徑)。根據式(3)[35]計算實驗組的孢子萌發相對抑制率,以多粘菌素B濃度的對數值為橫坐標,通過生物統計幾率值換算表,以相對抑制率對應的幾率值為縱坐標,計算每個實驗濃度的回歸方程和相應的EC50值。
式(1)
式中:R:孢子萌發率(%);Ng:孢子萌發數(個);Nt:孢子總數(個)。
式(2)
式中:Re:實驗校正孢子萌發率(%);Rt:實驗組孢子萌發率(%);R0:對照組孢子萌發率(%)。
式(3)
式中:I:孢子萌發相對抑制率(%);R0:對照組孢子萌發率(%);Re:實驗校正孢子萌發率(%)。
1.2.4.2 菌絲生長抑制法 配制濃度為5.00、10.00、20.00、30.00、40.00和50.00 mg/mL的多粘菌素B溶液,分別取5 mL與冷卻至50 ℃的察氏培養基混勻,培養基中多粘菌素B最終濃度分別為0.17、0.33、0.67、1.00、1.33和1.67 mg/mL。將含有多粘菌素B的察氏培養基倒入平板,每個平板20 mL,制備含多粘菌素B的平板,以不含多粘菌素B的平板作對照。參照Chen等[36]的菌絲生長抑制法加以修改,將含肽平板用打孔器打孔留空,然后將1.2.2中制成的直徑(5.80±0.02) mm的A.nigerATCC 16404和P.chrysogenumATCC 10106菌餅分別接種于留空處,菌絲面朝上,28 ℃培養。根據對照組平板中菌絲生長情況觀察實驗組的生長情況,游標卡尺測量菌絲直徑,每一個菌落采用十字交叉法垂直測量各一次,取其平均值。
按照式(5)計算各實驗組對指示菌的生長抑制率[37],以多粘菌素B濃度的對數值及菌絲生長抑制率對應的幾率值進行回歸性分析,計算多粘菌素B的EC50值。
D(mm)=D1-D2
式(4)
式中:D:菌落增長直徑(mm);D1:菌落直徑(mm);D2:菌餅直徑(mm)。
式(5)
式中:I:菌絲生長抑制率(%);D0:對照組菌落增長直徑(mm);Dt:實驗組菌落增長直徑(mm)。
1.2.5 菌絲生長抑制法的條件研究
1.2.5.1 培養時間的研究 按照1.2.4.2的方法制備含肽平板,多粘菌素B在培養基中的濃度分別為0.17、0.33、0.67、1.00、1.33和1.67 mg/mL,分別將直徑(5.80±0.02)mm的兩種絲狀真菌菌餅接種于含多粘菌素B的平板,以不含多粘菌素B的平板作對照,28 ℃培養,分別于36、48、60和72 h測量菌絲直徑,計算EC50值。
1.2.5.2 菌餅大小的研究 利用打孔器制備直徑分別為(5.80±0.02)、(8.00±0.02)和(10.00±0.02) mm的兩種絲狀真菌的菌餅,分別接種至1.2.4.2配制的不同濃度的多粘菌素B平板上,以不含多粘菌素B的平板作對照,28 ℃培養,A.nigerATCC 16404于48 h測量菌絲直徑,P.chrysogenumATCC 10106于72 h測量菌絲直徑,計算EC50值。
1.3 數據處理
每組實驗進行三個平行,數據取其平均值,采用SPSS 18.0軟件進行絲狀真菌抑制率的統計分析。
2 結果與分析
2.1 抗菌肽的選擇
研究7種抗菌肽對A.nigerATCC 16404和P.chrysogenumATCC 10106的抑制性,結果見表2。由表2可知,多粘菌素B能夠抑制這兩種指示菌,且抑菌效果好,抑菌圈直徑大于15 mm,因此,本研究的抗菌肽選擇多粘菌素B。

表2 7種抗菌肽對指示真菌的抑制性Table 2 The antimicrobial activities of 7 kinds of antimicrobial peptides against the indicator fungi
2.2 多粘菌素B抑制絲狀真菌測定方法的比較
2.2.1 孢子萌發抑制法 通過比較孢子萌發抑制法與菌絲生長抑制法研究多粘菌素B對A.nigerATCC 16404和P.chrysogenumATCC 10106的抑制作用。研究發現,在孢子萌發抑制法測定中,采用0.5%葡萄糖培養孢子,對照組的孢子萌發率低,約為40%,達不到測定方法中要求的90%以上[35],而添加多粘菌素B的實驗組萌發率更低。有報道[18]顯示可以采用培養基替代葡萄糖進行孢子萌發,基于此,本研究采用PDB培養基進行真菌孢子萌發的實驗。
結果顯示,未添加多粘菌素B的對照組其孢子萌發率約為80%,而添加多粘菌素B的實驗組的孢子萌發率均低于對照組,其對孢子萌發的抑制率結果見表3,回歸性分析見表4。表3顯示,隨著多粘菌素B濃度的增加,A.nigerATCC 16404和P.chrysogenumATCC 10106的孢子萌發抑制率逐漸增大,對抑制率進行統計分析(表4),2株菌的卡方均偏大,可見實際測定的孢子萌發抑制率與通過方程得到的理論值間差異較大。同時,參照農業部行業標準[35],其在結果調查中要求對照組的孢子萌發率達到90%以上,而本實驗未達到相關標準條件。因此,孢子萌發率法不適合評價多粘菌素B對A.nigerATCC 16404和P.chrysogenumATCC 10106的抑制性。
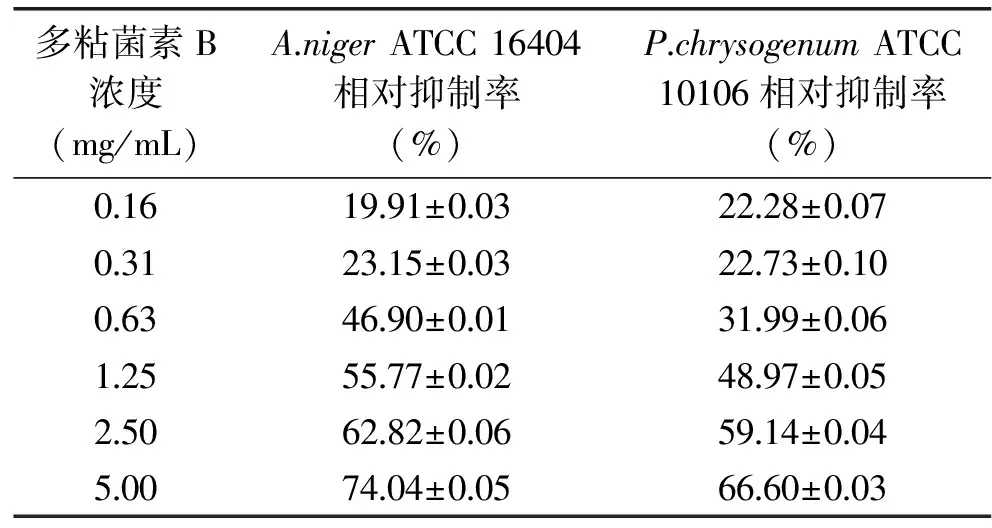
表3 多粘菌素B對指示菌孢子萌發的抑制率Table 3 Inhibition rate of polymyxin B against conidial germination of A.niger and P.chrysogenum strains
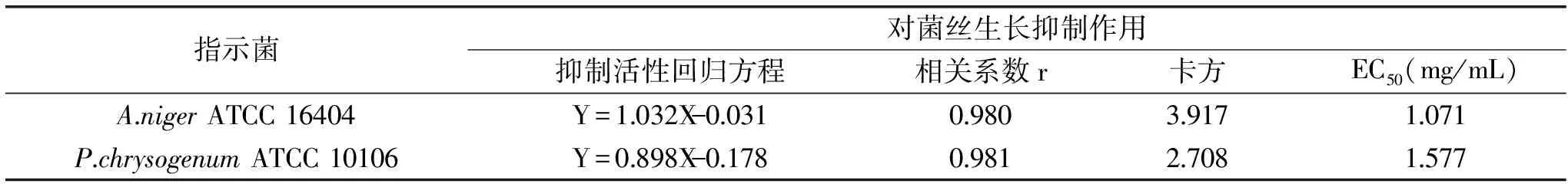
表4 多粘菌素B對指示菌孢子萌發抑制作用分析Table 4 Analysis the inhibition of polymyxin B against conidial germination of A.niger and P.chrysogenum strains
2.2.2 菌絲生長抑制法 多粘菌素B對指示菌菌絲生長抑制率的結果見表5。由表5可知,真菌菌絲的生長均受到多粘菌素B的抑制,隨著多粘菌素B濃度的增大,對絲狀真菌的抑制作用增強,當濃度為1.67 mg/mL時,對2株指示菌的抑制率均在80.00%左右。
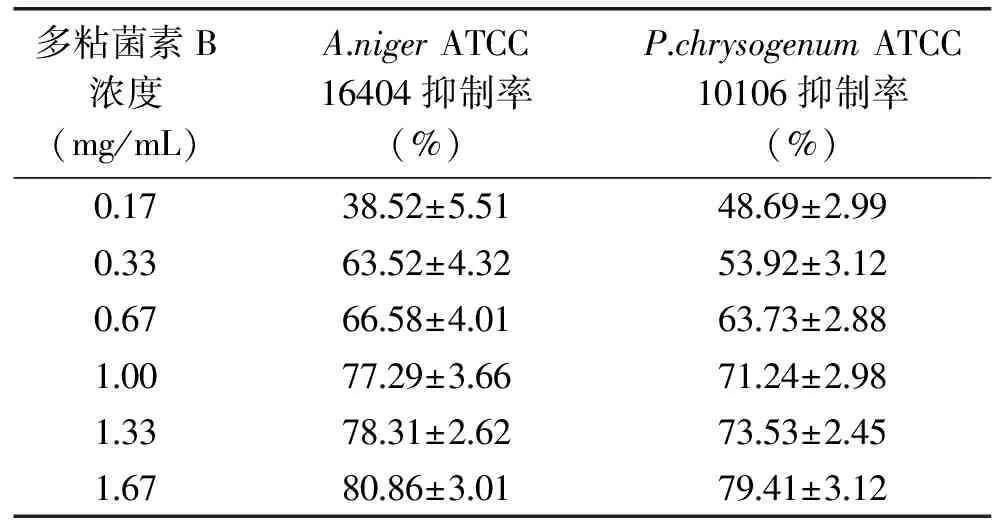
表5 多粘菌素B對指示菌菌絲生長的抑制率Table 5 Inhibition rate of polymyxin B against mycelial growth of A.niger and P.chrysogenum strains
根據多粘菌素B濃度對數值及對應的菌絲生長抑制率的幾率值進行回歸性及卡方分析,結果如表6所示。
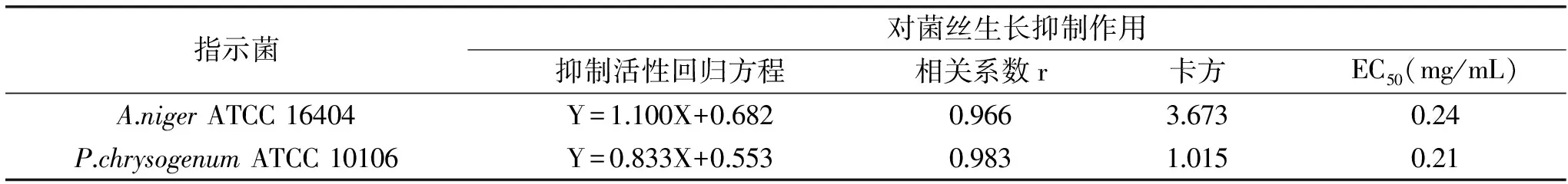
表6 多粘菌素B對指示菌菌絲生長抑制作用分析Table 6 Analysis the inhibition of polymyxin B against mycelial growth of A.niger and P.chrysogenum strains
對菌絲生長抑制法的抑制率進行分析,由表6可知,除多粘菌素B對A.nigerATCC 16404的相關系數r較孢子萌發抑制法的偏小外,其他分析結果均與孢子萌發抑制法相差不大或優于孢子萌發抑制法,尤其是其卡方均小于孢子萌發抑制法的數值,說明菌絲生長抑制法測定的數值與通過方程得到的預測值更為接近,而且多粘菌素B對菌絲生長的抑制作用相對孢子萌發作用強,其EC50均小于1.0 mg/mL。可見,菌絲生長抑制法能夠較為準確地檢測多粘菌素B的抑菌活性。綜合考慮,本研究選擇菌絲生長抑制法研究多粘菌素B對絲狀真菌的活性定量分析。
2.3 A. niger ATCC 16404菌絲生長抑制法的研究
在菌絲生長抑制性研究中,菌餅的大小在一定程度上反映了真菌的數量,而培養時間會影響菌絲的最終狀態,因此二者均會影響測定結果的穩定性和精確性,需要嚴格控制。
2.3.1 培養時間的研究 以平板中多粘菌素B濃度為0.33 mg/mL為例,觀察不同培養時間下A.nigerATCC 16404菌絲生長的情況(圖1),如圖1所示,隨著培養時間的延長,菌絲開始生長,逐漸向菌餅四周延伸,隨著菌絲的生長,形成的菌落圓且邊緣整齊,易于菌落直徑的測量。
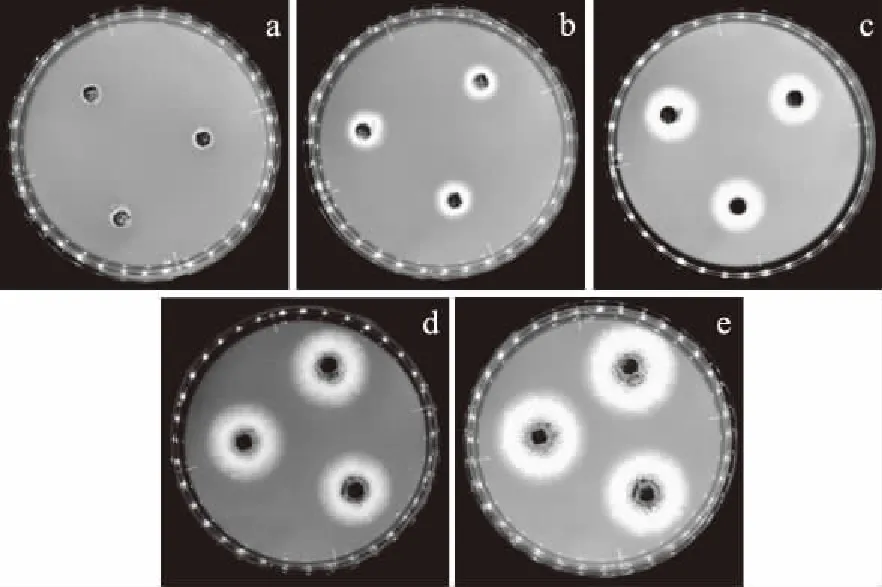
圖1 培養時間對含肽平板上A.niger ATCC 16404菌絲生長的影響
統計不同培養時間下,多粘菌素B對A.nigerATCC 16404菌絲生長抑制率的結果(表7),并進行回歸性分析(表8)。
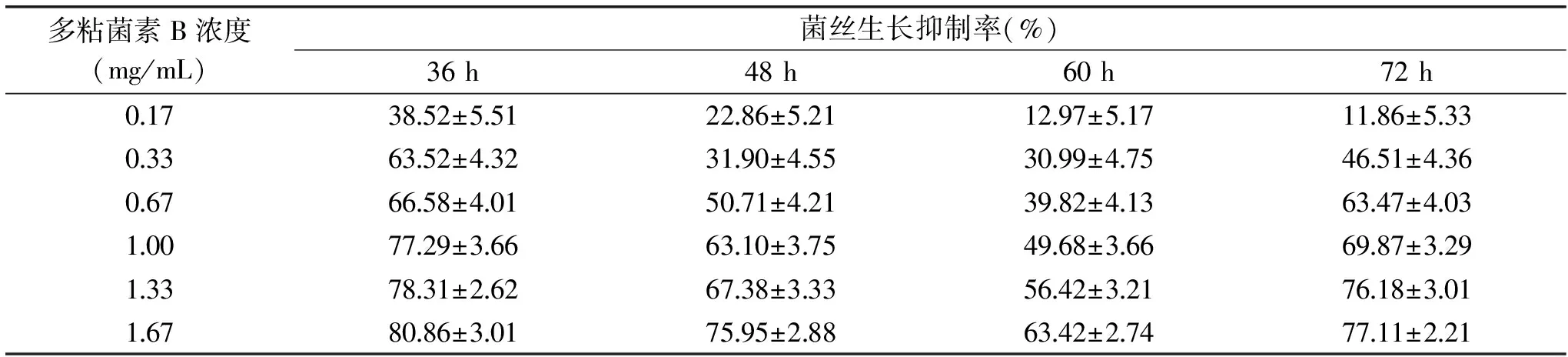
表7 培養時間對A.niger ATCC 16404菌絲生長抑制率的影響Table 7 Effects of culture time on the inhibition rate of mycelial growth of A.niger ATCC 16404
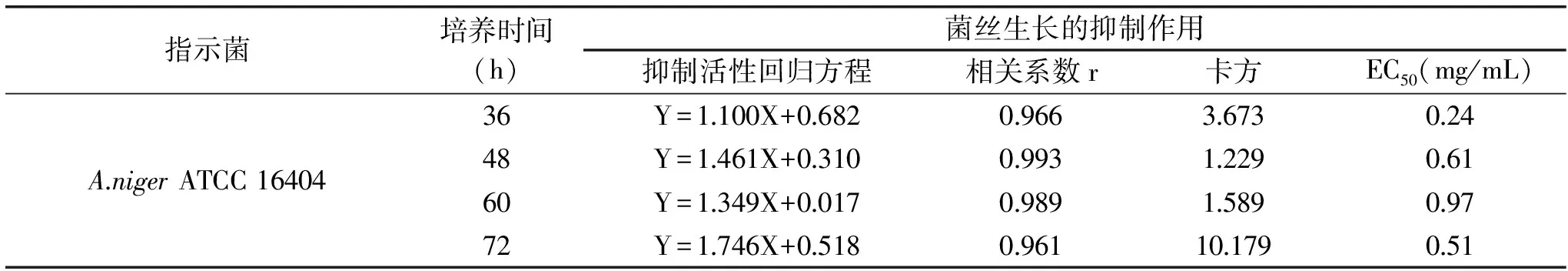
表8 培養時間影響A.niger ATCC 16404菌絲生長抑制作用的分析Table 8 Analysis the inhibition of mycelial growth of A.niger ATCC 16404 in different culture time
由表7可知,多粘菌素B的抑菌能力隨著時間的延長,呈現先降低后上升的現象,36 h的抑制率最高,其次是72 h,但是二者的相關系數r偏小、卡方偏大,說明線性回歸性下降,且實際測定值與通過方程得到的理論值偏離較大,數據準確性不高,不適合用于抑菌活性的測定(表8)。綜合比較48和60 h的分析結果,48 h的線性關系和準確度高,能充分代表此時抗菌肽的抑菌能力,且減少了時間和成本投入,因此本研究選擇48 h為最適的培養時間。在此條件下,多粘菌素B對A.nigerATCC 16404的EC50為0.61 mg/mL。
2.3.2 菌餅大小對菌絲生長的影響 不同直徑菌餅的A.nigerATCC 16404菌絲生長情況見圖2,由圖2可以看出,菌絲圍繞菌餅均勻擴展,呈現圓形且邊緣整齊,測量誤差小。
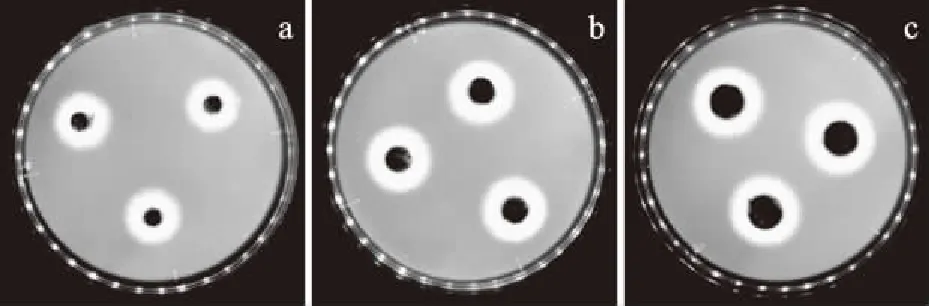
圖2 菌餅直徑對含肽平板上A.niger ATCC 16404菌絲生長的影響
不同菌餅直徑對菌絲生長抑制率的結果見表9,對抑制率進行線性回歸分析,分析結果見表10。
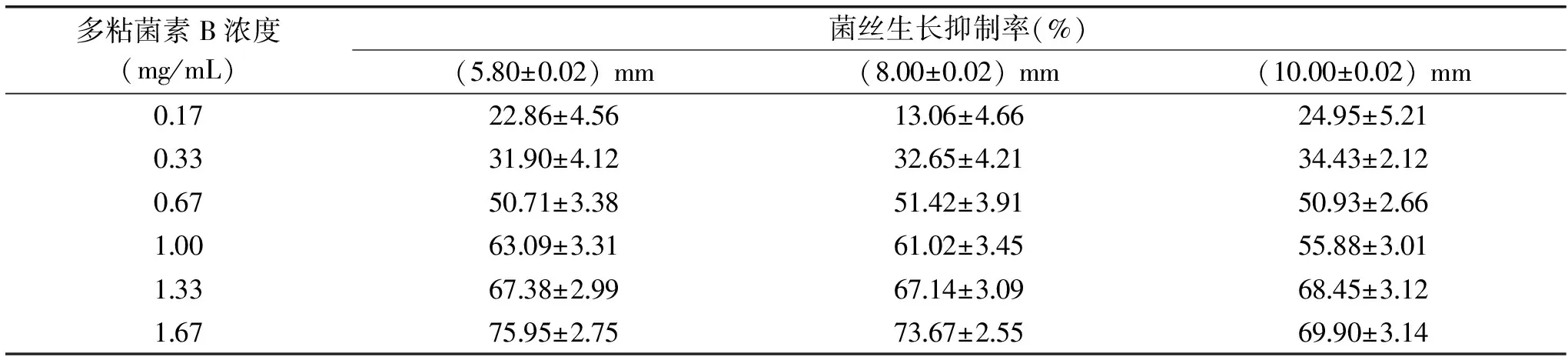
表9 菌餅大小對A.niger ATCC 16404菌絲生長抑制率的影響Table 9 Effect of mycelium plug diameter on the inhibition rate of mycelial growth of A.niger ATCC 16404

表10 菌餅大小影響A.niger ATCC 16404菌絲生長抑制作用的分析Table 10 Analysis the inhibition of mycelial growth of A.niger ATCC 16404 with different plug diameter
表9和表10顯示,菌餅直徑對抑菌率的影響不大,參考卡方與相關系數r可知,接種菌餅直徑(8.00±0.02) mm時,線性關系與精確度都是最佳的,因此選擇(8.00±0.02) mm直徑的菌餅,此時多粘菌素B對A.nigerATCC 16404的EC50是0.68 mg/mL。
2.4 P. chrysogenum ATCC 10106菌絲生長抑制法的研究
2.4.1 培養時間的研究 為進一步驗證菌絲生長抑制法的可行性,將多粘菌素B用于另一株絲狀真菌P.chrysogenumATCC 10106的抑菌性研究中。研究了多粘菌素B對P.chrysogenumATCC 10106菌絲生長抑制的最適培養時間,其菌絲生長狀態見圖3,菌絲生長抑制率見表11,統計分析結果見表12。
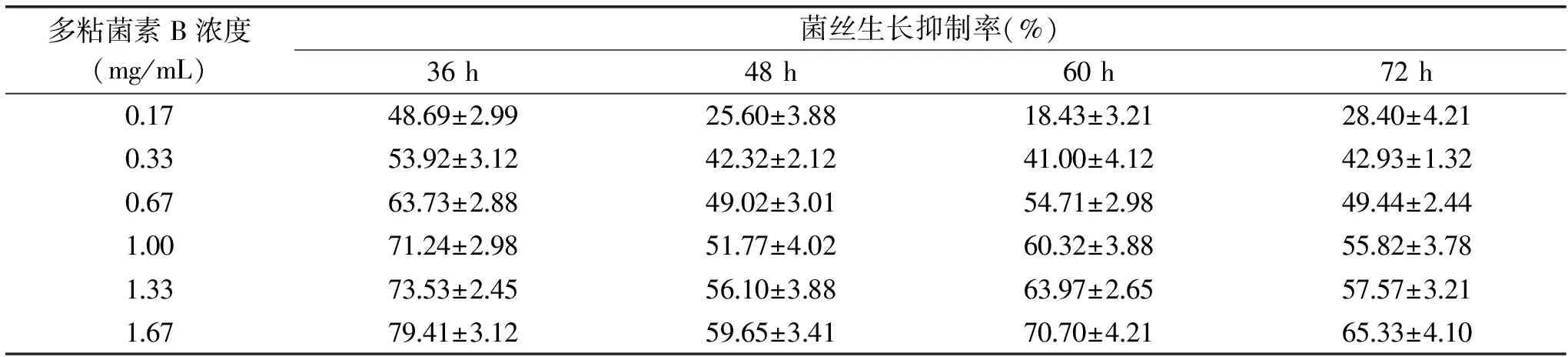
表11 培養時間對P.chrysogenum ATCC 10106菌絲生長抑制率的影響Table 11 Effect of culture time on the inhibition rate of mycelial growth of P.chrysogenum ATCC 10106
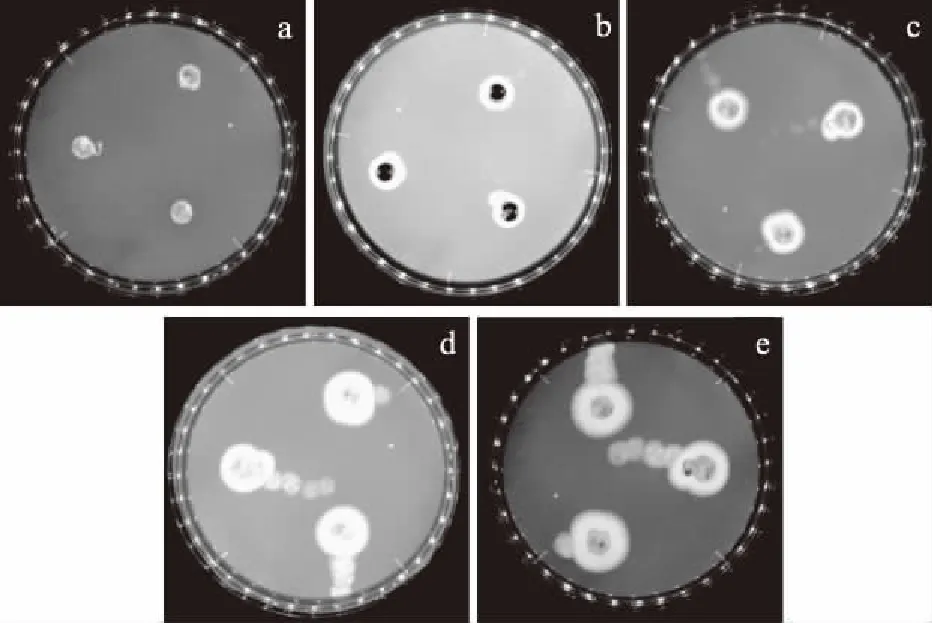
圖3 培養時間對含肽平板上P.chrysogenum ATCC 10106菌絲生長的影響
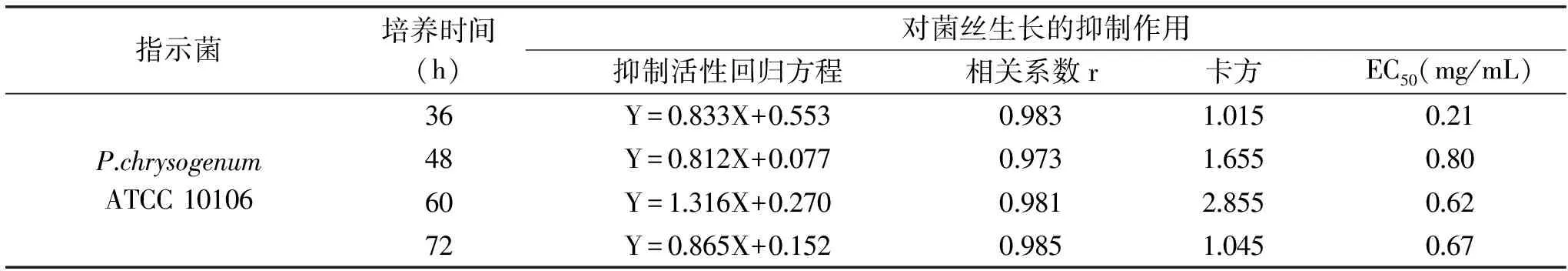
表12 培養時間影響P.chrysogenum ATCC 10106菌絲生長抑制作用的分析Table 12 Analysis the inhibition of mycelial growth of P.chrysogenum ATCC 10106 in different culture time
由圖3可知,隨著培養時間的延長,P.chrysogenumATCC 10106菌絲開始從菌餅處向含肽的平板上延伸生長,菌絲生長均勻致密,便于直徑的測量。由表11的抑制率數據可以看出,抑制率隨培養時間先下降后基本穩定,48 h時的抑菌率下降明顯,此后隨著時間的延長抑制率基本穩定。表12的統計分析顯示,36、72 h的卡方小,準確性較高,比較這2個時間下的相關系數r,二者沒有明顯差異(p<0.05),線性回歸性均較好,考慮36 h菌絲生長量較少,易造成測量誤差,綜合分析,選擇72 h為合適的培養時間,此時多粘菌素B對P.chrysogenumATCC 10106的EC50是0.67 mg/mL。
2.4.2 菌餅大小對菌絲生長情況的影響 不同直徑的P.chrysogenumATCC 10106菌餅在多粘菌素B平板上的生長情況見圖4,生長抑制率結果見表13和表14。
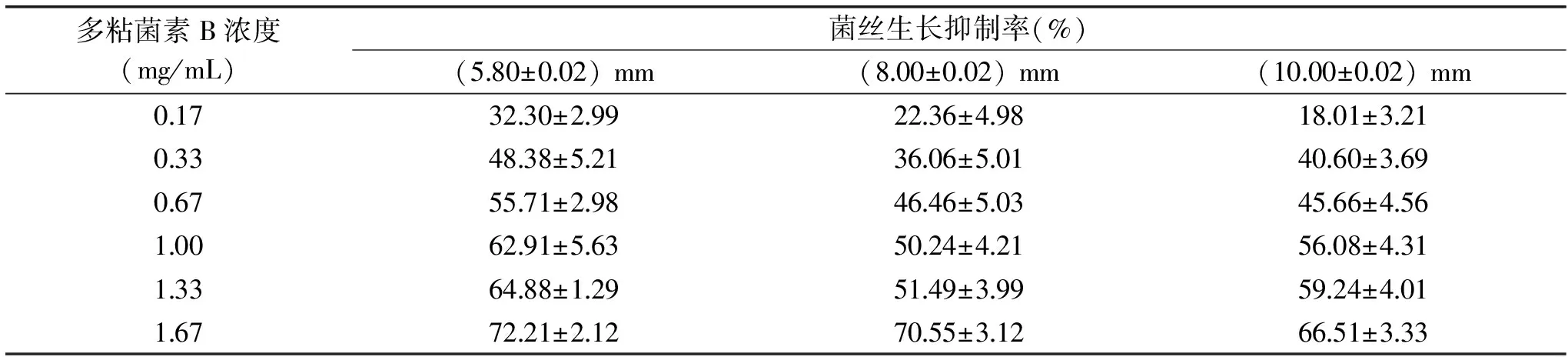
表13 菌餅大小對P.chrysogenum ATCC 10106菌絲生長抑制率的影響Table 13 Effect of mycelium plug diameter on the inhibition rate of mycelial growth of P.chrysogenum ATCC 10106

表14 菌餅大小影響P.chrysogenum ATCC 10106菌絲生長抑制作用的分析Table 14 Analysis the inhibition of mycelial growth of P.chrysogenum ATCC 10106 with different plug diameter
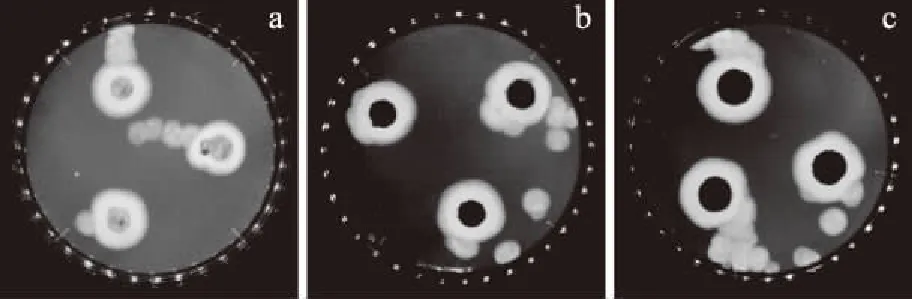
圖4 菌餅直徑對含肽平板上P.chrysogenumATCC 10106菌絲生長的影響
圖4顯示,接種菌餅后所形成的菌落較圓且邊緣較整齊,測量誤差較小。表13表明,隨著菌餅直徑的不斷增大,抑制率逐漸降低;表14表明參考卡方與相關系數r可知,在接種菌餅直徑為(5.80±0.02) mm時,線性關系與準確度均是最優的,因此,選擇(5.80±0.02) mm直徑的菌餅,此時多粘菌素B對P.chrysogenumATCC 10106的EC50是0.45 mg/mL。
3 討論與結論
在抗菌肽抑制絲狀真菌的活力定量測定中,本研究發現菌絲生長抑制法較孢子萌發抑制法更為準確。目前采用菌絲生長抑制法進行抑菌物質活力測定時,常用于分析的抑菌物質多為抗生素[38]、農藥殺菌劑[21,37]、中草藥提取物[36]、化學防腐劑[39]等,用于抗菌肽活力測定的研究較少,且還未形成相關的定量測定標準或評價方法。在此基礎上,本研究進一步建立了菌絲生長抑制法的定量測定條件:多粘菌素B抑制A.nigerATCC 16404檢測中,接種(8.00±0.02) mm直徑的菌餅于含多粘菌素B的察氏培養基平板,培養48 h,測得多粘菌素B的EC50是0.68 mg/mL;多粘菌素B抑制P.chrysogenumATCC 10106研究中,選擇接種的菌餅直徑(5.80±0.02)mm,培養時間72 h,此時多粘菌素B的EC50是0.45 mg/mL。本研究通過控制接種量和培養時間,保證了測定方法的精確度與線性回歸性;利用2種絲狀真菌進行抑菌方法研究,驗證了方法的可行性。

