不同甲醇流加速率對植酸酶工程菌發酵產酶的影響
王旺 李遠鋒 林影 梁書利
摘 要:為了確定植酸酶發酵過程中最合適的甲醇流加速率,對畢赤酵母工程菌15L罐發酵生產植酸酶的工藝條件進行了研究,通過控制3種甲醇流加速率,探討不同甲醇流加速率條件下的畢赤酵母工程菌的植酸酶產量。
關鍵詞:畢赤酵母;植酸酶;甲醇流加速率;發酵優化
中圖分類號:TQ922 文獻標識碼:A 文章編號:1671-2064(2019)09-0254-03
植酸酶(EC 3.1.3.8或EC 3.1.3.26)是催化植酸及植酸鹽水解成肌醇與磷酸(磷酸鹽)的酶類總稱,一方面它可以有效提高動物對磷的吸收利用率,提高飼料的營養價值;另一方面可減少動物糞便中磷排泄量,從而減少環境的磷污染[1]。目前,養殖業對植酸酶的需求越來越大,2010年國際植酸酶峰會報道,全球植酸酶市場占飼料酶市場60% 以上,產值3.5億美元/年,家禽和豬飼料大約70%都添加植酸酶[2]。與此同時,植酸酶的生產成本也日益受到關注[3]。因此,提高植酸酶產量并降低其生產成本成為當前植酸酶研究和生產的重要課題。
畢赤酵母產植酸酶發酵工藝的優化已有許多相關報道。趙凱等[3,4]考察了不同比生長速率和誘導濕重對重組畢赤酵母基因工程菌Mut+發酵生產植酸酶的影響。閔兆升等[5]采用單因素試驗和正交試驗對畢赤酵母工程菌H311產植酸酶的發酵工藝條件進行了優化。黃魁英等[6]對耐高溫植酸酶畢赤酵母工程菌PEY-2中試發酵條件進行了研究。
甲醇流加對微生物發酵影響的研究也有報道。李清亮等[7]考察了5L發酵罐中三種甲醇流加策略(恒溶氧、恒比生長速率和恒甲醇濃度)對重組畢赤酵母表達人肝再生增強因子(hALR)的影響,實驗結果表明控制恒定甲醇濃度進行誘導發酵,甲醇比消耗速率和hALR表達速率顯著高于其它兩種流加策略。陳多等[8]依據已有畢赤酵母發酵動力學模型,設定最優化問題,利用迭代循環確定最優乘子并求解最優甲醇流加軌跡,實驗證明優化后的甲醇流加方法可以使畢赤酵母表達的鼠李糖苷酶產量提高15%。王水蓮等[9]考察了不同甲醇流加濃度對重組畢赤酵母發酵生產腺苷蛋氨酸(SAMe)的影響,在發酵過程中控制發酵液中甲醇濃度并測定外源蛋白表達量,實驗結果表明當補加甲醇的量為0.5%時腺苷蛋氨酸表達量最高。
畢赤酵母發酵生產植酸酶的過程中,甲醇作為發酵過程中的碳源和誘導劑,其流加策略、流加速率及誘導方式都直接影響菌體的生長與外源蛋白的表達。當甲醇流加速率過低時,甲醇濃度不足,菌體的生長和外源蛋白的表達都將受到抑制,而甲醇流加速率過高則會造成菌體中毒,抑制菌體生長時[10]。目前,通過甲醇流加速率控制甲醇濃度對畢赤酵母發酵生產植酸酶方面的研究未見報道。本文研究了3.5g/(L·h)、5.5g/(L·h)、7.5g/(L·h)這3種甲醇流加速率下,畢赤酵母工程菌GAP-P180-AOX-HAC1-YNP01(簡寫為GAY1)的生長與產酶變化,確定了最適合畢赤酵母工程菌GAY1發酵積累植酸酶的甲醇流加速率。
1 儀器與材料
1.1 實驗材料
(1)菌株。菌株為前期工作所構建的基因工程菌株GAY1(基于畢赤酵母,通過基因改造手段獲得),華南理工大學酶學與酶工程實驗室保種。(2)試劑。酵母粉、蛋白胨、葡萄糖、十二烷基苯磺酸鈉(SDS)、磷酸二氫鉀、磷酸氫二鉀、無氨基酵母氮源YNB(含硫酸銨)、生物素、丙烯酰胺、四甲基乙二胺(TEMED)、過硫酸銨、甲醇、甘油、釩酸銨、鉬酸銨、硝酸、乙酸、乙酸鈉、植酸鈉。(3)培養基和終止顯色液。YPD種子培養基(1L):10g酵母粉,20g蛋白胨,10g葡萄糖。
BSM發酵培養基:1.49%(W/V)七水硫酸鎂,0.094%(W/V)硫酸鈣,1.82%(W/V)硫酸鉀,2.67%(V/V)磷酸,0.413%(W/V)氫氧化鉀,4%(W/V)甘油,121℃蒸汽滅菌30min,冷卻至30℃,添加0.435%(V/V)PTM1。
PTM1微量元素溶液:0.08g碘化鈉,6.00g五水硫酸銅,0.02g硼酸,20.00g氯化鋅,3.00g一水硫酸錳,0.20g二水鉬酸鈉,0.50g氯化鈷,0.20g生物素,65.00g七水硫酸亞鐵,1mL濃硫酸,用去離子水定容至1L,再用0.22μm孔徑無菌水相濾膜過濾,4℃保藏備用。
硝酸溶液:濃硝酸與水按體積比1:2混合均勻。
終止顯色液:硝酸、100g/L鉬酸銨、2.35g/L釩酸銨按體積比2:1:1混合,現用現配。
1.2 方法
(1)種子培養。將保藏菌種接種到YPD平板上劃線,30℃培養24h,從平板培養基上挑取酵母單克隆接種于10mL YPD液體培養基中,在30℃,250r/min條件下培養18-24h,再按照10%接種量接種YPD培養基擴培18-24h,然后按照8%接種量接入發酵罐BSM培養基中發酵培養。(2)發酵控制。甘油生長階段流加氨水控制pH5.5,溫度設定為30℃。甘油耗盡后通過流加含12mL/L微量鹽(PTM1)培養基的50%的甘油增加菌濃,控制相同菌體OD600(200左右)開始誘導,根據實驗需求和測量的菌濃控制不同的甲醇流加速率3.5g/(L·h)、5.5g/(L·h)、7.5g/(L·h)進行相應的甲醇補料誘導植酸酶表達。此時,流加氨水控制pH6.0,溫度設定為25℃。每隔8h取樣測測量。(3)分析方法。生長檢測。用OD600表示菌體生長,取發酵液利用UV2350型紫外分光光度儀,在波長600nm處檢測吸光值。
酶活測定。酶活測定采用鉬釩酸銨法[11]。
2 結果與討論
2.1 甲醇流加速率為3.5g/(L·h)時的發酵情況
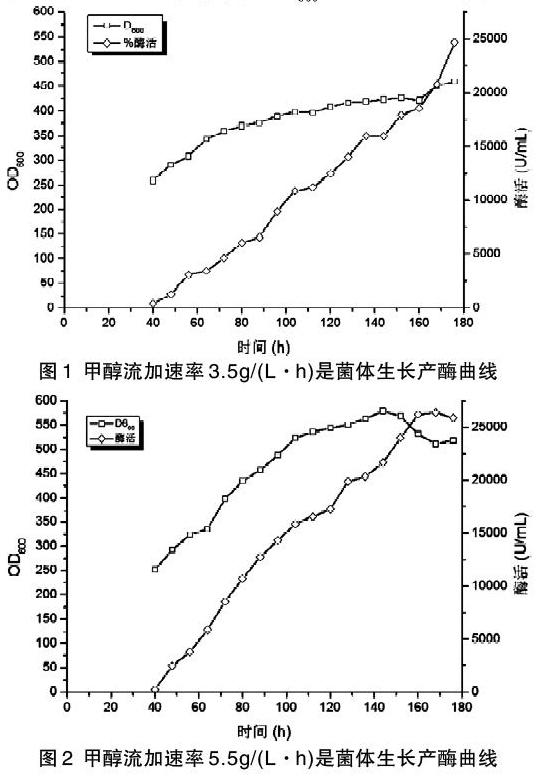
發酵液底料中含有4%的甘油,甘油耗盡之后DO回升,此時開始流加50%的甘油直至誘導所需OD600為250(大約發酵時間30h),之后停止流加甘油,饑餓60min左右,開始流加甲醇誘導產酶。初始甲醇流加速度為1g/(L·h),每兩小時提高0.5g/(L·h),直到甲醇流加速度為3.5g/(L·h)時,停止繼續提高,并以該流速流加至發酵結束。該流加速度下的發酵情況如圖1。
由圖1可知,發酵到40h,菌體OD600達到259,開始流加甲醇誘導產酶,隨后菌體OD600和酶活隨發酵時間增加而增加,發酵至176h下罐時,菌體OD600達到460,植酸酶酶活達到24698U/mL。
2.2 甲醇流加速率為5.5g/(L·h)時的發酵情況
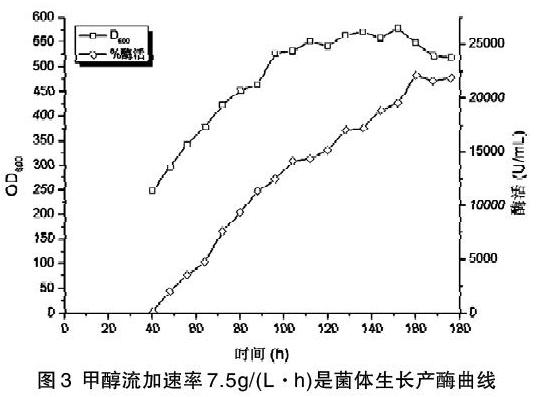
甲醇誘導產酶之前的過程同2.1。初始甲醇流加速度為1g/(L·h),每兩小時提高0.5g/(L·h),直到甲醇流加速度為5.5g/(L·h)時,停止繼續提高,并以該流速流加至發酵結束。該流加速度下的發酵情況如圖2。
由圖2可知,發酵到40h,菌體OD600達到252,開始流加甲醇誘導產酶,隨后菌體OD600和酶活隨發酵時間增加而增加,發酵至144h菌體OD600達到最大579,發酵至168h酶活達到最大26386U/mL,相較于甲醇流加速率3.5g/(L·h)酶活提高了6.83%,OD600提高了25.87%。發酵至176h下罐時,菌體OD600為511,酶活25864U/mL。
2.3 甲醇流加速率為7.5g/(L·h)時的發酵情況
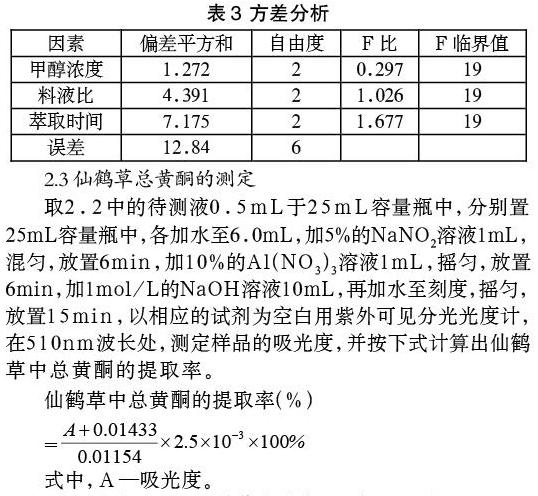
甲醇誘導產酶之前的過程同2.1。初始甲醇流加速度為1g/(L·h),每兩小時提高0.5g/(L·h),直到甲醇流加速度為7.5g/(L·h)時,停止繼續提高,并以該流速流加至發酵結束。該流加速度下的發酵情況如圖3。
由圖3可知,發酵到40h,菌體OD600達到238,開始流加甲醇誘導產酶,隨后菌體OD600和酶活隨發酵時間增加而增加,發酵至152h菌體OD600達到最大578,發酵至160h酶活達到最大22108U/mL,相較于甲醇流加速率3.5g/(L·h)OD600提高了25.65%但酶活降低了10.49%,而相較于甲醇流加速率5.5g/(L·h)OD600相近,但酶活降低了16.21%。發酵至176h下罐時,菌體OD600為518,酶活21863U/mL。
綜合以上分析,可以推斷出甲醇流加速率3.5g/(L·h)條件下,甲醇流加量不足,菌體的生長和酶活都受到限制。甲醇流加速率7.5g/(L·h)條件下,雖然菌體生長所需的營養充足,菌體生長不再受限,但甲醇積累量偏高,抑制了植酸酶酶活。甲醇流加速率5.5g/(L·h)條件下菌體生長所需營養物質充足,植酸酶酶活也未受到影響,因此,甲醇流加速率5.5g/(L·h)最適合畢赤酵母工程菌GAY1發酵生產植酸酶。
3 結語
該試驗通過控制溫度、pH等,改變誘導階段甲醇流加速率的發酵條件,探討了畢赤酵母工程菌GAY1發酵生產植酸酶的生長與產酶規律,發現5.5g/(L·h)甲醇流加速率條件下,菌體在整個發酵過程中菌體生長和植酸酶酶活都處于更理想的狀態,得出結論:甲醇流加速率5.5g/(L·h)最適合于畢赤酵母工程菌GAY1發酵生產植酸酶。該試驗確定畢赤酵母工程菌發酵過程中甲醇流加速率的控制策略,建立了基因工程菌株產植酸酶能力的評價體系,對植酸酶的實際工業發酵生產具有參考價值。
參考文獻
[1] 王仁華,謝益根,練小華.淺談植酸酶在動物生產中的應用[J].江西飼料,2016(05):8-10.
[2] Lei X G, Weaver J D, Mullaney E, et al. Phytase, a new life for an “old” enzyme[J]. Annu. Rev. Anim. Biosci.,2013,1(1):283-309.
[3] 趙凱,葛菁華,王海.不同比生長速率對畢赤酵母發酵生產植酸酶的影響[J].山東科學,2018,31(05):43-47.
[4] 趙凱,葛菁華,王海.不同濕重誘導對畢赤酵母發酵生產植酸酶的影響[J].山東科學,2018,31(04):85-88+109.
[5] 閔兆升,郭會明,張志強,洪厚勝.重組畢赤酵母產植酸酶發酵條件的優化[J].生物加工過程,2015,13(03):31-35.
[6] 黃魁英,夏楓耿,黃樂天,明飛平,杜少平.耐高溫植酸酶畢赤酵母工程菌發酵中試條件優化[J].現代食品科技,2011,27(10):1238-1241.
[7] 李清亮,周月涵,丁健,段作營,金堅,李華鐘.畢赤酵母GS115表達HSA-GCSF~m的誘導工藝研究[J].工業微生物,2016,46(02):8-13.
[8] 陳多,張湜,陳文亮,嚴明.畢赤酵母表達鼠李糖苷酶的甲醇流加方式優化[J].食品工業科技,2013,34(09):157-159+163.
[9] 王水蓮,張建勇,劉杰,高振.不同甲醇流加策略對重組畢赤酵母發酵生產腺苷蛋氨酸的影響[J].齊魯藥事,2006(12):756-757.
[10] Khatri N K , Hoffmann F . Impact of methanol concentration on secreted protein production in oxygen-limited cultures of recombinant Pichia pastoris[J]. Biotechnology & Bioengineering,2010,93(5):871-879.
[11] 楊平平,王燕,史寶軍,陶文沂.對發酵生產植酸酶過程中植酸酶活性測定方法的初步探討[J].食品與發酵工業,2003(09):52-55.

